Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Биохимия белков
Внутриклеточное превращение аминокислот и синтез мочевины
Аминокислоты, не использованные непосредственно для синтеза белка или образовавшиеся при внутриклеточном распаде белков, подвергаются дальнейшим превращениям.
Основные реакции превращения аминокислот
Имеется несколько типов реакций превращения аминокислот, характерных для внутриклеточного обмена. Это реакции дезаминирования, трансаминирования (переаминирования) и декарбоксилирования.
Дезаминирование аминокислот связано с потерей NH2-гpyппы и образованием свободного аммиака и кетокислот. Реакции дезаминирования протекают при участии ферментов дезаминаз или оксидаз. Кроме аммиака, при дезаминировании аминокислот образуются окси- и кетокислоты. Различают несколько видов процесса дезаминирования: восстановительное, гидролитическое, внутримолекулярное и окислительное. У животных и человека преобладают два последних вида дезаминирования.
Окислительное дезаминирование аминокислот интенсивно протекает при увеличении потребления энергии в клетке, так как эта реакция сопровождается извлечением энергии в виде высокоэнергетического Н2 в составе восстановленного НАДН2 или ФАДН2. Наиболее активно окислительному дезаминированию подвергается глутаминовая кислота, что связано с высокой активностью глутаматдегидрогеназы, обнаруженной почти во всех тканях:
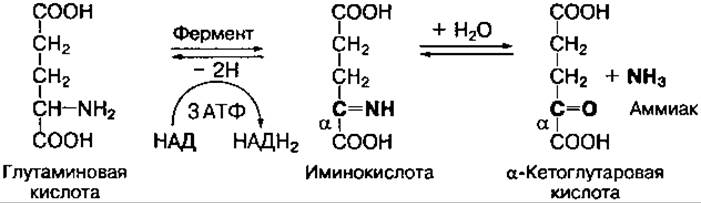
Фермент глутаматдегидрогеназа катализирует как реакцию дезаминирования, так и обратимую реакцию — аминирования, что приводит к образованию глутаминовой кислоты из аммиака и а-кетоглутаровой кислоты. Этот процесс называется восстановительным аминированием.
Трансаминирование аминокислот — это реакция переноса аминогруппы с аминокислоты на кетокислоту. Такие реакции обратимы и получили название "переаминирование", или "трансаминирование". В ходе реакций трансаминирования образуются новые амино- и кетокислоты:
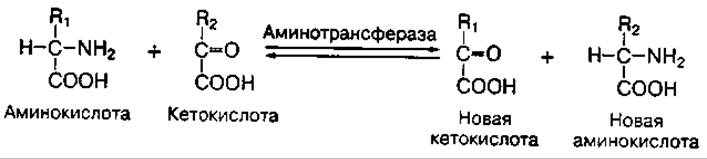
В настоящее время изучено более 60 реакций трансаминирования. Они катализируются сложными ферментами аминотрансферазами, коферментом которых является фосфопиридоксаль (витамин В6).
Реакциям трансаминирования принадлежит решающая роль в азотистом обмене организма, так как при этом образуются новые кислоты. Эти реакции поставляют в печень почти половину аммиака, который обезвреживается в процессе синтеза мочевины и выводится из организма как конечный продукт азотистого обмена.
Декарбоксилирование аминокислот — это также один из путей превращения аминокислот в тканях, связанный с отщеплением карбоксильной группы и выделением углекислого газа (СО2). При декарбоксилировании монокарбоновых аминокислот образуются амины и CО2. Функционально важной реакцией такого типа является декарбоксилирование аминокислоты гистидина, ведущее к образованию тканевого гормона гистамина:
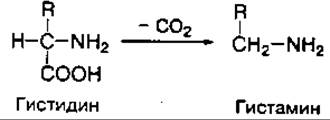
Реакции декарбоксилирования катализируются ферментами — декарбоксилазами аминокислот, коферментом которых является также фосфопиридоксаль (витамин В6). Декарбоксилирование аминокислот — необратимый процесс превращения аминокислот, который приводит к образованию биогенных аминов, отличающихся чрезвычайной биологической активностью.
Многие аминокислоты и продукты их превращения могут вступать в цикл окисления или биосинтеза других классов веществ (см. главу 13).
Превращение отлельных аминокислот в углеводы и жиры
Аминокислоты имеют разные углеродные скелеты и свои метаболические пути превращения. В процессе катаболизма они могут превращаться в отдельные метаболиты цикла лимонной кислоты, в пировиноградную кислоту либо в ацетил-КоА (рис. 98). В дальнейшем эти метаболиты могу превращаться в глюкозу либо в жирные кислоты и кетоновые тела. Аминокислоты, из которых в процессе глюконеогенеза образуется глюкоза называются глюкогенными, а из которых образуются жирные кислоты и кетоновые тела — кетогенными. Часть аминокислот окисляется до конечных продуктов обмена СО2 и Н2О с накоплением энергии. Однако аминокислоты обеспечивают только 10—15 % энергопотребления организма.
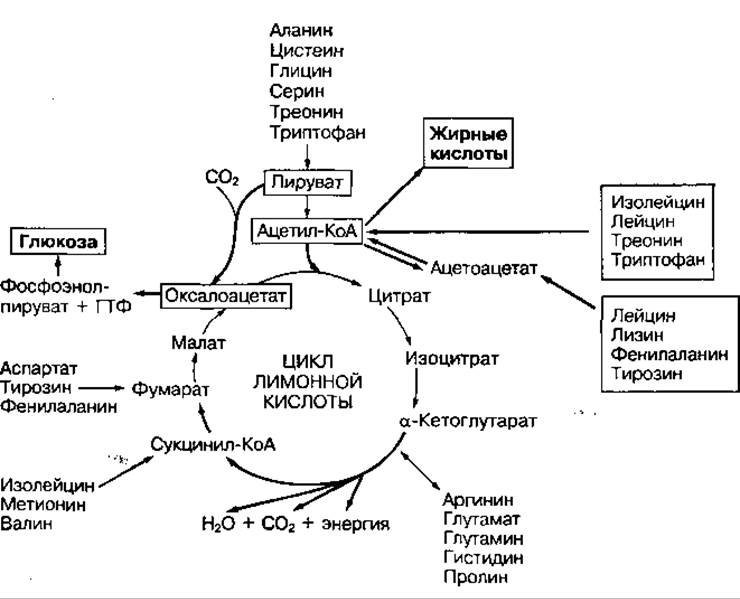
Рис. 98 Превращение аминокислот и их использование для синтеза глюкозы и жирных кислот (в рамках) — кетогенные кислоты, из которых могут синтезироваться жирные кислоты и жиры; без рамок — глюкогенные аминокислоты, превращающиеся в углеводы
Мочевина — основной конечный продукт распада белков и нуклеиновых кислот
В процессе катаболизма белков и нуклеиновых кислот, в частности при дезаминировании аминокислот, в тканях организма образуется свободный аммиак (NH3), а также кетокислоты и другие вещества.
Свободный аммиак — токсичное для организма человека веществе особенно для мозга. Токсичность его связана с возможным локальным изменением pH в отдельных частях клетки или заряда на клеточной мембране. Поэтому в организме существует несколько механизмов связывания и обезвреживания свободного аммиака. Непосредственное связывание аммиака в тканях, где он образуется, осуществляется с участием глутаминовой и аспарагиновой аминокислот, которые превращаются в амиды — глутамин и аспарагин. Реакция связывания требует энергии АТФ и катализируется глутамин- или аспарагинсинтетазами:
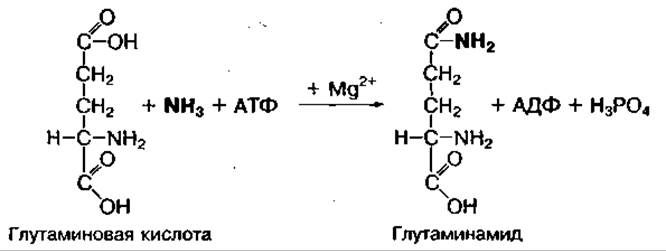
Амиды являются временной формой обезвреживания аммиака. Они легко проникают через клеточные мембраны и доставляют аммиак в печень. В печени глутамин легко превращается в глутаминовую кислоту и свободный аммиак:
![]()
Доставленный в печень аммиак обезвреживается в процессе синтеза мочевины. Часть свободного аммиака в клетках связывается в процессе образования новых аминокислот. Так, щавелевоуксусная кислота может связать NH3, в результате чего образуется аспарагиновая кислота, которая также участвует в обезвреживании аммиака, так как ее аминогруппа используется в процессе синтеза мочевины.
Процесс синтеза мочевины — сложный ферментативный цикл, начинающийся с реакции, в которой участвует аминокислота орнитин, поэтому он называется орнитиновым циклом. Цикл представлен на рис. 99 и включает 5 основных реакций.
Первой реакцией является взаимодействие молекул свободного аммиака (NH3) и углекислого газа (СО2) с участием АТФ. В ходе этой реакции образуется высокоэнергетический карбамилфосфат (1), который далее вступает во взаимодействие с аминокислотой орнитин с образованием цитрулина и фосфорной кислоты (2). Эти реакции протекают в митохондриях. Образовавшийся цитрулин из митохондрий поступает в цитоплазму, где взаимодействует с молекулой аспарагиновой кислоты (аспартат), которая поставляет вторую аминогруппу для синтеза мочевины (3). В этой реакции используется энергия молекулы АТФ и образуется сложное вещество — аргининоянтарная кислота (аргининосукцинат). Аргининоянтарная кислота ферментативно расщепляется на фумаровую кислоту (фумарат) и аргинин (4). Аргинин под действием высокоспецифического фермента аргиназы расщепляется на мочевину и орнитин (5). Образовавшийся орнитин может вступать во взаимодействие с новой молекулой карбамилфосфата, а мочевина выводится из организма. Суммарное уравнение синтеза мочевины имеет вид
![]()
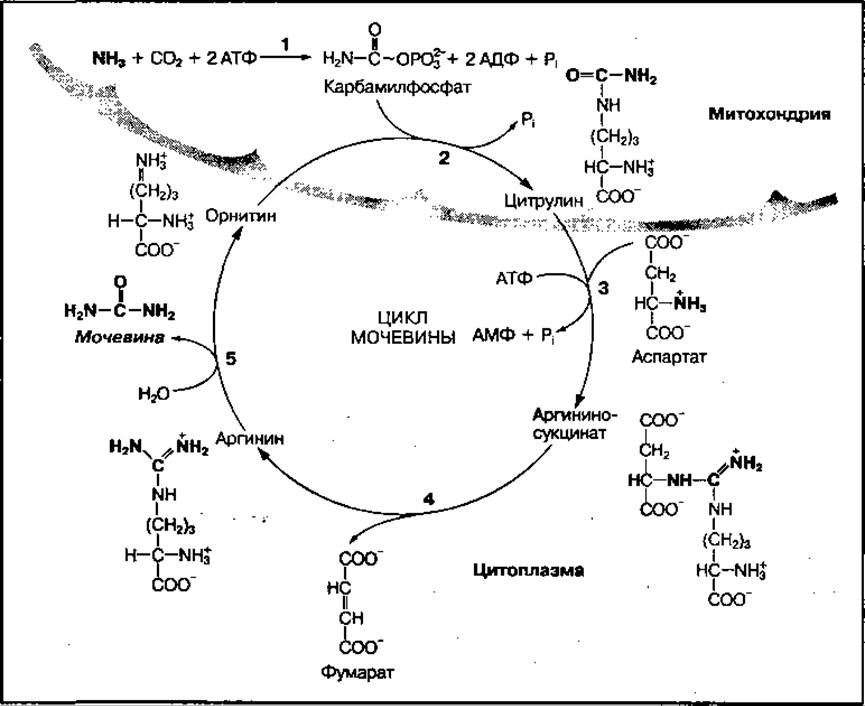
Рис. 99 Реакции синтеза мочевины
Мочевина является основным конечным продуктом обмена белков и других азотсодержащих веществ. С мочевиной выводится около 10—18 г общего азота организма человека, тогда как с аминокислотами — до 1,15 г, амминийными солями — до 1 г, креатином — до 0,8 г, мочевой кислотой — до 0,2 г. Мочевина из печени поступает в кровь, затем в почки и выводится с мочой.
Содержание мочевины в норме в крови взрослых людей индивидуально и составляет 3,5—6,5 ммоль ⋅ л-1 (20—30 мг%). По изменению ее содержания в крови диагностируют скорость процесса распада тканевых белков. В практике спорта мочевина широко используется как биохимический показатель процессов восстановления в организме после физических нагрузок (см. главу 24).