Основы биохимии - А. А. Анисимов 1986
Ферменты (энзимы)
Общие принципы строения ферментов
До начала XX столетия сведений относительно химической природы ферментов было очень мало, но уже тогда высказывались предположения о белковой природе ферментов. Такой точки зрения придерживался профессор Московского университета Н. Е. Лясковский, позднее аналогичное мнение высказывали академик И. П. Павлов, немецкий химик Э. Фишер и др., однако экспериментального подтверждения эти предположения не имели. Иной взгляд был у известного немецкого химика Р. Вильштеттера, добившегося больших успехов в выделении и очистке ферментов. Изучая свойства выделенных ферментов, Р. Вильштеттер пришел к выводу, что они относятся к особому классу веществ и состоят из двух компонентов: низкомолекулярной активной части (агон) и высокомолекулярного носителя (ферон).
В 20—30-х годах XX столетия стало появляться все больше данных, свидетельствующих о том, что ферменты — это белки. В 1926 г. Д. Самнером (США) из семян канавалии был выделен фермент уреаза в виде кристаллического белка. Несколько позже в 1931 г. Д. Нортроп (США) получил кристаллический пепсин. Этими работами была окончательно доказана белковая природа ферментов. Признанием больших заслуг Д. Самнера и Д. Нортропа в области энзимологии было присуждение им в 1946 г. Нобелевской премии.
Относительная молекулярная масса белков, обладающих ферментативными свойствами, колеблется от 15 тысяч до нескольких миллионов. Для ферментативных белков характерны те же физико-химические свойства, что и для белков, не наделенных этими функциями. Ферменты являются глобулярными белками, их молекулы могут быть представлены как простыми, так и сложными белками. В первом случае ферменты называют однокомпонентными, во втором — двухкомпонентными.
Белковая часть двухкомпонентных ферментов называется апоферментом, а молекула в целом — холоферментом. Небелковые компоненты, легко диссоциирующие из комплекса с ферментативным белком, принято называть коферментами. Они действуют как акцепторы (или доноры) атомов или функциональных групп, удаляющихся от субстрата (или присоединяющихся к нему). В связи с этим считают, что более правильно рассматривать коферменты как косубстраты. Это хорошо видно из следующих реакций (Е — фермент, К — кофермент, АН2, В — субстраты):
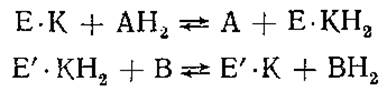
Прежде чем сможет окислиться новая молекула АН2, кофермент КН2 должен возвратиться в исходное состояние К. Это осуществляется при участии другого фермента Е', на который переходит восстановленный кофермент.
Если небелковая часть фермента прочно связана с белком и в цикле биохимических реакций не отсоединяется от него, ее принято называть простетической группой. Однако резкой границы между коферментами и простетическими группами не существует, степень прочности связи ферментативных белков с небелковыми компонентами широко варьирует.
Небелковые компоненты ферментативной молекулы принято называть также кофакторами. Соединение белковой части фермента и небелковой может осуществляться за счет ионных, водородных связей, гидрофобных взаимодействий, реже — с помощью ковалентных связей.
Функциями коферментов и простетических групп являются: 1) участие в акте катализа, 2) осуществление контакта между ферментативным белком и субстратом, 3) стабилизация апофермента. Апофермент, в свою очередь, усиливает каталитическую активность небелковой части и, кроме того, определяет специфичность действия ферментов, поскольку одна и та же по химизму небелковая часть может функционировать в составе различных ферментов. Например, НАД+ является коферментом многих дегидрогеназ — лактатдегидрогеназы (ЛДГ), малатдегидрогеназы (МДГ) и др.; они отличаются апоферментной, белковой частью молекулы.