Основы биохимии - А. А. Анисимов 1986
Нуклеиновые кислоты
Синтез ДНК
4.7.1. Полуконсервативная репликация ДНК. Д. Уотсон и Ф. Крик не только разработали модель структуры ДНК, соответствующую всем экспериментальным данным, но и предложили гипотезу механизма синтеза ДНК путем удвоения (репликации). Согласно этому механизму двухцепочечная молекула ДНК сначала разделяется вдоль, две ее цепи расходятся. На каждой старой цепи образуется новая цепь. При этом нуклеотиды новых цепей спариваются комплементарно с нуклеотидами старых цепей, так что старые цепи служат матрицами. Так образуются две дочерние двухцепочечные молекулы ДНК совершенно одинаковые, идентичные родительской молекуле. В каждой дочерней молекуле одна цепь получена от родительской ДНК, а вторая синтезирована заново. Этот путь синтеза получил название полуконсервативной репликации.
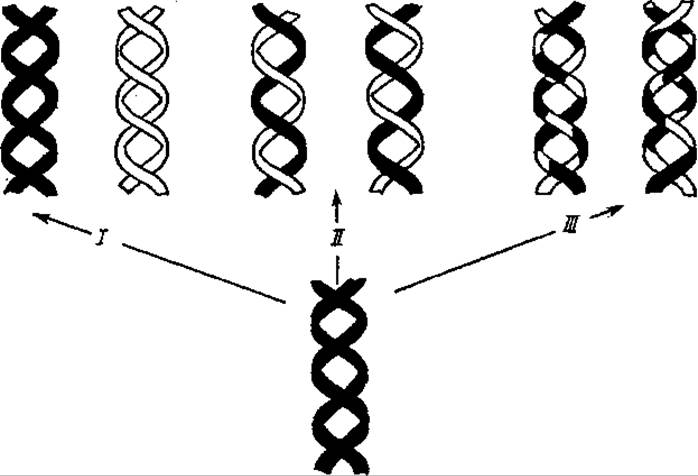
Рис. 4.14. Возможные способы воспроизведения ДНК:
I — консервативный, ІІ — полуконсервативный. ІІІ — дисперсный
Однако теоретически возможны еще два механизма разделения ДНК между дочерними клетками поровну, получившие название консервативной и дисперсной репликации. При консервативной репликации на двух цепях родительской молекулы ДНК, без их разделения, синтезируется новая молекула ДНК. Дисперсный механизм предполагает дробление молекул ДНК, в результате которого каждая отдельная цепь новых дочерних молекул содержит в себе участки как старой, так и новой цепи ДНК (рис. 4.14).
М. Месельсон и Ф. Сталь (1958) в опытах с Е. coli доказали, что в клетке репликация ДНК происходит полуконсервативным способом. Они выращивали Е. coli на синтетической среде, содержащей глюкозу и соли. Источник азота NH4Cl вместо обычного легкого азота 14N содержал тяжелый 15N, так что все азотсодержащие вещества бактерий, в том числе и ДНК, становились «тяжелыми». Затем бактериальные клетки отмывали и переносили на «легкую» питательную среду, содержащую изотоп азота 14N, где происходил их дальнейший рост. Через различные промежутки времени из бактерий выделяли ДНК и центрифугировали ее в градиенте плотности CsCl. Для нулевого-поколения была получена единственная полоса, соответствующая 15N-ДНК. После кратковременного роста, в течение которого число клеток удваивалось, в градиенте появилась другая, более легкая полоса. Плотность ее соответствовала гибридной молекуле ДНК, которая содержит равное количество 15N и 14N. По-видимому, цепи с 14N были вновь синтезированными. Это именно тот результат, которого следовало ожидать, исходя из полуконсервативного механизма. После репликации ДНК, завершения двух циклов деления бактерий, в градиенте плотности обнаруживали две полосы ДНК разной плотности. Одна из этих полос соответствовала гибридной ДНК, содержащей 15N и 14N, вторая — ДНК, содержащей обе цепи с 14N. Эти данные убедительно доказывают, что синтез ДНК происходит полуконсервативным способом.
4.7.2. Репликация ДНК как многоступенчатый процесс. Для того чтобы ДНК могла реплицироваться полуконсервативным способом, она должна разделиться на составляющие ее цепи. Установлено, что цепи ДНК раскручиваются не по всей длине, а на коротком участке. Здесь образуется вилка репликации — место удвоения ДНК. Перемещение репликационной вилки возможно только при раскручивании двухспиральной ДНК (хеликса) и закручивании двух дочерних молекул. Конформацию хеликса изменяет ряд ферментов; их делят на три группы.
Первую группу составляют хеликазы — белки, расплетающие двойную спираль и удерживающие одиночные цепи от воссоединения. К ним у Е. coli относятся связывающий белок и rер-белок.
Вторая группа — свивелазы (топоизомеразы I, или релаксирующие белки). С их помощью устраняется суперспирализация ДНК (т. е. они выполняют функцию шарнира). Свивелазы вносят в одну из цепей ДНК разрыв, благодаря чему делается возможным раскручивание этой цепи с последующим замыканием разрыва. К ним у Е. coli относится ω-белок.
Третью группу составляют жиразы (гиразы) — топоизомеразы II. Они вызывают негативную суперспирализацию в кольцевой ДНК путем разрыва одной связи, вращения цепи и замыкания связи. Фактически тоже выполняют функцию шарнира.
В репликационной вилке Е. coli rep-белок дестабилизирует двойную спираль ДНК, а связывающий белок присоединяется к одноцепочечным участкам, обеспечивая им роль матриц. Жиразы, видимо, способствуют формированию левозакрученных, т. е. (—) сверхспиралей, что создает (—) сверхспиральное давление на вилку, и облегчает работу хеликаз.
Геномы фагов и бактерий реплицируются как единое целое. Они представляют собой организованные единицы репликации, так называемые репликоны. Репликон имеет начало — ori (от англ. origin — начало), ориентированное направление и иногда терминальный участок — ter.
Репликация начинается в участке ori. Здесь цепи ДНК расходятся, образуются две репликационные вилки, в которых синтезируются новые цепи ДНК. Если ДНК имеет кольцевую форму, то репликационные вилки передвигаются навстречу друг другу до тех пор, пока ДНК це будет скопирована полностью (или до точки ter). У некоторых плазмид обнаружена однонаправленная репликация, при которой одна репликационная вилка движется в определенном направлении.
Процесс репликации ДНК делится на три основных этапа: 1) инициация, 2) элонгация, или рост цепи, 3) терминация. Согласно электронно-микроскопическим, радиоавтографическим и генетическим данным, в репликационной вилке с большой скоростью осуществляется синтез двух противоположно ориентированных цепей ДНК. Направление одной цепи 5'→3' совпадает с направлением движения вилки, эту цепь называют лидирующей. Вторая цепь называется запаздывающей. В 1968 г. Р. Оказаки и сотрудники показали, что синтез ДНК происходит на обеих цепях матричной ДНК в направлении 5'→3' и идет прерывисто, отдельными фрагментами размером в 1—2 тыс. нуклеотидов. В дальнейшем эти фрагменты получили название фрагментов Оказаки. В лидирующей цепи ДНК образуются более крупные фрагменты, направление их роста 5'→3' совпадает с направлением движения вилки репликации. С течением времени фрагменты Оказаки укрупняются и, наконец, образуют непрерывные дочерние цепи ДНК. Допускают даже, что у Е. coli лидирующая цепь растет непрерывно. В запаздывающей цепи ДНК образуются короткие фрагменты, в связи с чем многократно осуществляется инициация синтеза.
Синтез ДНК проводят ДНК-полимеразы, праймерами для которых in vivo служат фрагменты РНК.
Важную роль в инициации репликации в точке оrі играет белок В. После расплетания двойной спирали В-белок связывается в участке ori с матрицей лидирующей цепи; инициирует ее праймер, затем перемещается в противоположном направлении и обеспечивает инициацию праймеров запаздывающей цепи. Таким образом, ß-белок выполняет у E. coli функции «мобильного промотора», т. е. участка инициации транскрипции.
Синтез праймеров осуществляют ферменты примазы (специальные РНК-полимеразы). 3'-Конец РНК-праймера используется примазой для инициации фрагмента ДНК, дальнейшая его элонгация проводится холоэнзимом ДНК-полимеразы III. Поэтому каждый фрагмент Оказаки начинается фрагментом РНК в 50— 200 нуклеотидов, который затем удаляется. Удаление праймеров из фрагментов Оказаки у Е. coli проводит ДНК-полимераза I, она же застраивает образовавшиеся бреши. Укрупнение фрагментов. Оказаки путем их сшивания происходит с участием ДНК-лигазы (рис. 4.15).
Механизмы терминации репликации исследованы недостаточно. В ДНК Е. coli для терминации существует специальный участок — герминатор. В геноме ряда бактериофагов терминаторы отсутствуют, двусторонняя репликация завершается, видимо, после встречи двух вилок и реплицирующих комплексов.
Детали репликации хромосом эукариот изучены недостаточно, однако общие черты процесса можно представить следующим образом. Хромосома эукариот — это полирепликонная структура, т. е. в ней есть множество независимых репликонов, каждый из которых содержит начало и терминатор. Смежные репликоны ориентированы противоположно, после завершения репликации их реплики, т. е. синтезированные комплементарные нити, сливаются. Размеры репликонов составляют от 10 до 100 мкм, что отвечает 3х104—3х105 нуклеотидных пар. Высокая скорость репликации обеспечивается образованием большого числа репликационных вилок.
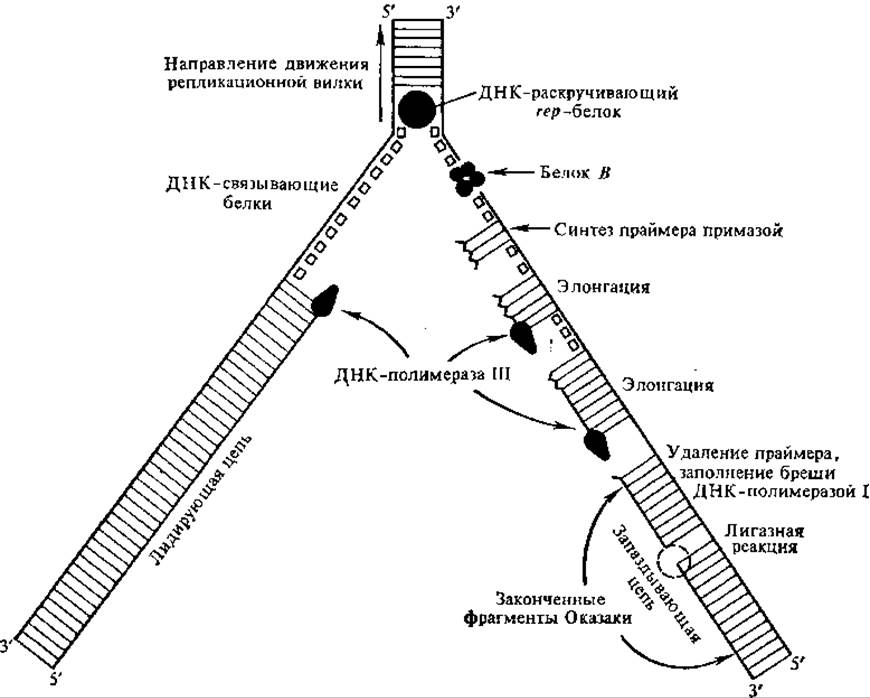
Рис. 4.15. Репликационная вилка ДНК coli (показаны стадии репликации и участвующие в ней белки)
Полуконсервативная репликация инициируется в участке оri путем надрезания одной из цепей сверхспиральной молекулы и, как следствие, разделения цепей ДНК. Здесь формируется репликационная вилка. В вилке по лидирующей цепи ДНК идет непрерывный синтез, по запаздывающей — дискретный. Фрагменты Оказаки имеют размер от 40 до 290 нуклеотидов (в среднем 135), праймеры — около 9 нуклеотидов. Механизм репликации, по-видимому, сходен с таковым у прокариот. Синтез ДНК проводит ДНК-полимераза а. Выделены и другие ферменты клетки, выполняющие функции, сходные с функциями ферментов репликации прокариот.
Особенности репликации ДНК в хромосомах связаны с нуклеосомной организацией последних. Когда вилка репликации проходит через нуклеосомный участок ДНК» этот участок «развивается» с помощью хеликсдестабилизирующих ферментов. После прохождения вилки формируются две новые двойные спирали, восстанавливается нуклеосомная структура.
Репликация геномов вирусов и фагов часто осуществляется путем использования ферментов клетки хозяина. Однако она может быть организована иначе, чем у бактерий.
В инфицированных плазмидами бактериях нередко обнаруживаются олигомерные геномы плазмид. Несколько одинаковых репликонов одной плазмиды оказываются объединенными в одной молекуле ДНК. Образование таких форм объясняет модель репликации ДНК, получившая название «катящегося кольца» (рис. 4.16). Согласно этой модели, одна цепь двухспиральной кольцевой молекулы ДНК разрывается, и ее 5'-конец прикрепляется к мембране клеточной стенки. Затем происходит полуконсервативная репликация, в ходе которой вторая цепь сохраняет кольцевую форму: она как бы «катится», представляя собой бесконечную матрицу. Если репликация завершится в той же точке, откуда она началась, то будет синтезирован геном-мономер, если же кольцо «покатится» дальше, то появятся олигомеры, содержащие несколько геномов. Такие продукты репликации могут мономеризоваться и приобретать кольцевую форму за счет рекомбинации. Предполагают, что репликация по механизму «катящегося кольца» осуществляется у ряда бактериофагов Е. coli, например Р2, P22, T4, λ, у бактерий при конъюгации. В клетках эукариот с помощью этого механизма протекает амплификация, т. е. избирательная многократная репликация генов. Примером служит амплификация генов, кодирующих рРНК в ооцитах Xenopus.
А. Корнберг (1977) предполагает, что ферменты, участвующие в синтезе ДНК, объединены в комплекс. Они образуют частицы диаметром 8—12 нм, связанные с мембраной клетки посредством гидрофобных взаимодействий. Комплекс называется реплисома.
После того как цепи ДНК построены, ДНК-метилазы метилируют их, придавая ДНК видовую специфичность. ДНК-гираза катализирует образование супервитков.
4.7.3. Репарация повреждений ДНК. Химические и физические факторы внешней среды могут вызвать повреждение ДНК. Так, например, ультрафиолетовое облучение в больших дозах оказывает летальное, в малых — антимитотическое и мутагенное действие. При этом в молекуле ДНК возникает ряд изменений: происходит дезаминирование цитозина, он превращается в урацил, что может привести к возникновению мутации; тиминовые основания образуют димеры — двойные тиминовые кольца; появляются участки локальной денатурации ДНК, которые препятствуют репликации ДНК.
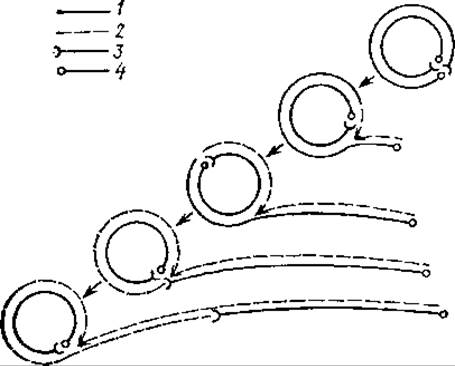
Рис. 4.16. Репликация ДНК по механизму «катящегося кольца» (по Г. Мейнеллу, 1976);
1 — исходная двухспиральная молекула, 2 — вновь синтезированные спирали, 3 — 3'-конец, 4 — 5'-конец
В процессе эволюции в клетках живых организмов выработались механизмы репарации повреждений ДНК. Один из процессов репарации протекает с участием света, это фотореактивация. Известен фермент, соединенный с хромофором, который поглощает видимый свет, доставляя необходимую для осуществления реакции энергию. Фермент специфически связывается с тиминовым димером, расщепляет его, а затем отделяется от ДНК. Функции ДНК восстанавливаются примерно на 90%.
Другой изученный процесс — темповая (эксцизионная) репарация ДНК, т. е. репарация, связанная с удалением поврежденного участка. Специфическая эндонуклеаза распознает повреждение и надрезает нить ДНК вблизи тиминового димера. Другой фермент — УФ-эндонуклеаза — вырезает олигонуклеотид, содержащий тиминовый димер. ДНК-полимераза I (или в других случаях ДНК-полимераза II) заполняет образовавшуюся брешь путем включения нуклеотидов. Фермент ДНК-лигаза замыкает фосфодиэфирную связь между вновь синтезированным фрагментом и остальной ДНК. Посредством темновой репарации может происходить исправление множества потенциально летальных нарушений генома. Так, у бактерий она может устранять разрывы полинуклеотидных цепей ДНК, вызванные действием рентгеновских лучей. При темновой репарации могут удаляться сшивки пуриновых оснований в ДНК, вызванные действием иприта. Таким образом, системы репарации повышают стабильность носителя наследственной информации — ДНК.
Некоторые редкие наследственные заболевания человека связаны с дефектами в репарации повреждений ДНК. К ним относится пигментная ксеродерма. Больные ксеродермой повышенно чувствительны к солнечному свету, у них часто возникает рак кожи. Если культуры клеток кожи таких больных подвергнуть ультрафиолетовому облучению, то скорость выщепления димеров тимина у этих клеток будет меньше, чем у клеток кожи нормальных людей. У одной группы больных, страдающих ксеродермой, отсутствует активность УФ-эндонуклеазы. У другой группы больных клетки не способны репарировать ДНК, имеющую однонитевые разрывы, что связано, по-видимому, с отсутствием ДНК-полимеразы I.