Основы биохимии - А. А. Анисимов 1986
Углеводы
Превращения углеводов, связанные с дыханием и брожением
6.9.1. Гликолиз. Стадии и реакции гликолиза. Гликолиз — это анаэробный процесс, приводящий к распаду одной молекулы глюкозы на две молекулы молочной кислоты. При этом освобождается энергия, которую организм аккумулирует в форме АТФ. Реакции гликолиза протекают в цитозоле, без потребления кислорода. В анаэробных условиях гликолиз — единственный процесс в организме животных, растений и многих бактерий, поставляющий энергию.
При аэробном расщеплении глюкозы один из конечных продуктов гликолиза — пировиноградная кислота окисляется до СO2 и Н2O в цикле трикарбоновых кислот (см. разд. 6.9.5). Реакция этого цикла осуществляется в митохондриях (у бактерий — в соответствующих мембранных образованиях) при участии кислорода.
Полная цепь реакций гликолиза была выявлена трудами Л. А. Иванова, С. П. Костычева, А. Н. Лебедева, Г. Эмбдена, Я. О. Парнаса и О. Мейергофа к середине 30-х годов нашего столетия. Эти реакции катализируются группой из одиннадцати ферментов которые хорошо изучены, легко экстрагируются из клеток и катализируют реакции in vitro. Гликолиз протекает в две стадии.
Первая стадия — подготовительная, или собирательная. На этой стадии различные гексозы вовлекаются в гликолиз. Хотя в реакциях гликолиза окисляется главным образом глюкоза, наряду с ней могут вступить в этот процесс другие различные гексозы, например фруктоза, манноза. При этом инертные молекулы гексоз активируются, фосфорилируются за счет АТФ, превращаются в глюкозо-6-фосфат. Этот этап заканчивается образованием глицеральдегид-3-фосфата. Важнейшая роль фосфорной кислоты в процессах анаэробного расщепления глюкозы была впервые установлена в исследованиях русских биохимиков Л. А. Иванова (1901, 1906), А. Н. Лебедева (1905).
Вторая стадия — окислительная. Глицеральдегид-3-фосфат окисляется до пировиноградной кислоты (пируват) или молочной кислоты (лактат). Энергия окисления накапливается в АТФ, образуются восстановительные эквиваленты НАДН.
На схеме (рис. 6.12) представлена полная цепь реакций гликолиза. Она начинается с фосфорилирования D-глюкозы за счет АТФ. Это первая пусковая реакция гликолиза, она является одной из ключевых в этом процессе. Нейтральная молекула D-глюкозы превращается в отрицательно заряженный глюкозо-6-фосфат:
![]()
Эту реакцию катализируют ферменты двух типов, различающиеся по своей специфичности в отношении сахаров, — гексокиназа и глюкокиназа. Гексокиназа играет основную роль, именно она функционирует в большинстве клеток. Гексокиназа способна катализировать фосфорилирование не только D-глюкозы, но также и многих других гексоз, например D-фруктозы, D-маннозы и D-глюкозамина.
Глюкокиназа фосфорилирует только D-глюкозу, к тому же обладает к ней более низким сродством, чем гексокиназа. Глюкокиназа содержится в печени. Она вступает в действие только в том случае, когда концентрация глюкозы в крови очень высока. Обе киназы нуждаются в присутствии двухвалентных катионов (Mg2+ или Мn2+), которые связываются с АТФ, образуя истинные субстраты — MgAТФ2- или МnАТФ2-. В ходе гексокиназной реакции происходит значительное уменьшение свободной энергии, что обеспечивает необратимость этой реакции внутри клетки. Скорость реакции тормозится ее продуктом — глюкозо-6-фосфатом.
Вторая реакция — изомеризация глюкозо-6-фосфата во фруктозо-6-фосфат:
![]()
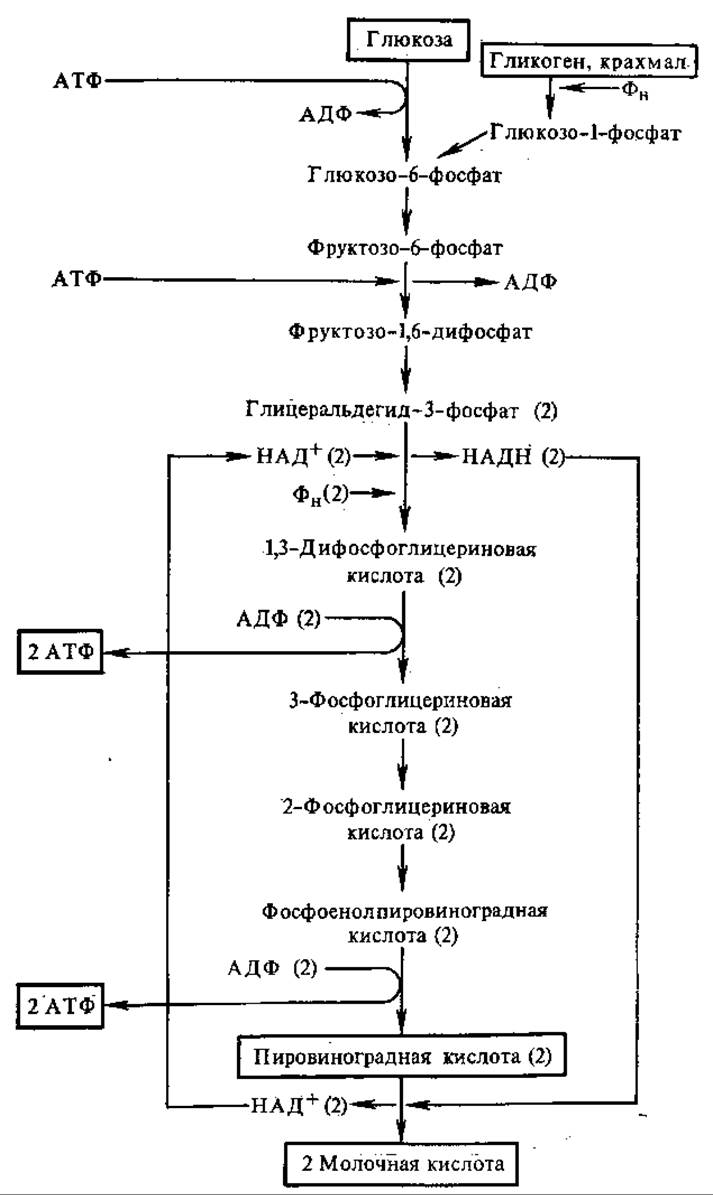
Рис. 6.12. Реакции гликолиза.
В рамки помещены исходные субстраты и конечные продукты гликолиза; цифрами в скобках обозначено число молекул
Третья реакция — фосфорилирование фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата. Это вторая пусковая реакция гликолиза, в ней используется вторая молекула АТФ:
![]()
Реакция необратима, так как происходит значительное уменьшение свободной энергии. Она протекает при участии фермента фосфофруктокиназы в присутствии ионов Mg2+, необходимых, видимо, для образования истинного субстрата, т. е. MgATФ2-. Это наиболее медленная реакция гликолиза, она определяет скорость процесса в целом, на ее уровне в основном осуществляется регуляция. Фосфофруктокиназа относится к числу аллостерических, или регуляторных, ферментов. Она ингибируется АТФ и лимонной кислотой, активируется АДФ и АМФ. В период покоя клетки при высоком отношении АТФ/АДФ активность фосфофруктокиназы понижается, гликолиз замедляется. При функциональной активности клетки количество АТФ уменьшается, и гликолиз ускоряется.
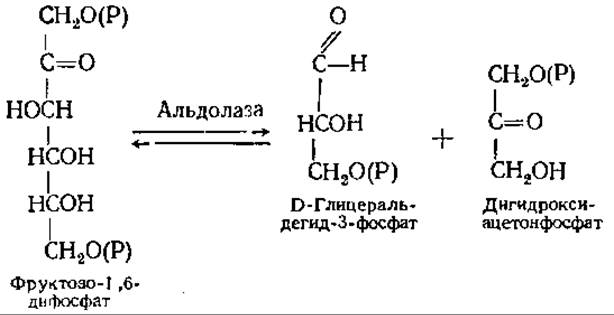
Четвертая реакция — расщепление фруктозо-1,6-дифосфата представляет собой обращенную альдольную конденсацию (см. разд. 6.5.1):
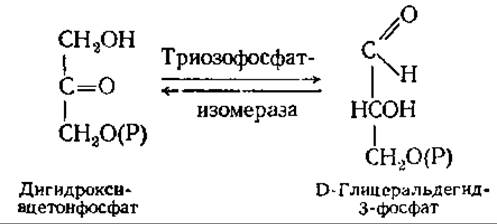
Пятая реакция — изомеризация триозофосфатов. Из образовавшихся триозофосфатов в последующие реакции гликолиза непосредственно включается только один — глицеральдегид-3-фосфат. В него превращается дигидроксиацетонфосфат в обратимой реакции:
Образованием фосфотриоз завершается первая стадия гликолиза. Молекула глюкозы путем двух фосфорилирований и расщепления превратилась в две молекулы фосфотриоз.
Вторая стадия гликолиза включает окислительно-восстановительные реакции и реакции фосфорилирования, в процессе которых генерируется АТФ. На этой стадии окисляются обе молекулы
фосфотриоз, т. е. две половины молекулы глюкозы. Поэтому во всех остальных реакциях впереди формулы субстрата следует поставить коэффициент 2.
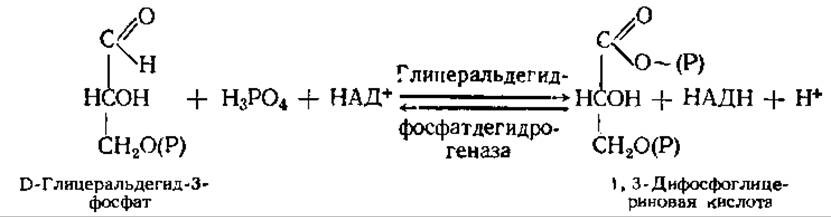
Шестая реакция — центральный этап гликолиза — представляет собой окислительно-восстановительный процесс. Альдегидная группа глицеральдегид-3-фосфата окисляется в СООН-группу 1,3-дифосфоглицериновой кислоты, НАД+ восстанавливается в НАДН. Освобождается энергия, за счет которой образуется высокоэнергетическая связь 1,3-дифосфоглицериновой кислоты. Таким образом, в этой реакции происходит субстратное фосфорилирование. Суммарное уравнение реакции следующее:
Седьмая реакция — богатая энергией фосфорильная группа 1,3-дифосфоглицериновой кислоты (находящаяся в положении 1) переносится на АДФ с образованием АТФ;
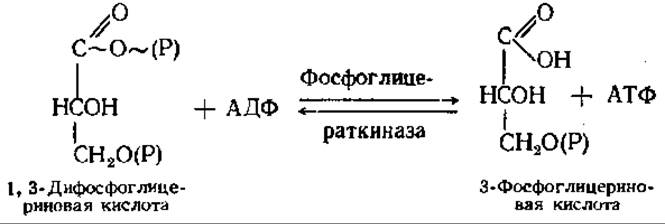
Восьмая реакция — фосфатная группа фосфоглицериновой кислоты переносится из положения 3 в положение 2:
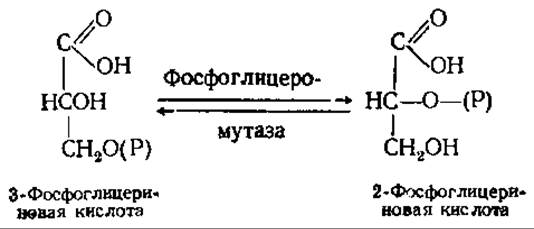
Девятая реакция — внутримолекулярный окислительно-восстановительный процесс: степень окисления С-2 2-фосфоглицериновой кислоты увеличивается, а С-1—уменьшается. В результате образуется высокоэнергетическое соединение фосфоенолпировиноградная кислота. Таким образом, здесь также происходит субстратное фосфорилирование. Формально реакция представляет собой отщепление молекулы воды:
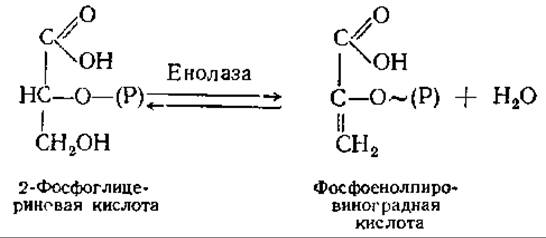
Десятая реакция — перенос фосфорильной группы вместе с высокоэнергетической связью от фосфоенолпировиноградной кислоты на АДФ:
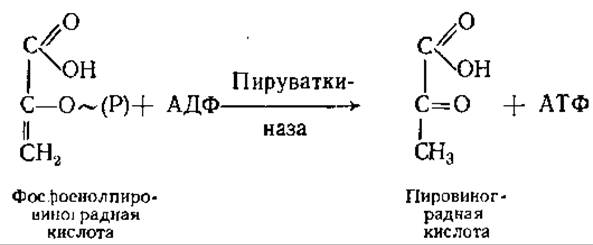
Эта реакция сильно экзергоническая, вследствие чего в клетке она практически необратима.
В одиннадцатой реакции происходит восстановление пировиноградной кислоты (ПВК) до молочной с участием НАДН:
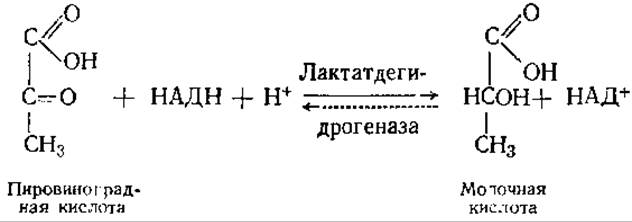
Равновесие сильно смещено в сторону образования молочной кислоты. Кофермент НАД выполняет роль переносчика электронов. Донором электронов для него в реакциях гликолиза служит глицеральдегид-3-фосфат (реакция 6). Если бы НАДН, образовавшийся при окислении глицеральдегид-3-фосфата, не окислялся, то гликолиз остановился бы, так как весь НАД+ восстановился бы в НАДН. Это предотвращается действием лактатдегидрогеназы.
Одиннадцатая реакция завершает процесс гликолиза. На ее уровне осуществляется регуляция гликолиза с помощью изоферментов лактатдегидрогеназы (см. разд. 3.8). Молочная кислота — это своеобразный тупик в метаболизме. В аэробных условиях она может превращаться только в ПВК путем обращения лактатдегидрогеназной реакции. В анаэробных условиях молочная кислота — конечный продукт гликолиза, например в мышцах при больших физических нагрузках. Тогда из мышц в кровь поступает большое количество молочной кислоты. В печени, а частично и в самих мышцах примерно одна пятая количества молочной кислоты окисляется до СО2 и Н2О в аэробной фазе дыхания. Оставшиеся четыре пятых ресинтезируются в гликоген.
Образовавшийся при гликолизе в цитоплазме НАДН не может проникать внутрь митохондрий. В аэробных условиях он передает электроны и протон в дыхательную цепь митохондрий (см. разд. 7.2) посредством глицерофосфатного челночного механизма. В цитоплазме НАДН реагирует с дигидроксиацетонфосфатом, образуя глицерол-3-фосфат, который легко проникает через мембрану митохондрий. Реакция катализируется цитоплазматической глицерол-3-фосфат — дегидрогеназой (НАД+):
Дигидроксиацетонфосфат + НАДН + Н+ ⇄ Глицерол-3-фосфат + НАД+
Внутри митохондрии глицерол-3-фосфат снова окисляется до дигидроксиацетонфосфата, но уже с помощью флавинового фермента — митохондриальной глицерол-3-фосфат — дегидрогеназы:
Глицерол-3-фосфат + ФАД Дигидроксиацетонфосфат + ФАДН2
Кофермент ФАДН2 вводит электроны и протоны в дыхательную цепь. При этом пара атомов Н дает только две молекулы АТФ, а не три, как при обычном введении пары электронов в дыхательную цепь через НАДН. Глицерофосфатный челночный механизм обеспечивает перенос электронов только внутрь митохондрий, т. е. является односторонним. Он особенно характерен для клеток печени и летательных мышц насекомых. В тех же клетках печени, а также в других тканях функционирует малатный челночный механизм, который является обратимым: переносит водород в митохондрии и из них. При этом цитоплазматический НАДН восстанавливает щавелевоуксусную кислоту до яблочной, легко проникающей в митохондрии и там снова окисляющейся до щавелевоуксусной кислоты с передачей водорода в дыхательную цепь.
Баланс энергии в реакциях гликолиза. В ходе гликолиза каждая шестиуглеродная молекула D-глюкозы превращается в две трехуглеродные молекулы молочной кислоты. При этом в первую стадию гликолиза расходуются две молекулы АТФ для активирования субстрата (в гексокиназной и фосфофруктокиназной реакциях). Во вторую стадию гликолиза АТФ образуется в двух реакциях: при действии фосфоглицераткиназы и пируваткиназы. Поскольку каждая молекула глюкозы дает две молекулы глицеральдегид-3-фосфата, всего получается четыре молекулы АТФ. Но так как две из них расходуются в первой стадии, в результате гликолиза образуются только две молекулы АТФ на одну молекулу глюкозы. Нетрудно рассчитать КПД этого процесса. Выделилась энергия:
Глюкоза → 2 Молочная кислота + 2Н+; ∆G0' (pH 7) =
= — 196 кДж ∙ моль-1
При этом она аккумулировалась в двух молекулах АТФ:
АДФ + Н3РО4 АТФ + Н2О; ∆G0' (pH 7) =
= + 34,5 кДж ∙ моль-1; 34,5 кДж∙моль-1х2 = 69 кДж ∙ моль-1
Таким образом, энергетическая эффективность гликолиза, его КПД составляет —35%. Следовательно, лишь одна треть энергии, выделяющейся при окислительном расщеплении глюкозы до молочной кислоты, запасается организмом в высокоэнергетических связях АТФ.
В извлечении из дыхательного материала (углеводов) свободной энергии и аккумуляции ее в легко используемой форме — молекулах АТФ — прежде всего заключается роль гликолиза как анаэробной фазы дыхания. Кроме того, в ходе реакций гликолиза образуется много высоко реакционноспособных соединений. Они используются в разнообразных метаболических реакциях. Значение гликолиза особенно велико в тканях и органах, где ограничен доступ кислорода или возможно внезапное и резкое возрастание скорости потребления АТФ. Например, в сердечной мышце скорость потребления АТФ может возрасти в 10 раз, а в работающей скелетной мышце — более чем в 100 раз. В этих случаях потребность в АТФ в какой-то мере удовлетворяется за счет аэробной фазы дыхания, но она ограничена притоком кислорода. В таких обстоятельствах скелетные мышцы (в меньшей мере — сердечные) получают дополнительное количество АТФ за счет гликолиза.
У растений в некоторых тканях гликолиз протекает даже при достаточном доступе кислорода. Особенно характерно такое однофазовое, «анаэробное дыхание» (или «аэробное брожение») для зародышевой ткани семян и внутренних тканей плодов растений вследствие недостатка в них кислорода. Гликолиз является основным путем катаболизма глюкозы гомоферментативных молочнокислых бактерий, дрожжей.
Анаэробному расщеплению могут подвергаться глюкозные остатки гликогена, этот процесс называется гликогенолизом. Включение гликогена в процесс анаэробного распада осуществляется тремя ферментами. Гликоген-фосфорилаза и амило-1,6-глюкозидаза (изоамилаза) расщепляют гликоген до глюкозо-1-фосфата. Далее фосфоглюкомутаза превращает последний в глюкозо-6-фосфат, который включается в обычные реакции гликолиза. Поскольку при гликогенолизе на образование глюкозо-6-фосфата АТФ не тратится, в процессе гликогенолиза накапливаются не две, а три молекулы АТФ на молекулу глюкозы. Однако это не означает, что гликогенолиз энергетически более выгоден, чем гликолиз, так как на синтез гликогена из глюкозы АТФ расходуется.
6.9.2. Брожения. Многие микроорганизмы (дрожжевые грибы, плесневые грибы, бактерии) получают энергию за счет брожения. Это наиболее примитивный способ получения энергии. Разнообразные брожения совпадают с гликолизом во многих своих стадиях, что было установлено акад. С. П. Костычевым (1907—1912). Один из конечных продуктов гликолиза — ПВК — исходное соединение для аэробного расщепления глюкозы и разнообразных брожений (рис. 6.13). Реакции дальнейшего превращения ПВК различны у ряда микроорганизмов и приводят к образованию характерных продуктов брожения, таких, как спирты и кислоты.
Принципиальное отличие брожений и анаэробного расщепления глюкозы от аэробного заключается в том, что при брожениях роль конечного окислителя — акцептора электронов и водорода играет не кислород, а какие-либо органические соединения. Брожение и анаэробное расщепление углеводов — это внутренние окислительно-восстановительные процессы, в результате которых происходит запасание энергии, а также регенерируется окисленный НАД+, что совершенно необходимо для продолжения гликолиза и брожения, так как содержание НАД+ в клетках ограничено.
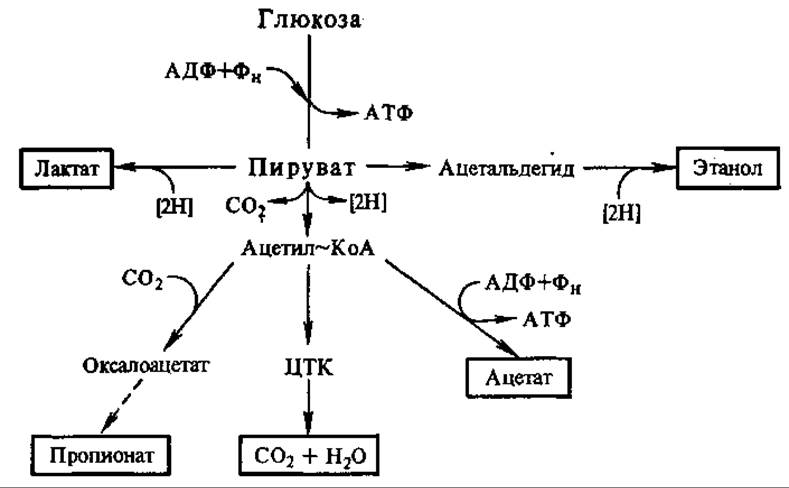
Рис. 6.13. Возможные пути превращения пировиноградной кислоты:
ЦТК — цикл трикарбоновых кислот; в рамках указаны продукты возможных превращений пирувата
Для дрожжевых грибов, особенно штаммов Saccharomyces сеrevisiae, характерен процесс спиртового брожения, в ходе которого сахара расщепляются с высоким выходом этилового спирта и оксида углерода (IV): С6Н12О6 = 2СО2 + 2С2Н5ОН. Превращение ПВК в конечные продукты спиртового брожения включает две реакции:
![]()
Характерной особенностью этой реакции является ее полная необратимость. Пируватдекарбоксилаза требует наличия Mg2+и кофермента тиаминдифосфата (ТДФ).
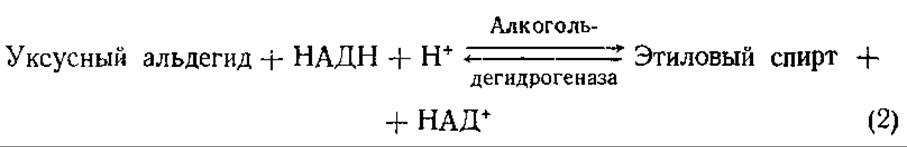
Другой часто встречающийся тип брожения — молочнокислое. В результате гомоферментативного молочнокислого брожения из глюкозы образуется молочная кислота с почти 100%-ным выходом. Реакции этого процесса идентичны реакциям гликолиза. При гетероферментативном (смешанное) молочнокислом брожении из глюкозы кроме молочной кислоты образуются в значительном количестве другие продукты — уксусная кислота, этиловый спирт и оксид углерода (IV). Химизм этого процесса совершенно иной, в основе его лежит окисление глюкозы по пентозофосфатному пути (см. разд. 6.9.3).
Молочнокислое брожение протекает при силосовании кормов для сельскохозяйственных животных, квашении капусты. Образующаяся молочная кислота предотвращает развитие гнилостных бактерий, плесневых грибов, т. е. служит консервантом.
Пропионовая кислота представляет собой продукт сбраживания углеводов пропионовыми бактериями. Наряду с ней образуются уксусная кислота и оксид углерода (IV). На каждую молекулу ПВК, окисленную до уксусной кислоты и СО2, приходится две молекулы ПВК, которые превращаются в пропионовую кислоту.
Уксуснокислые бактерии (рода Acetobacter) окисляют этиловый спирт до уксусной кислоты. Эти бактерии способны окислять и другие спирты, в том числе предельные многоатомные. Такое явление называется неполным окислением.
6.9.3. Пентозный путь, или пентозофосфатный цикл окисления углеводов. В 30-е годы XX столетия работами В. А. Энгельгардта, О. Варбурга, Ф. Липмана, Д. Диккенса было доказано, что кроме гликолиза в клетках существует еще один путь расщепления углеводов — ступенчатый окислительный распад гексоз до пентоз и других сахаров с более короткой цепью. Ключевую роль в реакциях этого цикла играют пентозофосфаты, в связи с чем он называется пентозным путем или пентозофосфатным циклом. Первая реакция этого пути — окисление глюкозо-6-фосфата до 6-фосфоглюконовой кислоты (6-фосфоглюконат), в связи с чем пентозофосфатный путь называется также фосфоглюконатным. Так как в реакциях пути окисляется монофосфат глюкозы, его нередко называют гексозомонофосфатным путем (ГМФ-путь).
Пентозный путь имеет две фазы, все реакции протекают в цитоплазме, ядрах и митохондриях. Первая фаза окислительная: глюкозо-6-фосфат окисляется до пентозофосфатов. Вторая фаза — неокислительная, она представляет собой взаимопревращения трех-, четырех-, пяти-, шести-, семи- и восьмиуглеродных сахарофосфатов, в результате которых регенерируется глюкозо-6-фосфат.
Первая реакция окислительной фазы представляет собой дегидрирование глюкозо-6-фосфата, катализируемое глюкозо-6-фосфат-дегидрогеназой, которая специфически использует в качестве акцептора электронов НАДФ+:
![]()
Равновесие реакции сильно смещено вправо; Лактон спонтанно гидролизуется до свободной кислоты. Однако в клетках содержится специфический фермент — глюконолактоназа, катализирующий гидролиз:
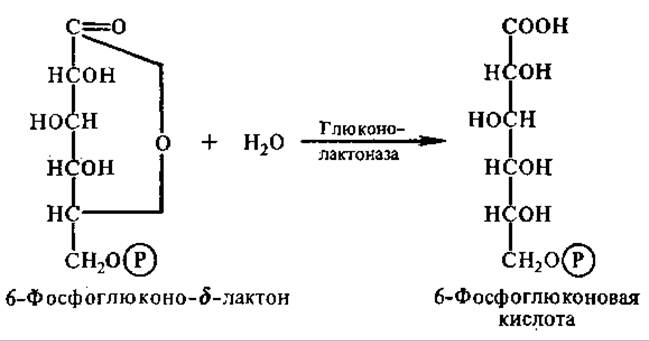
В следующей окислительной реакции 6-фосфоглюконовая кислота дегидрируется и декарбоксилируется. Реакция сопровождается образованием еще одной молекулы НАДФН:
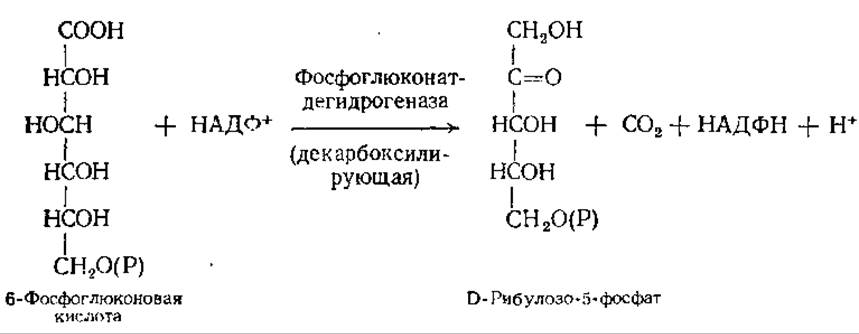
Под действием фермента рибцлозофосфат — 3-эпимеразы рибулозо-5-фосфат может обратимо превращаться в своей 3-эпимер — ксилулозо-5-фосфат. При участии особой рибозофосфат-изомеразы рибулозо-5-фосфат способен также обратимо превращаться в свой альдоизомер — рибозо-5-фосфат:
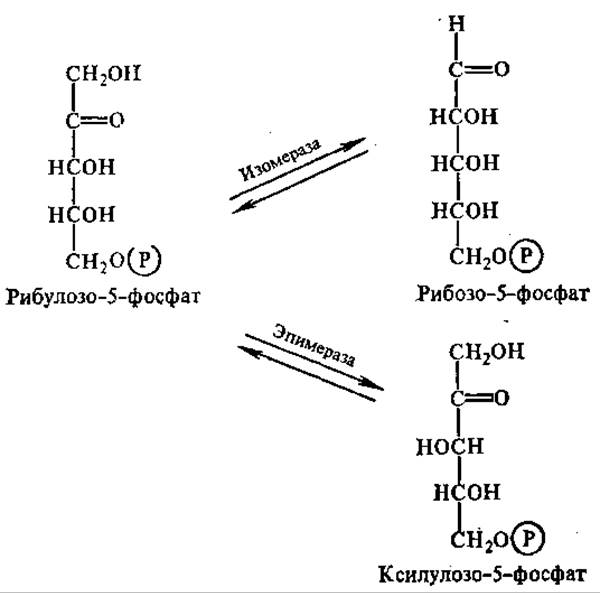
При определенных условиях фосфоглюконатный путь на этом завершается, и тогда суммарный итог описывается уравнением
Глкжозо-6-фосфат + 2НАДФ+→ Пентозо-5-фосфат + СО2 +
+ 2НАДФН + 2Н+
В других условиях наступает неокислительная стадия пентозофосфатного пути. Она протекает в анаэробных условиях. Основные реакции этой стадии осуществляются с участием специфических ферментов — транскетолазы и трансальдолазы. Транскетолаза осуществляет перенос гликоальдегидной группы (СН2ОН—СО—) от ксилулозо-5-фосфата к рибозо-5-фосфату, промежуточным переносчиком гликоальдегидной группы является тиаминдифосфат (ТДФ):
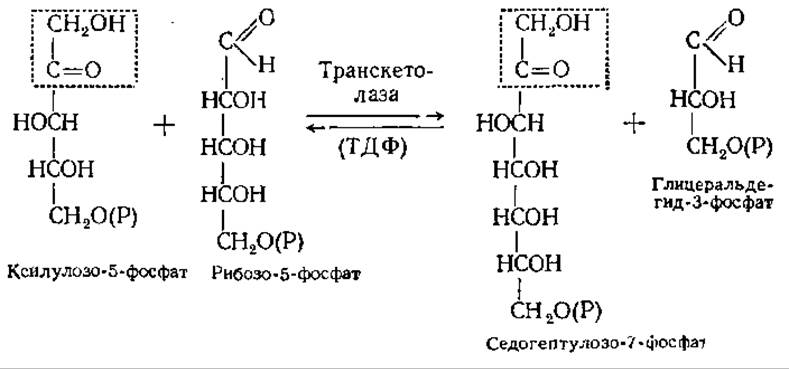
Трансальдолаза действует на продукты транскетолазной реакции. Происходит перенос группы дигидроксиацетона от седогептулозо-7-фосфата на глицеральдегид-3-фосфат, в результате чего образуется фруктозо-6-фосфат:

Второй продукт реакции представляет собой фосфорный эфир четырехуглеродного сахара — эритрозо-4-фосфат. Он используется во второй транскетолазной реакции:

Посредством пентозофосфатного цикла может происходить полное окисление глюкозо-6-фосфата до СО2. При этом 6 молекул глюкозо-6-фосфата дают 5 молекул глюкозо-6-фосфата и 6 молекул СО2 (рис. 6.14). Суммарное уравнение реакций имеет следующий вид:
6 Глюкозо-6-фосфат + 7Н2О + 12НАДФ+ → 5 Глюкозо-6-фoсфат +
+ 6СО2 + 12НАДФН + 12Н+ + Фн
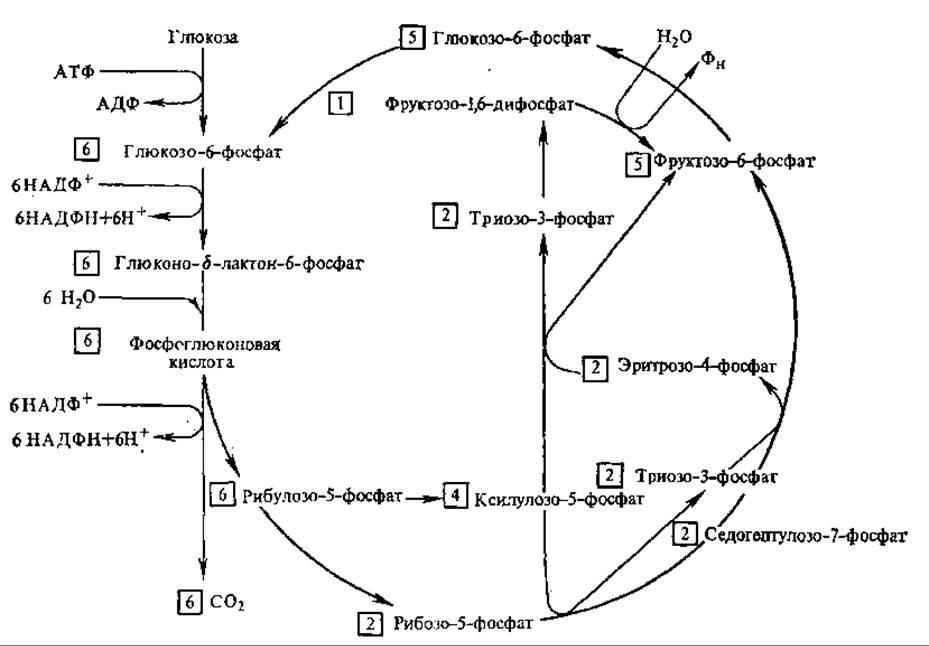
Рис. 6.14. Пентозофосфатный цикл окисления глюкозы: цифрами в квадратах обозначено число молекул
После сокращения общих членов получается:
Глюкозо-6-фосфат + 7Н2О + 12НАДФ+→ 6СО2 + 12НАДФН +
+ 12Н+ + Н3РО4
Такое полное окисление глюкозо-6-фосфата происходит не во всех клетках. Чаще пентозный путь на одном из этапов переходит в гликолитический. Существует всего три точки сопряжения пентозного пути с гликолизом: на уровне глюкозо-6-фосфата, фруктозо-6-фосфата и глицеральдегид-3-фосфата. Здесь осуществляется пересечение метаболических путей, обеспечивающее образование широкого набора различных метаболитов.
Работами Д. Ф. Вильямса, М. Г. Кларка, С. Е. Северина показано, что превращения пентозофосфатов в неокислительной стадии могут протекать еще более сложно. После первой транскетолазной реакции происходит следующее:

Последняя транскетолазная реакция представляет собой еще одно доказательство тесной взаимосвязи гликолитического и пентозофосфатного путей обмена углеводов. Она показывает, что эритрозо-4-фосфат может образовываться посредством транскетолазной реакции из начальных продуктов гликолиза — глюкозо-6-фосфата и фруктозо-6-фосфата. Благодаря этому как считают многие исследователи, гликолиз и пентозный путь способны переключаться с одного на другой. Роль регулятора этого процесса выполняет эритрозо-4-фосфат. Если пентозофосфатов много, то эритрозо-4-фосфат участвует в транскетолазной реакции, приводящей к образованию глюкозо-6-фосфата и фруктозо-6-фосфата. Если же много гексозофосфатов, то эритрозо-4-фосфат вступает в альдолазную реакцию, пополняющую пул седогептулозо-1,7-дифосфата.
Значение пентозного пути состоит главным образом в том, что он генерирует в цитоплазме восстановитель в форме НАДФН, необходимый в больших количествах для биосинтеза многих веществ, в частности жирных кислот и стероидов. Поэтому активность пентозного цикла высока в клетках печени, молочной железы, жировой ткани и коры надпочечников. Другая функция этого пути заключается в том, что он поставляет пентозофосфаты для синтеза нуклеиновых кислот и нуклеотидов. Кроме того, у ряда микроорганизмов этим путем пентозы могут окисляться, а также превращаться в гексозы.
Пентозный путь может быть также источником С1- и С7-сахаров, которые необходимы клетке для синтеза важных метаболитов. Образовавшийся НАДФН, как правило, не участвует в окислительном фосфорилировании, протекающем в митохондриях, поэтому у большинства организмов в плане энергетики пентозофосфатный путь существенной роли не играет. Согласно наиболее распространенной точке зрения первоначально пентозофосфатный путь возник, видимо, для обеспечения прокариотических организмов пентозами. Появление в процессе эволюции только трех новых ферментов (глюкозо-6-фосфатдегидрогеназа, глюконолактоназа и фосфоглюконатдегидрогеназа) решило проблему синтеза пентоз. Возникнув для выполнения узкой специфической задачи, пентозофосфатный путь у некоторых микроорганизмов стал выполнять и дополнительную функцию: снабжение энергией в анаэробных условиях. Например, у некоторых облигатных гетероферментативных молочнокислых бактерий (Leuconostoc mesenteroides) он является единственным путем сбраживания углеводов, эти бактерии не имеют ключевых ферментов гликолиза. Способность использовать энергию возникла с появлением в процессе эволюции двух новых ферментов: эпимеразы фосфопентоз и транскетолазы. Сформировался новый биохимический механизм — пентозофосфатный цикл, в котором происходит полное расщепление дыхательного материала до СО2.
6.9.4. Путь Энтнера — Дудорова. Небольшое число микроорганизмов, к которым относятся главным образом бактерии из рода Pseudomonas, получают энергию с помощью специфического метаболического пути — Энтнера — Дудорова. Он связан с пентозофосфатным циклом через 6-фосфоглюконовую кислоту и с гликолизом через глицеральдегид-3-фосфат. Первые две реакции этого пути идентичны началу пентозофосфатного цикла. Специфичным для пути Энтнера —Дудорова являются две следующие реакции: образование кетодезоксифосфоглюконовой кислоты и дальнейшее ее альдолазное расщепление на две триозы (рис. 6.15). Если глицеральдегид-3-фосфат окисляется далее путем реакций гликолиза до ПВК, то одна молекула глюкозы, расщепляясь по пути Энтнера — Дудорова, образует одну молекулу АТФ, одну молекулу НАДН и одну молекулу НАДФН.
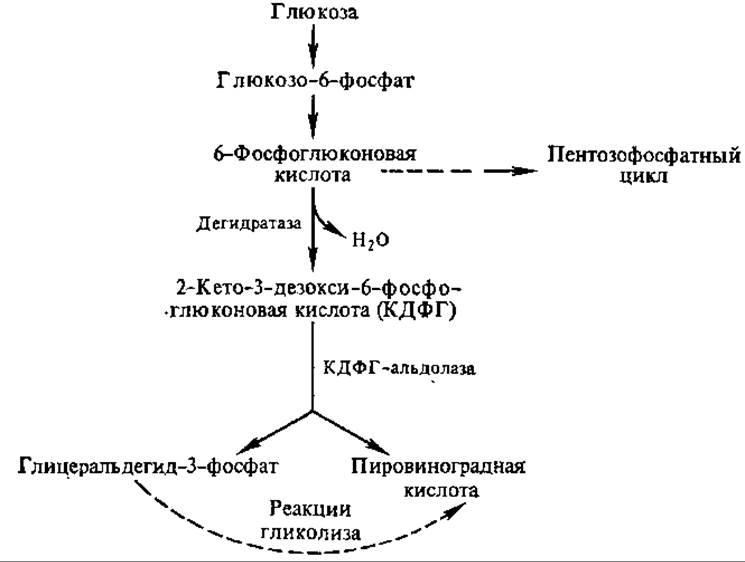
Рис. 6.15. Реакции пути Энтнера—Дудорова
Путь Энтнера — Дудорова возник в процессе эволюции, видимо, как ответвление пентозного пути, поскольку первые две реакции у них одинаковы. Существует предположение, что он появился в связи с высокой потребностью прокариот в ПВК как кратчайший путь ее образования (всего четыре реакции, тогда как при гликолизе ПВК образуется после девяти реакций).
6.9.5. Цикл трикарбоновых кислот (цикл Кребса). Окисление ПВК до ацетил к оэнзима А. В цикл трикарбоновых кислот (ЦТК) вступают ацетильные группы, образовавшиеся из углеводов, жиров и аминокислот. Именно в ЦТК происходит полное расщепление ПВК, образующейся в результате гликолиза, до конечных продуктов: СО2 и воды. Этот цикл был открыт и исследован Г. Кребсом в 1937 г., в связи с чем он называется также циклом Кребса. Все реакции цикла протекают в матриксе митохондрий. Непосредственным реакциям цикла предшествует подготовительная фаза — окисление ПВК до ацетилкоэнзима А (ацетил-КоА). Это сложный процесс, суммарное уравнение которого имеет следующий вид:
ПВК + НАД+ + КоА Ацетил-КоА + НАДН + Н+ + СО2
Процесс сопровождается значительным уменьшением свободной энергии, он практически необратим.
Окислительное декарбоксилирование ПВК катализируется пируватдегидрогеназной системой1. Она состоит не менее чем из трех ферментов, которые используют пять коферментов: тиаминдифосфат (ТДФ), амид липоевой кислоты ![]() коэнзим A (KoA-SH), ФАД, НАД+.
коэнзим A (KoA-SH), ФАД, НАД+.
Сначала протекает реакция между ПВК и связанным с пируватдегидрогеназой ТДФ, которая катализируется ферментом пируватдегидрогеназой. Происходит декарбоксилирование, образуются а-гидроксиэтил-ТДФ и СО2. Гидроксиэтильная группа еще связана на поверхности фермента, но уже реагирует с дисульфидной формой ЛК, присоединенного ко второму ферментативному белку системы — липоат-ацетилтрансферазе. Протекает окислительновосстановительная реакция, дисульфидные связи липоевой кислоты восстанавливаются до двух SH-групп, одна из них образует эфир с ацетилом, возникшим в результате окисления гидроксиэтильной группы. Ацетильная группа переносится к SH-группе КоА с образованием ацетил-КоА.
Ацетил-КоА отделяется от поверхности фермента, оставляя восстановленный ЛК(SН)2. Окисление восстановленного амида липоевой кислоты протекает при участии третьего фермента системы — липоамид-дегидрогеназы, которая содержит кофермент ФАД, способный к восстановлению. ФАДН2 окисляется присутствующим в среде НАД+. На этом весь процесс завершается, все коферменты оказываются в своем исходном состоянии, пригодном для следующего цикла.
Пируватдегидрогеназная система в животных клетках обладает молекулярной массой около 9∙106. В ее состав входит 30 молекул пируватдегидрогеназы, 60 молекул липоат-ацетилтрансферазы и 10 молекул липоамид-дегидрогеназы.
Реакции и ферменты цикла трикарбоновых кислот. Образовавшийся в результате окислительного декарбоксили- рования ПВК ацетил-КоА вступает в цикл трикарбоновых кислот. Он конденсируется с молекулой щавелевоуксусной кислоты (ЩУК, или оксалоацетат), в результате чего образуется лимонная кислота. Реакция катализируется ферментом цитрат-синтазой, найденным у животных, микроорганизмов и у различных растений.
Лимонная кислота превращается в цис-аконитовую, а затем — в изолимонную. Эти реакции катализируются одним и тем же ферментом — аконитат-гидратазой (рис. 6.16). Далее изолимонная кислота дегидрируется и декарбоксилируется под действием изоцитратдегидрогеназы с образованием СO2 и а-кетоглутаровой кислоты. Коферментом митохондриальной изоцитратдегидрогеназы служит НАД+, фермент нуждается в ионах Mg2+ или Мn2+, аллостерически активируется под действием АДФ. Активность фермента сильно ингибируют АТФ и НАДН, последний за счет конкуренции с НАД+. Благодаря этому при любых метаболических условиях, вызывающих повышение концентрации АДФ в клетке, автоматически увеличивается скорость окисления изолимонной кислоты. Вместе с тем увеличивается скорость всего ЦТК, так как обычно именно эта реакция лимитирует процесс в целом. Наоборот, увеличение концентрации АТФ и накопление НАДН приводит к выключению изоцитратдегидрогеназы, замедлению реакций цикла.
1 Ранее употреблявшийся в данном случае термин «комплекс» новыми правилами номенклатуры ферментов (1979) не рекомендуется.
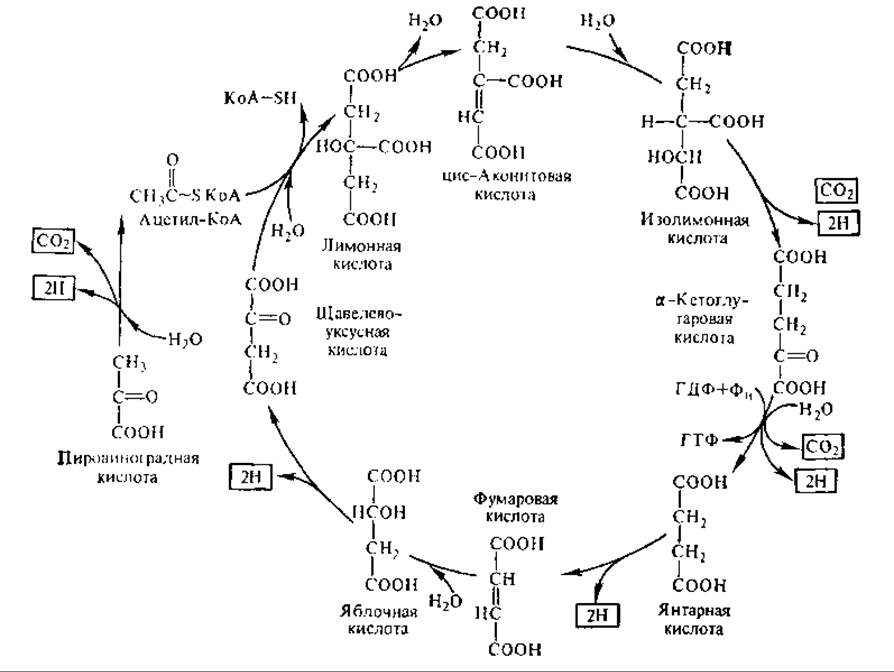
Рис. 6.16. Цикл трикарбоновых кислот (конечные продукты обведены рамкой)
Следующая реакция — окислительное декарбоксилирование а-кетоглутаровой кислоты до янтарной кислоты. Суммарное уравнение реакции таково:
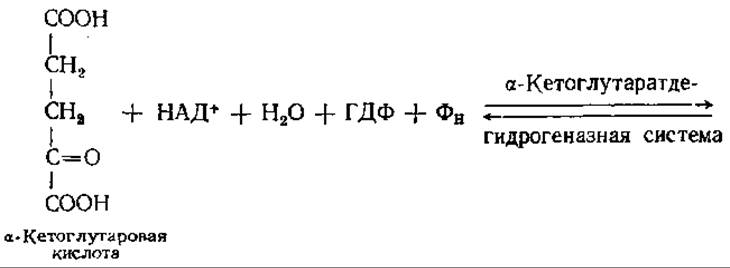
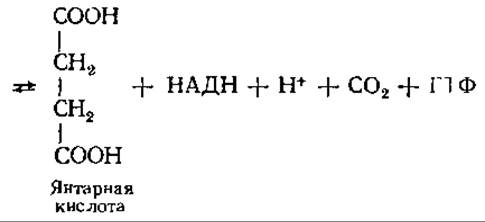
Это сложная многоступенчатая реакция, имеющая сходство с реакцией окисления ПВК. Механизм обеих реакций практически одинаков: и в той, и в другой участвуют в качестве кофакторов тиаминдифосфат, ЛК, КоА, НАД+ и ФАД.
а-Кетоглутаратдегидрогеназная система напоминает по своей структуре и свойствам пируватдегидрогеназную систему. Первая стадия окислительного декарбоксилирования а-кетоглутаровой кислоты включает в себя окисление и декарбоксилирование:
![]()
Конечный продукт этой реакции — сукцинил-КоА— представляет собой высокоэнергетический тиоэфир, у которого в образовании сложноэфирной связи участвует одна из СООН-групп янтарной кислоты (сукцината). На следующем этапе сукцинил-КоА утрачивает свою КоА-группу, освобождающаяся энергия запасается в фосфатной связи ГТФ:
Сукпинил ~ КоА + ФH + ГДФ Янтарная кислота + ГТФ + KoA-SH
Реакция катализируется ферментом сукцинил-КоА-синтетазой и относится к реакциям субстратного фосфорилирования: энергия окисления, которая была накоплена в сукцинил-КоА, переносится на ГТФ. ГТФ может отдавать свою концевую фосфорильную группу АДФ, в результате чего образуется АТФ: ГТФ + АДФ⇄ГДФ +АТФ. Эту реакцию катализирует нуклеозиддифосфат — киназа.
В дальнейшем происходит окисление янтарной кислоты до фумаровой. Оно катализируется ферментом сукцинатдегидрогеназой — флавопротеином, в молекуле которого с белком ковалентно связан ФАД, действующий в этой реакции как акцептор водорода. В отличие от других ферментов ЦТК, находящихся в матриксе митохондрий, сукцинатдегидрогеназа — белок внутренней мембраны митохондрий. Через сукцинатдегидрогеназу электроны и протоны от ФАДН2 непосредственно входят в дыхательную цепь.
В следующей реакции, протекающей в матриксе, осуществляется обратимая гидратация фумаровой кислоты с участием фермента фумаратгидратазы, образуется L-яблочная кислота (L-малат). В последней реакции ЦТК НАД-зависимая малатдегидрогеназа катализирует окисление L-яблочной кислоты в ЩУК, которая вступает в новый цикл реакций.
Баланс энергии в цикле трикарбоновых кислот. За один оборот ЦТК молекула ПВК оказывается полностью окисленной до СO2 и Н2О. Всего образуется 3 молекулы СO2 в следующих реакциях: при окислительном декарбоксилировании ПВК, при декарбоксилировании изолимонной кислоты, при окислительном декарбоксилировании а-кетоглутаровой кислоты. В цикл вступает три молекулы воды: в реакции окислительного декарбоксилирования ПВК и а-кетоглутаровой кислоты и в фумаратгидратазную. Всего при окислении ПВК отнимается пять пар атомов водорода, из них одна пара — от янтарной кислоты — поступает на ФАД, четыре пары — на НАД+ с образованием НАДН: при окислительном декарбоксилировании ПВК, а-кетоглутаровой и изолимонной кислот, при окислении яблочной кислоты. Нетрудно видеть, что в ЦТК молекулярный кислород непосредственно не участвует, окисление осуществляется путем присоединения воды и дегидрирования (см. разд. 6.16).
Суммарное балансовое уравнение окисления конечного продукта анаэробной фазы дыхания — ПВК — в реакция ЦТК следующее:
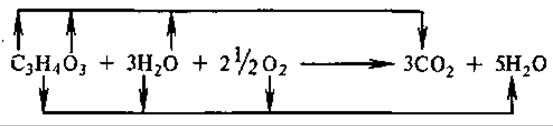
Из схемы видно, что весь углерод субстрата окисляется до оксида углерода (IV), в состав которого входит кислород субстрата и кислород воды. Кислород воздуха потребляется уже после непосредственных реакций цикла Кребса на окисление водорода ПВК и водорода воды, присоединившейся к субстрату на определенных стадиях цикла.
Восстановленный кофермент НАДН поступает в матрикс митохондрии и диффундирует к ее внутренней мембране. Здесь он связывается с ферментом НАДН-дегидрогеназой, окисляется ею, отдавая электроны и протон в дыхательную (электронпереносящую) цепь. Энергия окисления накапливается в форме электрохимического потенциала ионов водорода на мембране ∆μН4, за счет которого синтезируется АТФ из АДФ и Н3РO4, осуществляется окислительное фосфорилирование (см. разд. 7.3).
Можно рассчитать энергетический выход окисления глюкозы через ПВК в процессе дыхания. При окислении ПВК четыре пары атомов водорода поступают на НАД+. Окисление одной молекулы НАДН дает три молекулы АТФ. Одна пара атомов водорода окисляется через ФАД, что дает две молекулы АТФ. Одна молекула АТФ образуется путем субстратного фосфорилирования. Всего 3∙4+2+1 = 15 молекул АТФ. Следовательно, за счет окисления 1 моля ПВК получается 15 молей АТФ. Следует учесть, что из одной молекулы глюкозы образуется две молекулы ПВК, поэтому необходимо ввести коэффициент 2:15 молекул АТФx2=30 молекул АТФ.
Кроме того, в анаэробной фазе (при гликолизе) образуются еще две молекулы АТФ и две молекулы цитоплазматического НАДН. В зависимости от механизма поступления восстановительных эквивалентов в матрикс митохондрий и далее в дыхательную цепь (см. разд. 6.9.1) образуется еще 4 или 6 молекул АТФ. Таким образом, при аэробном окислении 1 моля глюкозы клетка получает до 38 молей АТФ, т. е. значительно больше, чем при гликолизе. При этом в высокоэнергетических связях АТФ запасается 34,5x38=1311 кДж свободной энергии. Всего при полном окислении 1 моля глюкозы до СO2 и Н2O выделяется около 2872 кДж энергии. Таким образом, при аэробном распаде глюкозы в высокоэнергетических связях аккумулируется более 45% выделившейся свободной энергии.
Цикл трикарбоновых кислот обнаружен у животных, растений, микроорганизмов. Он может протекать не только в аэробных, но и в анаэробных условиях, например у фотосинтезирующих бактерий, однако при условии, что присутствует подходящий акцептор водорода. Анаэробные варианты ЦТК известны также в животных клетках. При нехватке кислорода в органах млекопитающих НАДН может расходоваться на восстановление фумаровой кислоты до янтарной. Филогенетически древние синезеленые водоросли не имеют полного цикла.
В цикле Кребса перерабатываются не только углеводы. Ацетил- КоА, который получается при окислении жирных кислот, может конденсироваться с ЩУК. Многие аминокислоты, подвергаясь реакциям переаминирования, могут превращаться в какой-то метаболит цикла, и, таким образом, вступать в него. Промежуточные продукты цикла, в свою очередь, могут удаляться из него и использоваться как предшественники аминокислот и других биологически важных веществ. Таким образом, цикл трикарбоновых кислот — это амфиболический путь метаболизма (см. разд. 1.2). Функции его связаны не только с катаболическими, но и с анаболическими процессами, для которых он поставляет вещества-предшественники. Цикл трикарбоновых кислот — это не только аэробное расщепление глюкозы, но и тот фокус, в котором скрещиваются многие метаболические пути.
6.9.6. Глиоксилатный цикл. Существуют специальные ферментативные механизмы, пополняющие запас промежуточных продуктов ЦТК. Такую функцию, в частности, выполняет глиоксилатный цикл. Он обнаружен в клетках высших растений, плесневых грибов, некоторых бактерий (Pseudomonas, Е. coli). В животных клетках пока не найдены ключевые ферменты этого цикла, поэтому считают, что у них он осуществляться не может. Цикл открыт Г. Кребсом в 1957 г.
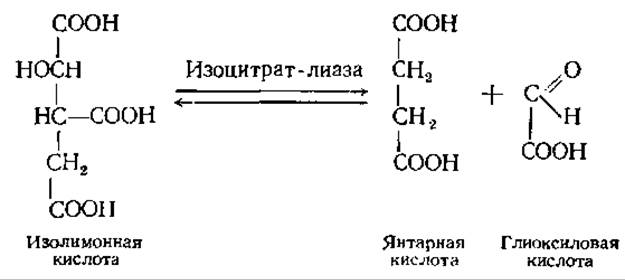
Глиоксилатный цикл — это видоизмененный цикл трикарбоновых кислот. В нем ферменты изоцитратдегидрогеназа и а-кетоглутаратдегидрогеназа заменены ферментом изоцитрат-лиазой, которая расщепляет изолимонную кислоту до янтарной и глиоксиловой:
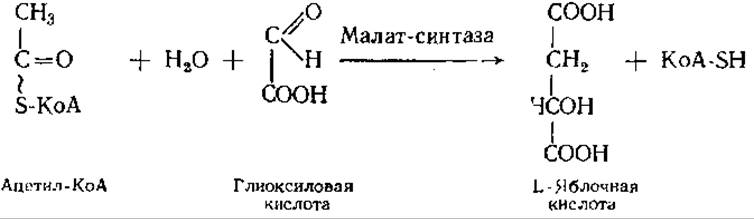
Другой ключевой фермент цикла — малат-синтаза. Она катализирует реакцию конденсации ацетил-КоА с глиоксиловой кислотой:
Кроме этик двух специфических для глиоксилатного цикла ферментов в нем участвует ряд ферментов ЦТК.
Пусковая реакция цикла обеспечивается работой цикла Кребса, в котором образуется ЩУК. Под действием фермента цитрат-синтазы ацетил-КоА конденсируется с ЩУК, образуя лимонную кислоту. Она под действием аконитат-гидратазы превращается в аконитовую, а затем в изолимонную кислоту. Последняя расщепляется под действием изоцитрат-лиазы на янтарную и глиоксиловую кислоты. С участием второго специфического для цикла фермента — малат-синтазы глиоксиловая кислота конденсируется со второй молекулой ацетил-КоА, образуется яблочная кислота, она окисляется малатдегидрогеназой, в результате чего регенерируется ЩУК (рис. 6.17).
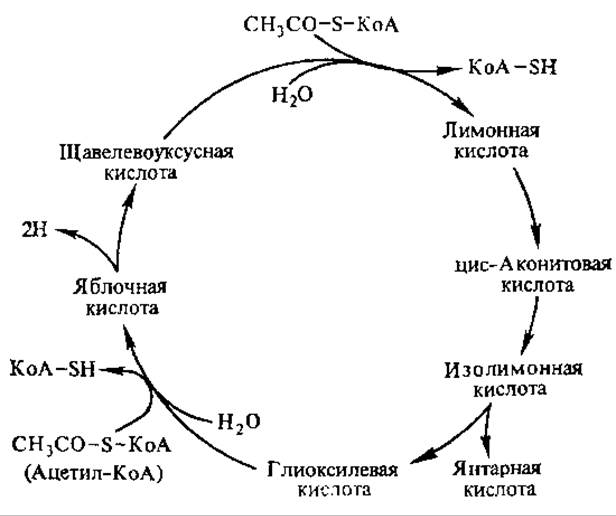
Рис. 6.17. Реакции глиоксилатного цикла
Таким образом, при каждом обороте цикла в него включаются две молекулы ацетил-КоА, образуется одна молекула янтарной кислоты, которая может вступать в реакции глюконеогенеза, в другие процессы биосинтеза или в ЦТК. В последний могут переходить и такие метаболиты глиоксилатного цикла, как яблочная и изолимонная кислоты. В результате реакций глиоксилатного цикла два атома водорода могут поступать в дыхательную цепь, при этом образуются три молекулы АТФ. Это особенно важно для тех организмов и в тех случаях, когда ацетильная группа и другие двухуглеродные соединения служат единственным источником энергии.
Глиоксилатный цикл характерен, например, для микроорганизмов, использующих в качестве энергетического и пластического материала двухуглеродные соединения. Уксусная кислота и этиловый спирт непосредственно включаются в ЦТК в виде ацетил-КоА, но в нем не могут использоваться более восстановленные соединения типа глицина и гликолевой кислоты. Они окисляются до глиоксиловой кислоты в глиоксилатном цикле.
В тканях растений с помощью глиоксилатного цикла протекает превращение жиров в углеводы и другие клеточные компоненты. Особенно активно этот процесс осуществляется в прорастающих семенах масличных растений. Запасные триацилглицерины расщепляются, при окислении входящих в их состав жирных кислот образуется ацетил-КоА. Он вступает в реакции глиоксилатного цикла, получается янтарная кислота. Последняя превращается в углеводы в результате реакций ЦТК и глюконеогенеза. Ферменты глиоксилатного цикла локализуются у растений в микротельцах, называемых глиоксисомами.