Основы биохимии - А. А. Анисимов 1986
Биологическое окисление и биоэнергетика
Регуляция энергетического обмена
Ярким примером регуляции и саморегуляции энергетического обмена в организме является ускорение генерирования АТФ в работающей мышце. В покоящейся мышце, как и в других тканях, АТФ расходуется на поддержание постоянства внутренней среды и на непрерывно протекающие анаболические процессы. Однако при выполнении механической работы потребность мышцы в энергии в форме АТФ может почти мгновенно возрастать в 20—200 раз. В то же время количество АТФ, содержащейся в мышечной ткани, невелико, достаточно не более чем для 0,5 с интенсивной работы. Большой вклад в энергетику мышцы вносит креатинфосфат, его в 3—8 раз больше, чем АТФ; но запасы креатинфосфата также невелики, его расход должен возмещаться синтезом АТФ в процессах гликолиза и окислительного фосфорилирования. В период работы мышцы окислительное фосфорилирование усиливается, однако предельно возможное поглощение кислорода гораздо меньше, чем это требуется для получения достаточного количества энергии. Поэтому внезапное возрастание потребности в АТФ удовлетворяется в основном за счет гликолиза, скорость которого увеличивается в сотни раз. При этом используется запас мышечного гликогена, а также глюкоза, поступающая из крови. Молочная кислота, образующаяся при сокращении мышцы, диффундирует в кровь и ресинтезируется в печени в глюкозу и гликоген (см. разд. 6.10). АДФ и Фн, освобождающиеся при сокращении мышцы, используются в окислительном фосфорилировании и в генерирующих энергию реакциях гликолиза, повышая скорость этих процессов.
Другой пример регуляции энергетического обмена — эффект Пастера. Известно, что в анаэробных условиях дрожжи извлекают энергию из молекул глюкозы посредством брожения. Л. Пастер открыл, что в присутствии кислорода воздуха клетки дрожжей потребляют меньше глюкозы на единицу массы, чем в анаэробных условиях, при этом уменьшается накопление молочной кислоты. Торможение гликолиза в присутствии кислорода аэробным дыханием получило название эффекта Пастера. Он характерен для факультативно анаэробных клеток, включая клетки высших организмов.
Как уже указывалось, при полном аэробном окислении молекулы глюкозы образуется 38 молекул АТФ, т. е. в 19 раз больше, чем при гликолизе. Поэтому в присутствии кислорода клетка переключается на более экономный путь получения энергии, в связи с чем потребляет меньшие количества глюкозы. В основе эффекта Пастера лежат изостерические и аллостерические взаимодействия ферментов и субстратов. Так, гликолиз и окислительное фосфорилирование конкурируют друг с другом за неорганический фосфат и АДФ (изостерические взаимодействия). Митохондрии обладают высоким сродством к АДФ, они продолжают фосфорилирование АДФ до тех пор, пока не будет достигнута очень высокая величина отношения АТФ/АДФ. Поэтому при включении окислительного фосфорилирования гликолиз тормозится вследствие нехватки АДФ. Общую скорость гликолиза лимитирует фосфофруктокиназная реакция (см. разд. 6.9.1). 6-Фосфофруктокиназа — регуляторный аллостерический фермент. Его активность стимулируется АДФ и Фн, подавляется АТФ и лимонной кислотой. Поэтому при высоком значении отношения АТФ/АДФ активность фермента сильно снижается, а при низком — повышается.
Таким образом, в результате окислительного фосфорилирования происходит «выключение» 6-фосфофруктокиназы и соответственно снижается скорость гликолиза. К тому же в аэробных условиях в реакциях цикла трикарбоновых кислот образуется лимонная кислота, которая выходит из митохондрий в цитоплазму и действует как отрицательный модулятор 6-фосфофруктокиназы. Инактивация 6-фосфофруктокиназы приводит к накоплению глюкозо-6-фосфата, который подавляет активность гексокиназы — ключевого фермента всего процесса гликолиза. Таким образом, эффект Пастера можно представить как результат последовательных и взаимосвязанных ступенчатых процессов (рис. 7.10).
Известно, что при недостатке АДФ скорость аэробного дыхания тормозится (дыхательный контроль). Таким способом регулируется скорость окислительного фосфорилирования. Д. Е. Аткинсон (1968) предложил характеризовать энергетическое состояние клетки количественно, вычисляя «заполнение» системы АТФ-АДФ-АМФ высокоэнергетическими фосфатными связями. Если все содержащиеся в клетке аденозинфосфаты находятся в форме АТФ, то система энергетически заполнена до предела, т. е. ее энергетический заряд равен 1,0. Если аденозинфосфаты находятся в форме АМФ, то система не содержит высокоэнергетических связей, она энергетически «пуста», ее заряд равен 0. Энергетический заряд системы АТФ-АДФ-АМФ вычисляется по уравнению
![]()
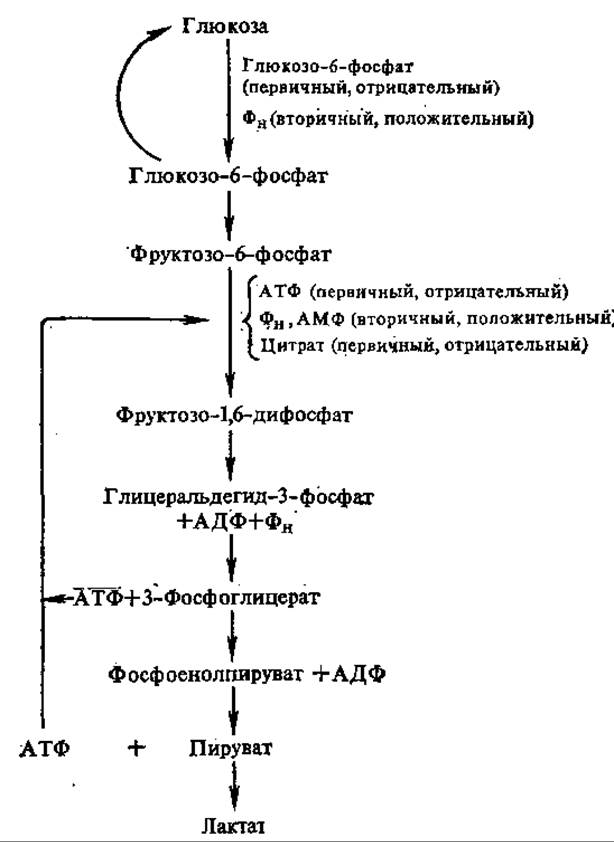
Рис. 7.10. Механизм эффекта Пастера, аллостерические регуляторы фосфофруктокиназы и гексокиназы. Эффекторы, стимулирующие активность фермента, — положительные, подавляющие — отрицательные; воздействующие прямо на фермент, — первичные; эффекторы, влияющие на стимуляцию или ингибирование первичным эффектором, — вторичные
От величины энергетического заряда зависят скорости реакций цикла трикарбоновых кислот и скорости других реакций, связанных с образованием или потреблением энергии. Например, у дрожжей уменьшение отношения АТФ/АМФ вызывает активацию цикла трикарбоновых кислот за счет активирования цитрат-синтазы и изоцитратдегидрогеназы. В тканях животных важную регуляторную роль выполняет отношение АТФ/АДФ.