Основы биохимии - А. А. Анисимов 1986
Белки
Аминокислоты
2.2.1. Определение и классификация. Аминокислоты можно рассматривать как производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на группу NH2. У большинства природных аминокислот аминогруппа находится в a-положении по отношению к карбоксилу:
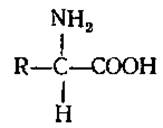
Значительно реже в живых организмах встречаются аминокислоты с ß- или у-положением аминогрупп (ß-аминопропионовая, у-аминомасляная).
В зависимости от характера боковых цепей (R-группы) аминокислоты делят на ациклические (алифатические) и циклические (гомо- и гетероциклические).
По числу аминных и карбоксильных групп аминокислоты разделяются на: 1) моноаминомонокарбоновые (глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, триптофан, тирозин, фенилаланин); 2) диаминомонокарбоновые (лизин, аргинин, цитруллин); 3) моноаминодикарбоновые (аспарагиновая и глутаминовая кислоты); 4) диаминодикарбоновые (цистин). По характеру заряженности боковых радикалов, их полярности аминокислоты классифицируют на: 1) неполярные, гидрофобные (глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, метионин); 2) полярные, но незаряженные (серин, треонин, аспарагин, глутамин); 3) полярные с отрицательным (аспарагиновая и глутаминовая кислоты, цистеин, тирозин) или положительным (лизин, аргинин, гистидин) зарядами.
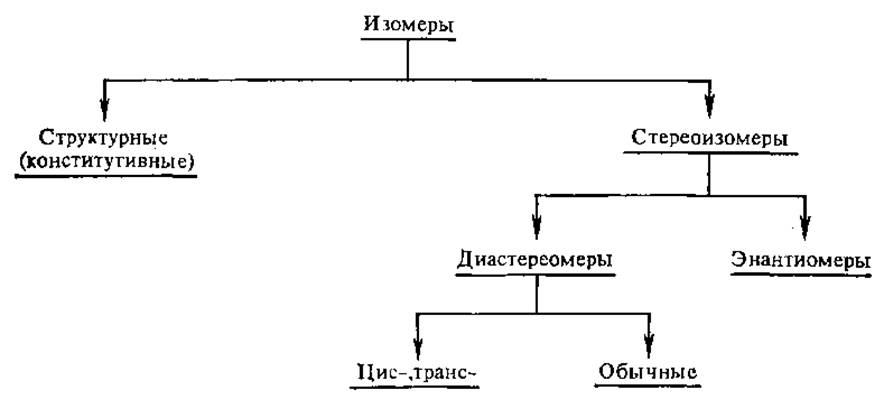
2.2.2. Изомерия, общие понятия1. Изомеры — соединения, имеющие одинаковую молекулярную формулу, но отличающиеся расположением атомов в пространстве, природой и последовательностью связей между ними.
1 Материал этого раздела излагается в соответствии с номенклатурой органической химии, предложенной Международной организацией чистой и прикладной химии «IUРАС. Nomenclature of Organic Chemistry». Oxford—New-York—Toronto—Sydney—Paris—Frankfurt., 1979.
Существует два вида изомеров; структурные изомеры и стереоизомеры.
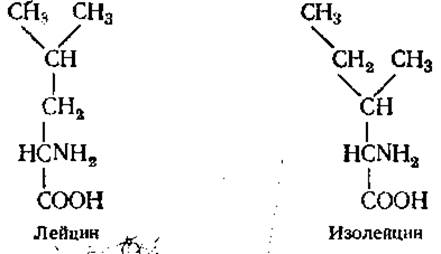
Структурные изомеры (новые правила международной номенклатуры рекомендуют их называть конститутивными) имеют различную последовательность связывания атомов. Например, лейцин и изолейцин. Молекулярная формула их одинакова — С6Н13O2, а структурные формулы отличаются;
Стереоизомеры — изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве. Например, стереоизомеры аланина:

В прошлом стереоизомерия включала оптическую изомерию и геометрическую изомерию. В настоящее время употребление этих терминов не рекомендуется: известно, например, что оптическая активность в зависимости от растворителя может меняться не только по величине, но и по знаку.
Если два стереоизомера относятся друг к другу как предмет и его зеркальное изображение, они называются энантиомерами. Стереоизомеры, не относящиеся друг к другу как предмет и его зеркальное изображение, называют диастереомерами. Диастереомерами являются, в частности, и цис-транс-изомеры, если они отличаются только расположением атомов относительно плоскости, проходящей через молекулу:
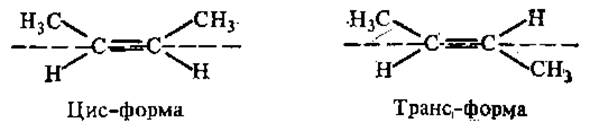
Цис-транс-изомерия возможна только в структурах, которым придает жесткость двойная связь или цикл.
В целом изомеры можно классифицировать следующим образом:
Симметричность любой молекулы может быть охарактеризована по присутствию или отсутствию основных элементов симметрии, которыми являются: плоскость симметрии, центр симметрии и ось симметрии. Если молекула не имеет ни центра симметрии, ни плоскости симметрии, она хиральна, существует в виде пары энантиомеров.
Хиральность, следовательно, — это свойство соединении существовать в виде пары не совместимых между собой зеркальных изображений (от англ. chirality — принадлежность руке).
Хиральные соединения иначе называются дисимметричными. Техиральные молекулы, у которых нет оси симметрии, называют асимметричными. Таким образом, асимметричная молекула всегда хиральна, но не всякая хиральная молекула асимметрична. Молекулы, не имеющие энантиомеров, называют ахиральными. Хиральные молекулы содержат атом, вокруг которого размещены четыре разных атома или функциональные группы. Он называется хиральным атомом или хиральным центром. Кроме углерода хиральными могут быть атомы Р, N, Si и др. Если в соединении содержится n хиральных атомов, оно может существовать в количестве 2n стереоизомеров.
Ранее употреблявшийся термин асимметричный углерод в настоящее время не рекомендуется, так как хиральность и асимметричность не являются синонимами.
Хиральные соединения обладают оптической активностью, они способны вращать плоскость поляризованного света. Величину и направление вращения плоскости поляризации измеряют прибором поляриметром. Энантиомеры проявляют одинаковые химические и физические свойства, за исключением одного — направления вращения плоскости поляризованного света. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим (его обозначают знаком «+»), против часовой стрелки — левовращающим (обозначают «—»).
Эквимолярная смесь (т. е. смесь равного количества молекул) правого и левого энантиомеров называется рацемической (рацемат). Она не обладает оптической активностью, так как действия правовращающих и левовращающих молекул взаимно компенсируются. Для характеристики оптически активных соединений установлена константа — удельное оптическое вращение, под которым понимают величину вращения в угловых градусах при концентрации вещества 1 г/мл и толщине слоя измерения 1 дм, Удельное вращение обозначают знаком [а]tD где t — температура, при которой проводили измерение, a D — длина волны света (как правило, используют D — линию натрия, равную 546 нм).
Существуют две системы, характеризующие расположение атомов и группировок вокруг хиральных атомов. Одна из них, достаточно давно принятая и более широко распространенная (особенно для характеристики аминокислот и сахаров), имеет в основе сравнение конфигурации описываемого хирального соединения с глицеральдегидом (для моносахаридов и аминокислот) или с серином (для аминокислот). Этот относительный принцип обозначения форм сахаров и аминокислот был введен Э. Фишером (1898). Использовать при этом глицеральдегид в качестве «ключа» предложил М. А. Розанов в 1906 г. Та форма глицеральдегида, у которой на проекционном изображении ОН-группа расположена справа от оси углеродных атомов, была обозначена D-формой, а при нахождении ОН — слева от углеродной оси — L-формой:
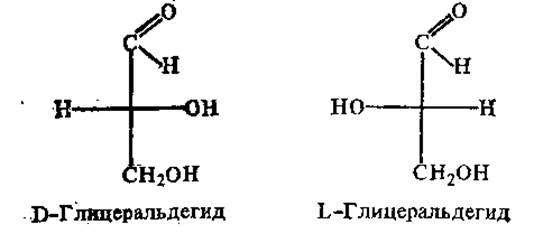
Чтобы определить, к D- или L-форме относится данный энантиомер аминокислоты, сравнивают конфигурацию его хирального центра с энантиомерами глицеральдегида. Если аминогруппа расположена справа от оси СООН—R, это D-аминокислота, при нахождении аминогруппы слева от оси СООН—R — L-форма.
Для обозначения энантиомеров моносахаридов сравнивают с глицеральдегидом расположение ОН-группы у последнего хирального атома, т. е. наиболее удаленного от альдегидной или кето-группы. Иногда к буквам D и L добавляют индексы s или g, которые указывают, серин (s) или глицерин (g) использованы в качестве «ключа».
В 1951 г. был найден способ определения абсолютной конфигурации, и в связи с этим предложена новая система описания хиральных центров без сравнения с каким-либо «ключевым» соединением — RS-система. Она нами не рассматривается, поскольку при определении конфигураций аминокислот и сахаров обычно используют D, L-систему.
Одним из частных случаев стереоизомерии является конформация. В правилах международной химической номенклатуры (1978) указывается, что пока нет общепринятого определения термина конформация. Наиболее часто употребляют следующее. Конформациями молекулы называют различные расположения ее атомов в пространстве, возникающие в результате вращения вокруг одинарных (о) связей.
В последние годы некоторые авторы распространяют это определение на двойные и другие связи. При наличии цикла под конформациями понимают формы молекулы, возникшие в результате изгибов плоскости цикла, изменения взаимного положения частей цикла. Молекулы, отличающиеся конформацией, называются конформационными изомерами или конформерами. В приложении к молекулам белков термин конформация характеризует пространственную структуру молекулы в целом.
2.2.3. Стереохимия аминокислот. Все аминокислоты, за исключением глицина, оптически активны и могут существовать в виде пары энантиомеров — D и L, поскольку углеродный атом, у которого водород замещен на группу NH2, является хиральным. Направление вращения плоскости поляризации обозначают знаком «+» или «—». Например, D(—)-аланин и L( 4-) -аланин. Необходимо указывать условия, при которых проводили измерение: природа растворителя, реакция среды, наличие в растворе солей. Так, L-гистидин в водном растворе обнаруживает удельное вращение, равное —39,3°, а в солянокислом растворе [a]20D = +11,1°. Знак и величина оптического вращения зависят также от природы боковой цепи аминокислоты (R-гpyппa).
Живые организмы различают L- и D-формы аминокислот. Показано, что дрожжи и плесневый гриб Penicillium glaucum используют L-глутаминовую кислоту и L-лейцин, но не усваивают D-формы этих аминокислот. Большинство D-изомеров обладают сладким вкусом, а L-формы аминокислот безвкусные или горькие.
В составе белков обнаруживаются только L-аминокислоты. Если гидролиз белков проводят в мягких условиях, то аминокислоты сохраняют свою оптическую активность. В процессе химического синтеза аминокислот или при их кипячении в присутствии сильных оснований происходит рацемация и образуется D,L-смесь аминокислот, не обладающая оптической активностью.
D-Формы аминокислот в природе встречаются редко. Они входят, например, в состав клеточных стенок некоторых микроорганизмов (см. разд. 6.4.4), являются компонентом пептидных антибиотиков (грамицидин, актицомицин D); очень редко обнаруживаются у растений.
2.2.4. Диссоциация аминокислот. Все а-аминокислоты существуют в водных растворах преимущественно в виде биполярных ионов или цвиттерионов с диссоциированной карбоксильной группой и протонированной аминогруппой:
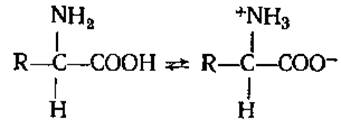
Биполярность структур молекул аминокислот обусловливает целый ряд их свойств, в частности хорошую растворимость большинства аминокислот в воде и сравнительно низкую в органических растворителях, большие дипольные моменты их молекул, высокие значения диэлектрических постоянных и температуры плавления. В зависимости от pH среды аминокислоты могут быть в форме анионов, катионов, электронейтральных биполярных ионов или в виде смеси этих форм с доминированием одной из них. В сильнокислых растворах аминокислоты присутствуют в виде положительных ионов, а в щелочных — в виде отрицательных ионов, т. е. аминокислоты представляют собой амфотерные электролиты:
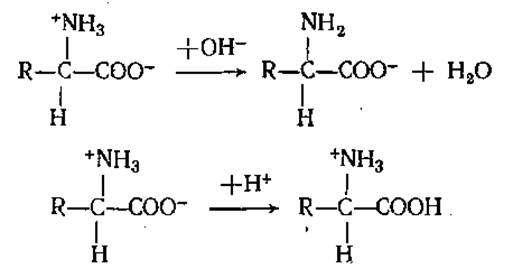
В соответствии со своей амфотерной природой аминокислоты в зависимости от состава раствора могут образовывать различные соли, реагируя как с кислотами, так и с основаниями:

Диссоциация аминокислот может быть хорошо понята с позиций теории кислот и оснований Бренстеда, согласно которой кислотой называют все те вещества, которые способны отдать протон, а основанием — все те, что способны его связать. С этой точки зрения группы СООН и H3N+ следует считать кислотами, а группы COO- и NH2 — основаниями.
Константы диссоциации карбоксильной (К1) и аминной групп (К2) или их отрицательные логарифмы (рК1 и рК2) численно равны концентрации водородных ионов (значения рН), при которой отношение диссоциированных форм к недиссоциированным равно динице, т.е. 50% аминокислоты находится в виде диполей, а 50% — в виде катионов и анионов.
Величины рК1и рК2 можно определить с помощью электрометрического титрования. Кривая титрования аланина соляной кислотой и гидроксидом натрия представлена на рис. 2.1. Как видно из рисунка, титрование аланина (и других моноаминомонокарбоновых кислот) носит двухстадийный характер, вследствие чего кривая титрования состоит из двух четко различающихся ветвей. Точки перегиба этих ветвей соответствуют значениям pK1 и рК2 и равны соответственно 2,34 и 9,69. При значении рН ниже pK1 все нейтральные аминокислоты несут положительный заряд, а при pH выше рК2 — отрицательный. В точке перехода между ветвями молекула аминокислоты не несет заряда, так как число отрицательных и положительных ионов одинаково.
Значение pH, при котором суммарный заряд аминокислоты равен нулю, т.е. молекула электронейтральна, называется изоэлектрической точкой ИЭХ (рI). При этом рН не происходит перемещения аминокислоты в электрическом поле. pH раствора чистой аминокислоты в воде назьвается изоионной точкой. Изоэлектрические и изоионные точки аминокислоты в разбавленных растворах приблизительно совпадают.
Изоэлектрическую точку для моноаминомонокарбоновых кислот можно найти путем деления суммы рК1 и рК2 на 2. В нашем случае: (2,34+9,69)/2 = 6.02. В изоэлектрической точке аминокислоты не проявляют буферных свойств, их буферная емкость максимальна при pH, равных значениям рК кислотных групп. Если известны величины pK1 и рК2, то можно рассчитать соотношение различных видов ионов для любого значения pH.
Кривые титрования аминокислот с ионизирующимися R-гpyппами (например, гистидин, лизин, глутаминовая кислота) имеют более сложный характер, поскольку кривые, описывающие диссоциацию R-групп, накладываются на кривые диссоциации а-карбоксильных и а-аминогрупп. Диссоциация боковых R-групп идет следующим образом:
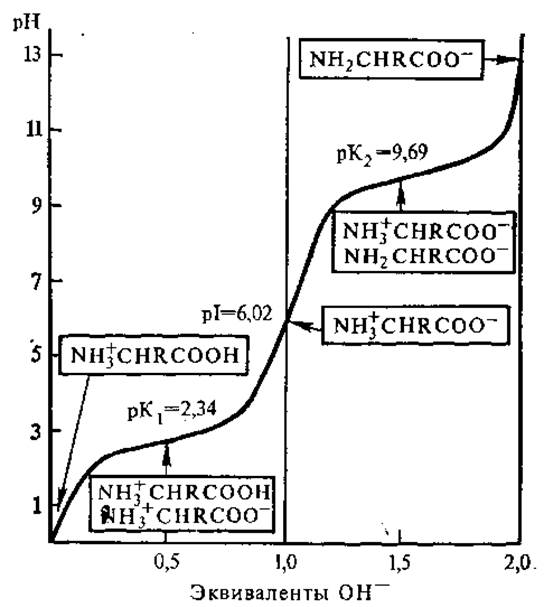
Рис. 2.1. Кривая титрования аланина (в рамках указаны виды ионов, преобладающих в точках перегиба кривой)
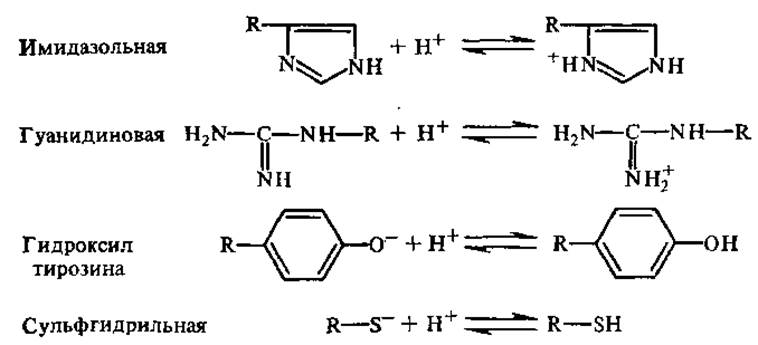
Величины рК диссоциирующих группировок некоторых аминокислот приведены в табл. 2.1.
Таблица 2.1. Значения рК диссоциирующих групп некоторых аминокислот (при +25 С)
Аминокислота |
рК1 |
рК2 |
Название R-группы и рК3 |
Аленин |
2,34 |
9,69 |
|
Лейцин |
2,19 |
9,60 |
— |
Аспарагиновая |
1,88 |
9,60 |
ß-Карбоксильная 3,65 |
Глутаминовая |
2,19 |
9,67 |
у-Карбоксильная 3,22 |
Гистидин |
1,82 |
9,17 |
Имидазольная 6,00 |
Лизин |
2,18 |
8,95 |
ε-Аминогруппа 10,53 |
Аргинин |
2,17 |
9,04 |
Гуанидиновая 12,48 |
Тирозин |
2,20 |
9,11 |
Фенольный гидроксил 10,07 |
Цистеин |
1,96 |
10,28 |
Сульфгидрильная 8,18 |
Сравнение величин рК диссоциирующих групп разных аминокислот позволяет заключить, что у большинства аминокислот достаточно близки значения как рК а-СООН групп (2,1—2,3), так и рК а-NН+3 групп (9,1—9,6). Карбоксильные группы моноаминомоно-карбоновых кислот имеют более сильную кислотность, чем карбоксилы соответствующих алифатических кислот (положительно заряженные а-аминогруппы способствуют отталкиванию H+ карбоксила). Например, у аланина pK1 = 2,34, а у соответствующей ему пропионовой кислоты рК1 = 4,85. Аминогруппа лизина и гуанидиновая группа аргинина характеризуются сильно выраженными основными свойствами, при pH 7 их суммарный заряд положителен. Гидроксильная группа тирозина и сульфгидрильная группа цистеина имеют слабо выраженные кислотные свойства.
2.2.5. Спектры поглощения аминокислот. Ни одна из двадцати аминокислот, входящих в состав белков, не поглощает свет в видимой части спектра, а только в дальней ультрафиолетовой области (<220 нм). Тирозину, фенилаланину и особенно триптофану свойственно заметное поглощение в ультрафиолетовой области спектра (260—280 нм). Цистин обладает слабым поглощением при 240 нм вследствие наличия в нем дисульфидной группы.
2.2.6. Растворимость. За некоторым исключением, аминокислоты хорошо растворимы в воде. С увеличением углеводородного бокового радикала растворимость в воде падает, а в спирте возрастает (рис. 2.2).
2.2.7 Химические свойства аминокислот. Одной из наиболее характерных реакций а-аминогруппы является ее взаимодействие с нингидрином. Эта реакция может быть использована для количественного определения аминокислот, содержащихся в растворе в очень небольших концентрациях. При pH выше 5 реакция протекает в две стадии. В 1-й стадии образуется восстановленный нингидрин за счет окислительного дезаминирования аминокислоты. Одновременно происходит и ее декарбоксилирование.
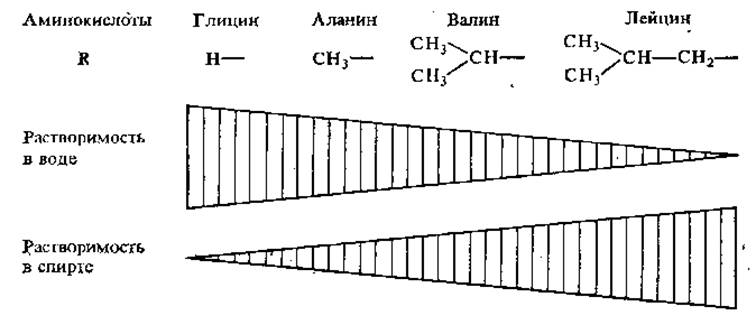
Рис. 2.2. Растворимость аминокислот
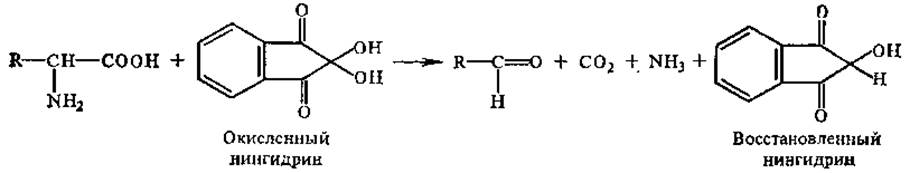
На 2-й стадии реакции образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт (пурпур Руэманна) с максимумом поглощения при 580 нм, интенсивность окраски которого пропорциональна количеству аминокислоты.
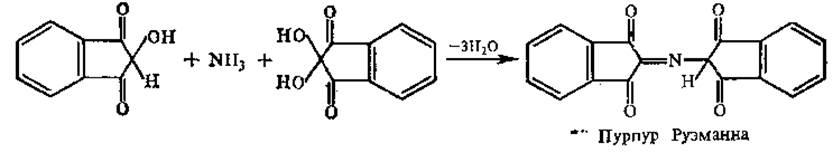
Пролин и оксипролин, содержащие замещенные а-аминогруппы, образуют с нингидрином производные, окрашенные в желтый цвет (максимум поглощения при 440 нм), и не образуют аммиака.
Реакция с нингидрином не является специфической, ее дают многие другие соединения, содержащие аминогруппы, в том числе белки, аммиак, с тем лишь отличием, что при этом не выделяется СО2. Образование СО2 специфично для а-аминокарбоновых кислот. Эту реакцию используют в хроматографии для выявления аминокислотах количественное определение в автоматических анализаторах производят путем измерения окраски, возникающей при взаимодействии последовательно выделяющихся с колонки аминокислот с нингидрином.
Благодаря наличию аминогруппы аминокислоты реагируют также с азотистой кислотой (1) и с формальдегидом (2).
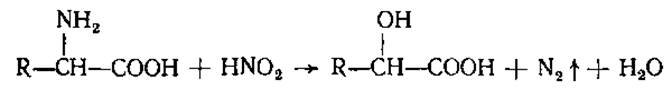 (1)
(1)
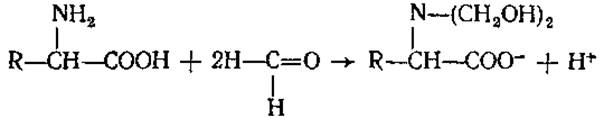 (2)
(2)
Данные реакции применяются для количественного определения аминокислот (метод Ван-Слайка — по измерению объема выделившегося газообразного азота, и формольный — путем титрования щелочью освободившегося после добавления формальдегида протона).
Очень важными реакциями на а-аминогруппы являются реакция Сенгера с 1-фтор-2,4-динитробензолом и реакция Эдмана с фенил-изотиоцианатом. Они представляют исключительную ценность для идентификации N-концевых аминокислот полипептидных цепей (см. разд. 2.4.2).
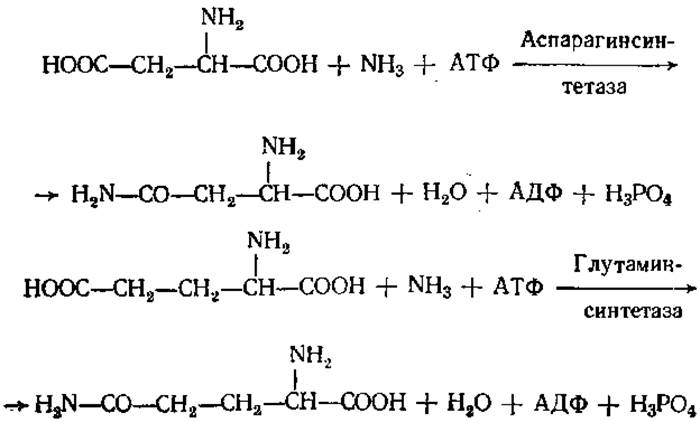
Интересной и важной является реакция образования амидов аспарагиновой и глутаминовой кислот. В природе эти реакции идут обычно с использованием энергии АТФ:
При декарбоксилировании аминокислот образуются амины:
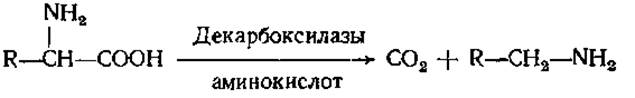
Амины обычно существуют в виде жидкости с резким запахом и щелочной реакцией. Многие из них обладают хорошо выраженной физиологической активностью. Так, продукт декарбоксилирования гистидина — гистамин имеет широкий спектр биологического действия. Он обладает сосудорасширяющими свойствами, чем отличается от других биогенных аминов, оказывающих сосудосуживающий эффект. В большом количестве гистамин образуется в местах воспалительного процесса. Вызывая расширение сосудов в очаге воспаления, он ускоряет тем самым приток лейкоцитов. Содержание гистамина резко возрастает при радиоактивном облучении, травматическом шоке. Он способствует также выделению желудочного сока с повышенным содержанием соляной кислоты, играет существенную роль в явлении аллергии и в болевом синдроме. Гистамин содержится в яде пчел и ряда животных, в большом количестве присутствует в спорынье.
Большой интерес представляют диамины путресцин и кадаверин, возникающие в результате декарбоксилирования орнитина и лизина.
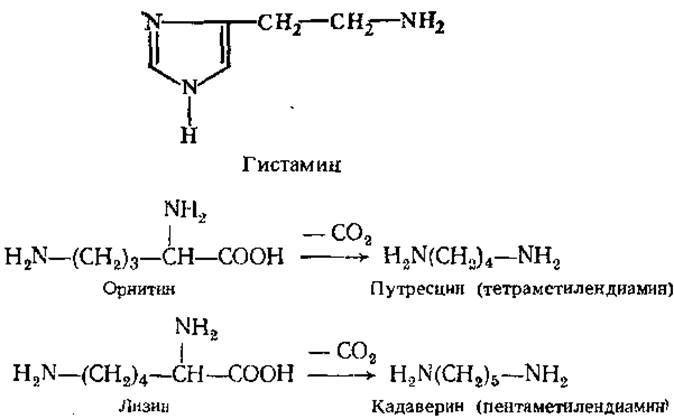
Кадаверин и путресцин образуются при расщеплении белков гниющих трупов (от лат. cadaver — труп, putresko — тлеть, гнить) и могут быть причиной отравления, вызванного испорченным мясом. Их образование возможно в кишечнике человека при некоторых кишечных инфекционных заболеваниях. В норме небольшие количества этих диаминов быстро нейтрализуются уже в клетках слизистой оболочки кишечника путем связывания аминогрупп, например, их ацетилированием, а также путем расщепления в процессе окислительного дезаминирования. Продукты деградации этих веществ выводятся через почки с мочой. В малых концентрациях путресцин стимулирует синтез РНК, ускоряет рост клеток животных и бактерий.
Очень важными производными аминов являются адреналин и норадреналин — гормоны мозгового слоя надпочечников, образующиеся из тирозина (см. разд. 12.6.6.).
Радикалы аминокислот исключительно разнообразны, что дает возможность для обнаружения большинства аминокислот использовать цветные реакции. Многие из них весьма чувствительны и специфичны, позволяют определять ничтожные количества той или иной индивидуальной аминокислоты в составе сложных смесей, биологических жидкостях, белках. Некоторые цветные реакции находят применение при количественном определении аминокислот и белков.
Аминокислоты могут вступать в реакцию с соединениями, имеющими карбонильную группу, например с восстанавливающими сахарами, в результате чего из аминокислоты образуется соответствующий альдегид, а из углевода — фурфурол или оксиметилфурфурол. Альдегиды, образующиеся из аминокислот, обладают приятным запахом. Сочетание запахов разных альдегидов и определяет, в основном, аромат пищевых продуктов. Фурфуроли оксиметилфурфурол в свою очередь способны взаимодействовать с аминокислотами, давая темноокрашенные продукты, называемые меланоидинами. Синтез меланоидинов является причиной потемнения многих пищевых продуктов при их приготовлении, сушке и хранении. Особенно интенсивно реакция меланоидинообразования протекает при повышенных температурах, например при сушке плодов, овощей, солода, при топлении молока, выпечке хлеба (придает цвет корке), при обработке вина теплом и т. п.
2.2.8. Характеристика отдельных аминокислот, входящих в белки. Моноаминомонокарбоновые аминокислоты. Глицин (гликокол, а-аминоуксусная кислота)
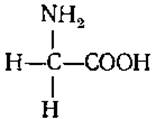
Единственная оптически неактивная аминокислота. Имеет сладкий привкус и является одной из самых распространенных. Особенно много ее в желатине. Является предшественником при биосинтезе пуринов, порфириновой части гемоглобина, хлорофилла, геминовых ферментов. Участвует в образовании клеточных стенок бактерий. Функционирует как тормозной медиатор в спинном мозге и в большинстве структур ствола мозга, где находится в высоких концентрациях.
L-Аланин (а-аминопропионовая кислота)
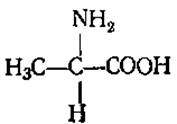
Содержится практически во всех белках. Играет большую роль в обмене азотистых соединений. Может быть исходным продуктом для синтеза каротиноидов, каучука, жиров и углеводов.
L-Валин (а-аминоизовалериановая кислота)
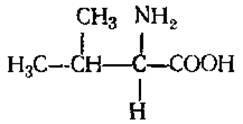
Обладает способностью к гидрофобным взаимодействиям, что важно при создании и стабилизации структуры белковой молекулы. Содержится во многих белках, но обычно в небольших количествах. Участвует в синтезе алкалоидов, некоторых циклопептидов, пантотеновой кислоты, пенициллина.
L-Лейцин (а-аминоизокапроновая кислота)
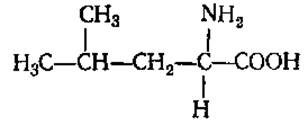
L-Изолейцин (а-амино-β-этил-β-метилпропионовая кислота)
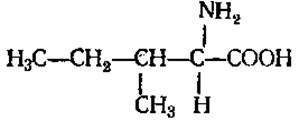
Обе аминокислоты плохо растворимы в воде. В белках содержатся в незначительных количествах, способны к гидрофобным взаимодействиям. Являются источником сивушных масел при брожении.
L-Серин (а-амино-β-оксипропионовая кислота)
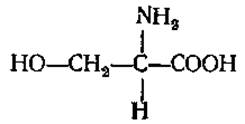
Играет большую роль в обмене веществ любого организма. Входит в состав фосфолипидов (фосфатидилсерины), полипептидов брадикинина и каллидина, участвует в построении активного центра некоторых протеолитических ферментов, синтезе аминоспирта сфингозина (компонент сфинголипидов). В некоторых белках, таких, как казеин молока или вителлин яичного желтка, содержится в виде сложного эфира — так называемой серинфосфорной кислоты, которая играет важную роль в метаболизме молодого растущего животного организма. У растений образуется в ходе фотодыхания из глицина.
L-Треонин (а-амино-β-оксимасляная кислота)
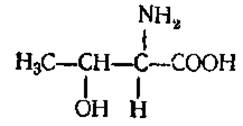
Участвует в синтезе витамина B12, антибиотика актиномицина D. L-Цистеин (а-амино-β-меркаптопропионовая кислота)
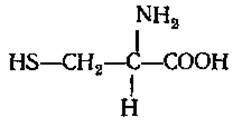
Играет большую роль в обмене веществ растений и животных как источник серы, а также в связи с наличием сульфгидрильной SH-группы, являющейся восстанавливающим агентом. Входит в состав трипептида глютатиона, в виде амина в кофермент А, присутствует в активном центре многих ферментов. В молекулах белков и пептидов (инсулин, АКТГ и др.) принимает участие в образовании дисульфидных связей между полипептидными цепями или внутри одной цепи, отсюда его важная роль в образовании третичной структуры белковой молекулы. Является тем соединением, в виде которого некоторые микроорганизмы и растения метаболизируют сероводород. Из двух молекул цистеина при их окислении получается цистин. Столь же легко происходит и обратный переход. Таким путем образуется одна из важнейших окислительновосстановительных систем живых организмов:
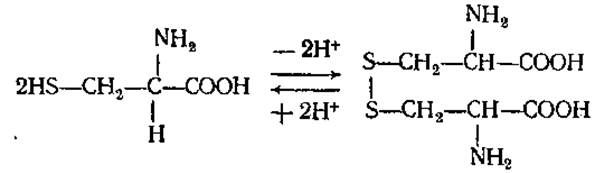
В белках цистин преобладает над цистеином. В больших количествах он содержится в белках волос, рогов, копыт.
L-Метионин (а-амино-у-метилтиомасляная кислота)
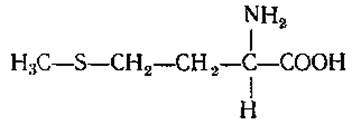
Является одним из основных доноров метильных групп при синтезе углеводов клеточной стенки растений, холина, адреналина, креатина, стеринов и источником серы при образовании тиамина. Из него могут образовываться и другие серосодержащие аминокислоты. Много метионина в белке молока — казеине. Как липотропный фактор является лечебным препаратом при атеросклерозе.
Диаминомонокарбоновые аминокислоты.
L-Лизин (а, ε-диаминокапроновая кислота)
Содержится почти во всех белках, особенно много его в белках молок рыб, относящихся к протаминам и гистонам. Является исходным продуктом при синтезе алкалоидов (анабазин, никотин, лупанин, кониин). Участвует своей ε-аминогруппой в образовании комплекса между белковой частью фермента и коферментом, например в биотин-зависимых ферментах.
Содержится в незначительных количествах в белках семян злаковых, особенно кукурузы, что существенно обесценивает кормовые свойства последней. Советские селекционеры, лауреаты Государственной премии М. И. Хаджинов и Г. С. Галеев вывели ряд сортов кукурузы с повышенным содержанием лизина.
L-Аргинин (а-амино-δ-гуанидил-n-валериановая кислота)
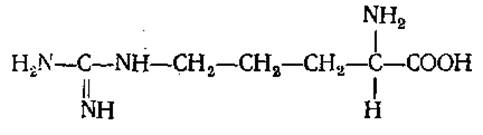
Содержится во всех белках. Входит в большом количестве в состав основных белков-гистонов и протаминов, в связи с чем его много в белках рыбьих молок. Играет большую роль в белковом обмене, участвуя в синтезе мочевины, креатина. В виде фосфоаргинина в мышцах беспозвоночных выполняет функцию, аналогичную функции фосфокреатина у высших животных.
Моноаминодикарбоновые аминокислоты. L-Аспарагиновая кислота, аспартат (а-аминоянтарная кислота)
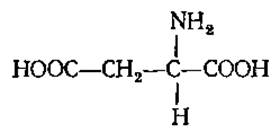
Очень плохо растворима в воде, ее раствор имеет кислую реакцию. Содержится в больших количествах во всех растительных белках и играет важную роль в обмене веществ у растений и животных, в частности, принимая участие в реакциях переаминирования, образовании мочевины, креатина, циклопептидов. При ее декарбоксилировании образуется а- или ß-аланин, необходимый для синтеза карнозина, ансерина и коэнзима А (КоА). Амид аспарагиновой кислоты — аспарагин накапливается в очень больших количествах при прорастании семян бобовых растений, особенно в темноте, из-за отсутствия углеводов или при избытке аммиака. Аспарагин обнаружен в плазме крови и в составе некоторых животных белков (инсулин, гемоглобин, миоглобин и др.). У человека и животных аспарагин, как и аспарагиновая кислота, активно участвует в реакциях переаминирования, служит предшественником при синтезе пуриновых и пиримидиновых оснований, никотиновой кислоты, у растений является запасной и транспортной формой азота.
L-Глутаминовая кислота (глутамат, а-аминоглутаровая кислота)
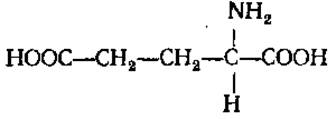
В водных растворах дает кислую реакцию. Содержится в больших количествах во всех белках. Входит в состав витамина фолиевой кислоты, глутатиона. Наряду с аспарагиновой кислотой играет первостепенную роль в аминокислотном обмене, активно участвуя в реакциях переаминирования, дезаминирования, прямого аминирования. При декарбоксилировании глутаминовой кислоты образуется у-аминомасляная кислота, имеющая большое значение в метаболизме мозга, усиливающая, в частности, процессы торможения, и δ-аминолевулиновая кислота, участвующая в синтезе порфиринов. Амид глутаминовой кислоты — глутамин, является транспортной формой азота у животных и растений, исходным соединением при синтезе пуриновых и пиримидиновых оснований, никотиновой кислоты. Мононатриевая соль глутаминовой кислоты служит вкусовой приправой, обладая вкусом и запахом куриного бульона.
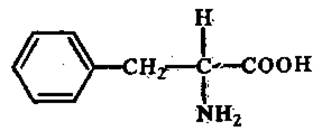
Циклические аминокиcлоты L-Фенилаланин
(а-амино-β-фенил-пропионовая кислота)
Содержится во всех белках. Участвует в биосинтезе флавоноидов, алкалоидов. Обладает способностью к гидрофобным взаимодействиям. Обусловливает ксантопротеиновую реакцию на белки. В состав молекулы грамицидина и антибиотика тироцидина входит D-фенилаланин, который в свободном виде в природе не обнаружен.
L-Тирозин (а-амино-β-гидроксифенилпропионовая кислота)
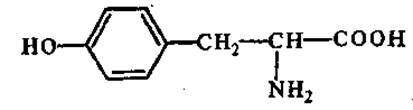
Одна из наиболее распространенных в природе аминокислот; содержится во всех белках (за исключением некоторых протаминов). Является исходным субстратом для синтеза гормонов (тироксин, норадреналин, адреналин), алкалоидов (морфин, кодеин, папаверин). Окисление тирозина под влиянием тирозиназы приводит к образованию меланинов (пигмент кожи, волос, перьев).
L-Триптофан (а-амино-β-индолилпропионовая кислота)
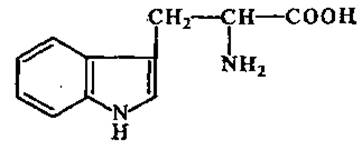
Находится почти во всех белках. Бедны триптофаном семена злаков. При кислотном гидролизе белков распадается. Триптофан служит исходным продуктом для синтеза никотиновой кислоты (витамин РР), гетероауксина.
L-Гистидин (а-амино-β-имидазолпропионовая кислота)
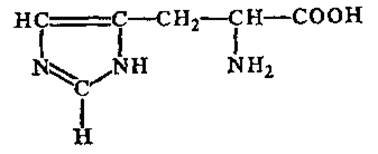
Принадлежит к группе основных аминокислот — в водных растворах дает щелочную реакцию. Значительное количество гистидина содержится в глобине — белковом компоненте гемоглобина крови. Входит в активные центры некоторых протеолитических ферментов.
L-Пролин (пирролидин-а-карбоновая кислота)
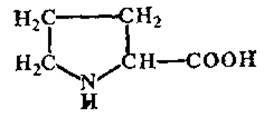
Является иминокислотой. Хорошо растворим в спирте. Особенно велико содержание пролина в белках семян злаков (проламины), в коллагене, эластине и белке эмали зубов. Входит в состав ряда антибиотиков циклопептидов — грамицидина, лихениформина, актиномицина D.
L-Оксипролин
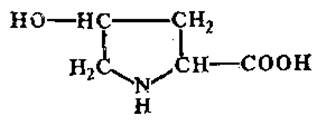
Является производным L-пролина. Значительные его количества обнаружены в белках клеточных оболочек, желатине, коллагене.
2.2.9. Аминокислоты, редко встречающиеся в белках, и небелковые аминокислоты. Кроме обычных 20 аминокислот из белков удалось выделить в небольших количествах другие редко встречающиеся аминокислоты:
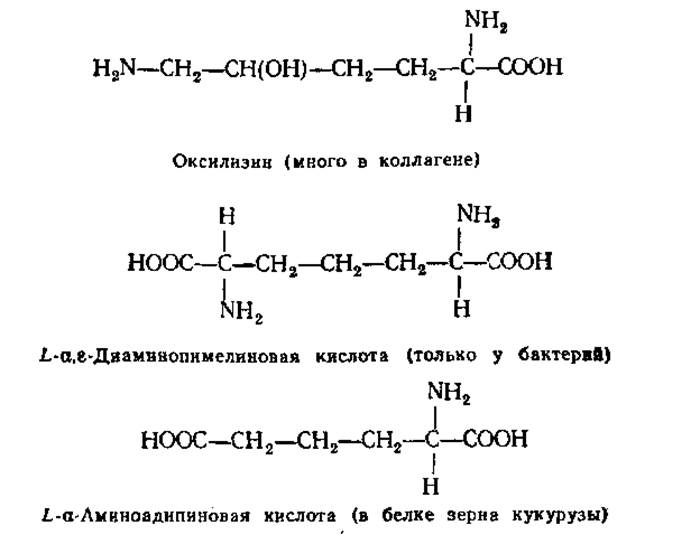
Свыше 150 аминокислот, обнаруженных в живых организмах, не входят в состав белков. Некоторые из них играют важную роль в обмене веществ.
ß-Аланин (β-аминопропионовая кислота)
Н2N—CH2—CH2—COOH
Является составной частью кофермента А (см. разд. 3.4.1), витамина В3 (пантотеновая кислота), карнозина, ансерина. Встречается также в свободном виде. Оказывает тормозящий эффект на центральную нервную систему.
L-Орнитин (а, δ-диаминовалериановая кислота)
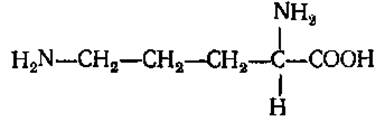
Легко образуется из аргинина под действием фермента аргиназы. Принимает участие в образовании мочевины, а также в синтезе алкалоидов и антибиотика грамицидина.
L-Цитруллин (а-амино-δ-карбамидовалериановая кислота)
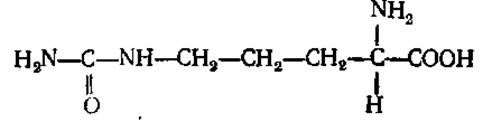
Является промежуточным продуктом при синтезе мочевины. Встречается в свободном виде в соке плодов арбуза (Citrullus), откуда и получил свое название.
у-Аминомасляная кислота (ГАМК)
H2N—СHЗ—CH2—CH2—COOH
Содержится во многих растениях, в тканях мозга млекопитающих, некоторых земноводных, птиц. Образуется в мозге при участии глутаматдекарбоксилазы:
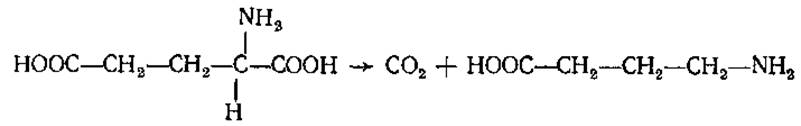
У животных функционирует в качестве химического агента при передаче нервного импульса, т. е. является нейромедиатором. Полагают, что в количественном отношении ГАМК является главным тормозным медиатором в нервной системе. Наличие ГАМК в центральной нервной системе необходимо также для нормального течения обмена веществ: под ее влиянием усиливаются энергетические процессы, повышается дыхательная активность тканей головного мозга, улучшается утилизация мозгом глюкозы, активируются многие ферменты дыхания, улучшается кровоснабжение мозга, стимулируется удаление из мозга токсических продуктов. ГАМК используют как лечебный препарат под названием «Аминалон» или «Гаммалон».