Основы биохимии - А. А. Анисимов 1986
Интеграция и регуляция метаболизма
Регуляция метаболизма через ферментативный аппарат
Поскольку практически все биохимические реакции протекают при участии ферментов, важнейшим путем регуляции метаболизма является изменение функциональной активности ферментативного аппарата. Оно может достигаться благодаря изменению количества тех или иных ферментов в клетке, активности существующих молекул ферментов, а также количественного соотношения субстратов и ферментов при участии мембран. Увеличение и уменьшение количества ферментов является результатом регуляции их биосинтеза, подробно этот вопрос рассмотрен в разд. 5.3.
Регуляция активности ферментов по сравнению с регуляцией их биосинтеза является более быстродействующей и более тонкой, чувствительной к изменению концентрации отдельных метаболитов в клетке. Вопросы влияния физико-химических условий среды (в частности, pH, t°) на активность ферментов, типы специфического обратимого ингибирования ферментов соединениями, конкурирующими за активный центр, освещены в гл. 3. В связи с этим в данном разделе рассматриваются иные пути регуляции активности ферментов: аллостерическая и мембранная регуляция, ковалентная модификация ферментов и др.
Регуляция ферментативной активности по аллостерическому типу характерна для так называемых аллостерических или регуляторных ферментов. Под аллостерическими эффектами понимают такие эффекты, когда обратимое связывание ферментами некоторых метаболитов (эффекторов) вызывает увеличение или уменьшение активности фермента в результате изменения его сродства к субстрату. Связывание эффекторов происходит в специфических участках ферментов, отличных от активных центров, — аллостерических центрах (от греч. аллос — другой).
Различают положительные эффекторы — метаболиты, вызывающие аллостерическую активацию, и отрицательные, связывание которых с ферментом снижает скорость реакции благодаря аллостерическому ингибированию. Ферменты могут быть моновалентными, т. е. иметь один аллостерический эффектор, и поливалентными.
Специфичность аллостерических центров к эффекторам может быть абсолютной или относительной аналогично специфичности активных центров к субстратам. Подавляющее большинство аллостерических ферментов имеет четвертичную структуру, в образовании которой принимают участие идентичные или неидентичные субъединицы. У одних регуляторных ферментов каждая субъединица содержит каталитический и аллостерический центры, у других — эти центры локализованы на разных субъединицах. Однако не все ферменты с четвертичной структурой способны к регулированию по аллостерическому типу.
Механизм действия- аллостерических эффекторов заключается в том, что они, соединяясь с аллостерическим центром, изменяют конформацию фермента, что приводит к изменению сродства последнего к субстрату, т. е. снижению или повышению каталитической активности. Субъединицы аллостерических ферментов отвечают на связывание эффекторов кооперативно: изменение конформации одной из субъединиц в результате связывания эффектора влияет на конформацию не только этой, но и других субъединиц и изменяет их сродство к субстрату. Кооперативное взаимодействие субъединиц у ряда регуляторных ферментов наблюдается и под действием субстрата, в этом случае связывание первой молекулы субстрата с одной из субъединиц изменяет сродство к субстрату остальных субъединиц: при положительной кооперативности сродство увеличивается, при отрицательной — уменьшается. Характер и меру кооперативности отражает коэффициент Хилла (h). При h = 1 кооперативности отсутствует, при h < 1— отрицательная кооперативно, при h > 1 — положительная. Чем выше h, тем сильнее кооперативности, в пределе коэффициент Хилла равен числу центров связывания.
Мысль об изменении конформации у регуляторных ферментов под влиянием эффекторов или субстратов и кооперативном взаимодействии субъединиц фермента возникла на основе сходства кинетического поведения аллостерических ферментов и гемоглобина при насыщении его кислородом (см. разд. 2.5.3). У аллостерических ферментов графики зависимости V от концентрации субстрата или эффектора имеют вид сигмоидной, или S-образной, кривой, а графики, построенные на основе обратных величин, нелинейны (рис. 12.2).
Сигмоидный характер зависимости V от [S] у аллостерических ферментов обнаруживается только в отсутствие насыщающих концентраций эффекторов. В случае избытка аллостерических эффекторов все субъединицы ферментативных молекул находятся в активной конформации и их каталитические центры функционируют не по кооперативному принципу, независимо друг от друга. Такая же автономность в работе активных центров субъединиц характерна и для неаллостерических ферментов с четвертичной структурой, кинетика которых подчиняется уравнению Михаэлиса — Ментен.
Наличие сигмоидной кинетики у регуляторных ферментов делает их более чувствительными к изменению концентрации метаболитов. Так, если зависимость скорости реакции от концентрации эффектора или субстрата следует уравнению Михаэлиса — Ментен, то для увеличения скорости в девять раз в ряде случаев необходимо повысить концентрацию метаболита примерно в 80 раз, т. е. не обходимо существенное изменение состава окружающей среды. Однако концентрация основных метаболитов в клетке не может изменяться в столь широких пределах, а потребности в многократных изменениях скорости реакции возникают довольно часто. В связи с этим регуляция метаболизма по обычным законам ферментативной кинетики не обеспечивает необходимого контроля ферментативной активности.
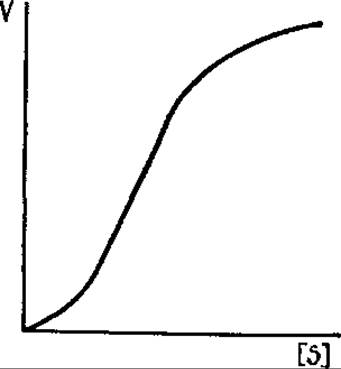
Рис. 12.2. Зависимость скорости реакции (V), катализируемой аллостерическим ферментом, от концентрации субстрата [S]
В случае сигмоидной кинетики, относительно небольшие изменения концентрации метаболита приводят к существенным изменениям в скоростях. Так, увеличение скорости реакции, как и в предыдущем случае, в девять раз достигается только четырехкратным увеличением концентрации метаболита. Таким образом, кооперативность связывания обеспечивает значительные изменения активности фермента в ответ на небольшие колебания в концентрации метаболитов. Следует, однако, иметь в виду, что сигмоидный характер зависимости скорости ферментативной реакции от концентрации субстрата не указывает однозначно на кооперативное взаимодействие нескольких центров в ферментативной молекуле. Сигмоидная зависимость V от [S] возможна и при наличии одного активного центра (кажущаяся кооперативность), что может быть связано, например, с существованием более чем одного пути присоединения субстрата к ферменту. В свою очередь, не все аллостерические ферменты обнаруживают сигмоидную кинетическую кривую.
Регуляция по аллостерическому типу наиболее характерна для ферментов, катализирующих ключевые анаболические реакции. Если в системе накопится много конечного продукта, то его образование будет заингибировано в результате того, что конечный продукт выступит в роли отрицательного эффектора первого фермента в метаболическом цикле, ведущем к синтезу этого продукта. Такое ингибирование называется ингибированием по типу обратной связи или ретроингибированием. Подобного рода влияние, например, оказывает ФЕП (продукт одной из завершающих реакций гликолиза) на фермент подготовительной стадии этого процесса — фосфофруктокиназу. К регуляторным ферментам такого типа относится и треониндезаминаза, катализирующая первую пусковую реакцию синтеза изолейцина из треонина. Конечный продукт этой цепи реакций — изолейцин избирательно ингибирует треониндезаминазу.
Аллостерическая регуляция ферментативной активности происходит и при активации предшественником, когда метаболит, действующий как аллостерический эффектор, активирует фермент, катализирующий превращение либо этого же метаболита, либо продукта, находящегося немного дальше в цепи превращений (форактивация). Так действует фруктозо-1,6-дифосфат, активирующий фермент гликолиза фосфоенолпируваткиназу. Встречаются и другие пути контроля метаболизма по аллостерическому механизму.
Ферменты могут иметь один или несколько аллостерических ингибиторов и активаторов. Например, фосфофруктокиназа у Е. соli ингибируется ФЕП, цитратом и активируется АДФ и ГДФ, ФЕП — карбоксилаза ингибируется аспартатом и малатом, активируется ацетил-КоА, ГТФ, УТФ, фруктозо-1,6-дифосфатом, а МДГ ингибируется только НАДН. К числу важных эффекторов относятся адениннуклеотиды (индикаторы энергетического состояния клетки); их соотношение — регулятор активности ферментов центральных метаболических путей.
Различные изоферменты, а также один и тот же по специфичности фермент, выделенный из разных организмов, благодаря некоторому отличию в структуре могут иметь разную чувствительность к аллостерическим эффекторам, т. е. обладать разными регуляторными свойствами. Так, если клетка продуцирует несколько множественных молекулярных форм фермента, то ингибированию продуктом реакции по типу отрицательной обратной связи может подвергаться только одна из форм.
Изменение активности ферментов часто усиливается с помощью так называемого каскадного механизма, при этом первый фермент увеличивает активность второго, второй — третьего и т. д. Примером изменения активности фермента по каскадному механизму является регуляция работы гликоген-фосфорилазы мышц.
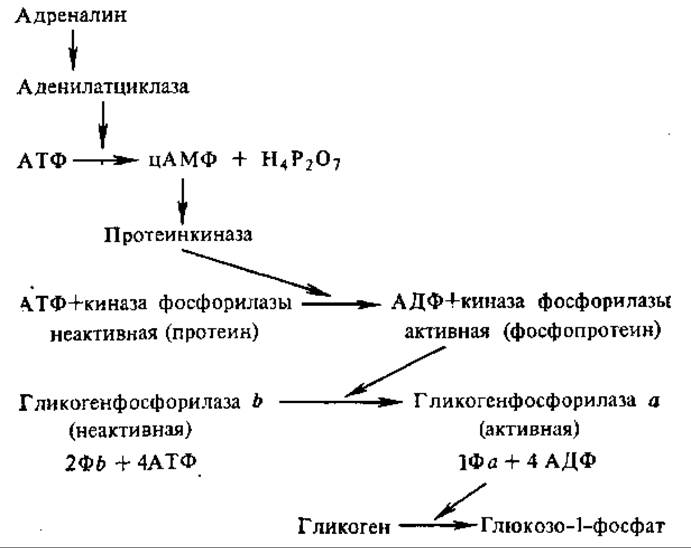
Биологический смысл каскадности заключается в том, что она придает процессу активации ферментов взрывной характер, позволяет в короткий срок осуществить активацию большого числа молекул фермента. В приведенном ферментном каскаде одна молекула гормона «включает» в работу несколько молекул аденилат-циклазы, каждая из которых катализирует образование большого числа цАМФ. На этом этапе сигнал усиливается в 102—103 раз. Сигнал возрастает еще примерно в 100 раз при активации протеин-киназы АМФ» а затем увеличивается и до 106—107 раз за счет включения киназы фосфорилазы и самой фосфорилазы. Одна из причин усиления сигнала при активации гликоген-фосфорилазы — более высокая концентрация фермента на каждом последующем этапе по сравнению с предыдущим. Так, молярное соотношение трех ферментов — протеинкиназы, киназы фосфорилазы и гликоген-фосфорилазы в мышцах составляет примерно 1 : 20 : 120.
Изменение активности ферментов происходит и в результате их ковалентной модификации при участии специальных ферментов. Для эукариотических организмов наиболее характерна модификация ферментов за счет фосфорилирования — дефосфорилирования. Характерным примером в этом плане является активация гликоген-фосфорилазы. За счет фосфорилирования регулируется активность и гликоген-синтазы, перенос фосфатной группы от АТФ на остаток серина переводит фермент в неактивную форму. Модификация белков путем фосфорилирования осуществляется ферментами про- теинкиназами, а дефосфорилирование — фосфатазами.
Роль ковалентной модификации как фактора регулирования ферментативной активности показана и на примере ряда полиферментных систем (пируват- и а-кетоглутаратдегидрогеназных систем), участвующих в окислительном декарбоксилировании а-кето-кислот. В таких системах, отличающихся высокой организацией, различные ферменты объединены в комплекс и функционируют совместно. С дигидролипоилтрансацетилазой пируватдегидрогеназной системы (см. разд. 6.9.5) связано несколько молекул киназы пируватдегидрогеназы, которая за счет АТФ катализирует фосфорилирование серинового остатка в пируватдегидрогеназе. Фосфорилированный фермент не способен декарбоксилировать пируват. НАДН, ацетил-КоА, АТФ являются активаторами киназы пируватдегидрогеназы. Вместе с тем с трансацетилазой в пируватдегидрогеназной системе связано несколько молекул Ca2+-Mg2+-зaвисимой фосфатазы, действие которой восстанавливает активность пируватдегидрогеназы за счет отщепления остатка ортофосфата.
Помимо модификации путем фосфорилирования известны также и другие типы модификации: например, аденилирование — деаденилирование (у глутаминсинтетазы Е. coli), ацетилирование — деацетилирование (у цитрат-лиазы Rhodopseudomonas gelatinosa), метилирование, гидроксилирование. Аденилирование тирозина (перенос АМФ от АТФ) в глутаминсинтетазе приводит к падению ее активности, а ацетилирование цитрат-лиазы — к активации.
Уровень активности ряда ферментов зависит и от перехода их из проферментной формы (зимоген) в активный фермент обычно в результате частичного протеолиза, путем отщепления от зимогена пептидов. В виде зимогенов синтезируются ферменты, функционирующие вне клеток. Зимогенами, например, являются трипсиноген, химотрипсиноген, которые после синтеза в поджелудочной железе секретируются в тонкий кишечник и там активируются (см. разд. 5.6.1).
Регуляция активности ферментов может происходить и за счет белок-белковых взаимодействий, они важны, например, при работе лактозосинтазы. Этот фермент представляет собой комплекс специфической галактозилтрансферазы (неактивной в отношении синтеза лактозы) и белка молока а-лактальбумина. Присоединение последнего к галактозилтрансферазе придает ей лактозосинтазную активность. Предполагают, что регуляция за счет белок-белковых взаимодействий происходит в дыхательной цепи на уровне цитохромов; предыдущий переносчик электронов активирует последующий при их столкновении в фосфолипидном слое мембраны.
Довольно общим регулятором ферментативной активности являются мембраны. В настоящее время показано, что многие ферменты в клетке связаны с мембранами и изменение состава, свойств мембран может оказывать влияние на активность мембраносвязанных ферментов. Обратимая адсорбция ферментов на субклеточных структурах, контролируемая клеточными метаболитами, также может быть фактором регуляции ферментативной активности. Идея о существовании такого механизма регуляции ферментативной активности была выдвинута и экспериментально разработана А. И. Опариным (1935).
Регуляция метаболизма через ферментативный аппарат может осуществляться и благодаря изменению проницаемости мембран под влиянием различных факторов. От проницаемости зависит поступление отдельных субстратов в компартменты, где локализованы ферменты метаболизации этих субстратов.
В клетке находятся особые органеллы — лизосомы, представляющие собой небольшие пузырьки, окруженные одиночной мембраной. Они содержат большой набор ферментов (протеазы, нуклеазы, гликозидазы и др.), способных расщеплять практически любые клеточные компоненты, и участвуют в процессе фагоцитоза, генерации, удаления «отработанных» органелл. При функционировании лизосом их ферменты начинают активно действовать только после выхода из лизосом вследствие разрушения мембран последних.