Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Гормоны
Гормоны надпочечников
Химическое строение, биосинтез и биологическое действие кортикостероидов
К настоящему времени из коркового вещества надпочечников человека, свиньи и быка выделено около 50 различных соединений, которым дано общее название «кортикоиды», или «кортикостероиды». Общее число всех стероидов, которые синтезируются в надпочечниках многих животных, приближается к 100, однако биологической активностью наделены не все кортикостероиды.
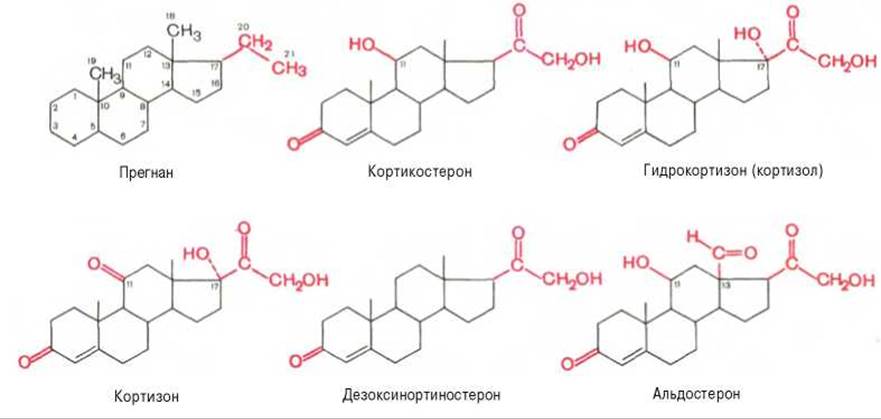
В зависимости от характера биологического эффекта гормоны коркового вещества надпочечников условно делят на глюкокортикоиды (кортикостероиды, оказывающие влияние на обмен углеводов, белков, жиров и нуклеиновых кислот) и минералокортикоиды (кортикостероиды, оказывающие преимущественное влияние на обмен солей и воды)*. К первым относятся кортикостерон, кортизон, гидрокортизон (кортизол), 11-дезоксикортизол и 11-дегидрокортикостерон, ко вторым — дезоксикортикостерон и альдостерон.
В основе их структуры, так же как и в основе строения холестерина, эргостерина, желчных кислот, витаминов группы D, половых гормонов и ряда других веществ, лежит конденсированная кольцевая система циклопентанпергидрофенантрена (см. главу 7).
Для гормонов коркового вещества надпочечников, наделенных биологической активностью, общим в строении оказалось наличие 21 углеродного атома; вследствие этого все они являются производными прегнана. Кроме того, для всех биоактивных гормонов коркового вещества надпочечников характерны следующие структурные признаки: наличие двойной связи между 4-м и 5-м углеродными атомами, кетонной группы (С=О) у 3-го углеродного атома, боковая цепь (—СО—СН2—ОН) у 17-го углеродного атома.
У человека и большинства животных наиболее распространены 5 гормонов коркового вещества надпочечников.
* В надпочечниках открыты, кроме того, неспецифические (не свойственные данной ткани) половые гормоны: андро- и эстрокортикостероиды.
Установлено, что предшественником кортикостероидов является холестерин(ол) и процесс стероидогенеза, как и нормальное гистологическое строение и масса надпочечников, регулируется АКТГ гипофиза. В свою очередь синтез АКТГ в гипофизе, а значит, и кортикостероидов в корковом веществе надпочечников регулируется гипоталамусом, который в ответ на стрессовые ситуации секретирует кортиколиберин. Имеются неоспоримые доказательства быстрого (кратковременного) и медленного (хронического) действия АКТГ на надпочечники, причем в остром случае ткань железы отвечает кратковременным увеличением синтеза кортикостероидов, в то время как при хроническом воздействии АКТГ отмечается его трофический эффект, который сводится к стимулированию всех обменных процессов, обеспечивающих рост и размножение клеток железы, а также продолжительное увеличение секреции стероидных гормонов. Следует отметить, что действие АКТГ также опосредовано через специфический рецептор и систему аденилатциклаза—цАМФ—протеинкиназа.
Получены экспериментальные доказательства индуцирующего действия кортикостероидов на синтез специфических мРНК и соответственно синтез белка.
Предполагают, что механизмы такого действия стероидов включают проникновение гормона вследствие легкой растворимости в жирах через липидный бислой клеточной мембраны, образование стероидрецепторного комплекса в цитоплазме клетки, последующее преобразование этого комплекса в цитоплазме, быстрый транспорт в ядро и связывание его с хроматином. Считают, что в этом процессе участвуют как кислые белки хроматина, так и непосредственно ДНК. В настоящее время разработана концепция о существовании в организме определенной последовательности механизма кортикостероидной регуляции обмена веществ:
![]()
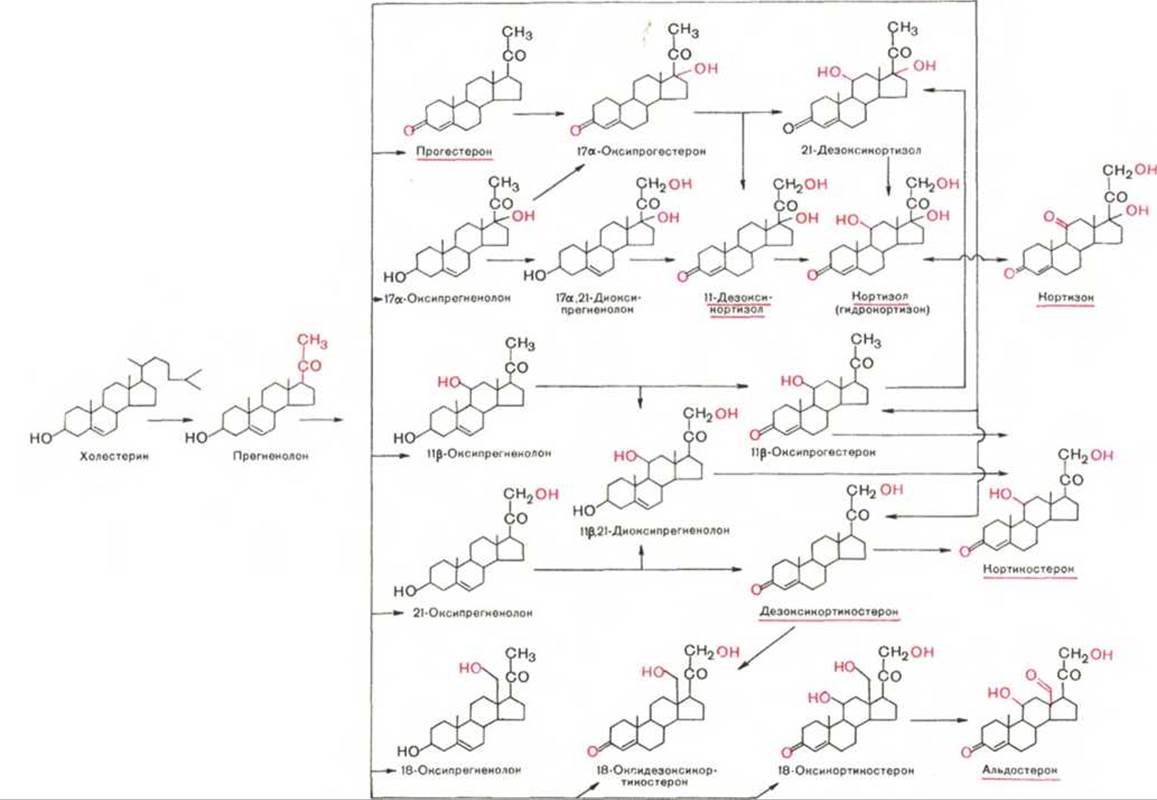
Основной путь биосинтеза кортикостероидов включает последовательное ферментативное превращение холестерина(ола) в прегненолон, который является предшественником всех стероидных гормонов (рис. 8.2).
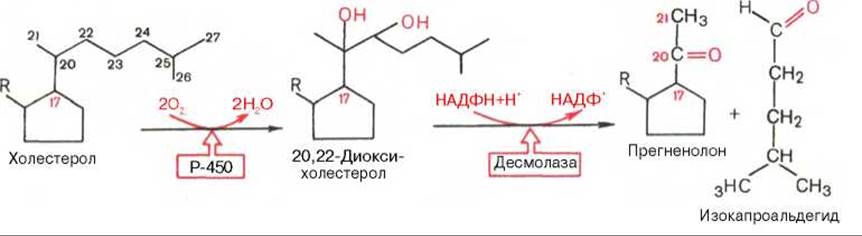
Рис. 8.2. Биосинтез прегненолона — предшественника стероидных гормонов. R обозначает кольцевые структуры (А, В, С) холестерола.
Ферменты катализируют минимум две последовательные реакции гидроксилирования и реакцию отщепления боковой цепи холестерина (в виде альдегида изокапроновой кислоты). В качестве переносчика электронов участвует цитохром Р-450 в сложной оксигеназной системе, в которой принимают участие также электронтранспортирующие белки, в частности адренодоксин и адренодоксинредуктаза.
Дальнейшие стадии стероидогенеза также катализируются сложной системой гидроксилирования, которая открыта в митохондриях клеток коры надпочечников; последовательность всех этих реакций синтеза стероидных гормонов обобщена в общую схему по Н.А. Юдаеву и С.А. Афиногеновой*.
Глюкокортикоиды оказывают разностороннее влияние на обмен веществ в разных тканях. В мышечной, лимфатической, соединительной и жировой тканях глюкокортикоиды, проявляя катаболическое действие, вызывают снижение проницаемости клеточных мембран и соответственно торможение поглощения глюкозы и аминокислот; в то же время в печени они оказывают противоположное действие. Конечным итогом воздействия глюкокортикоидов является развитие гипергликемии, обусловленной главным образом глюконеогенезом.
Механизм развития гипергликемии после введения глюкокортикоидов включает, кроме того, снижение синтеза гликогена в мышцах, торможение окисления глюкозы в тканях и усиление распада жиров (соответственно сохранение запасов глюкозы, так как в качестве источника энергии используются свободные жирные кислоты).
Доказано индуцирующее действие кортизона и гидрокортизона на синтез в ткани печени некоторых белков-ферментов: триптофанпирролазы, тирозинтрансаминазы, серин- и треониндегидратаз и др., свидетельствующее, что гормоны действуют на первую стадию передачи генетической информации — стадию транскрипции, способствуя синтезу мРНК.
Минералокортикоиды (дезоксикортикостерон и альдостерон) регулируют главным образом обмен натрия, калия, хлора и воды; они способствуют удержанию ионов натрия и хлора в организме и выведению с мочой ионов калия. По-видимому, происходит обратное всасывание ионов натрия и хлора в канальцах почек в обмен на выведение других продуктов обмена, в частности мочевины. Альдостерон получил свое название на основании наличия в его молекуле альдегидной группы у 13-го углеродного атома вместо метильной группы, как у всех остальных кортикостероидов. Альдостерон — наиболее активный минералокортикоид среди других кортикостероидов; в частности, он в 50—100 раз активнее дезоксикортикостерона по влиянию на минеральный обмен.
* При изображении структуры стероидов связь a-ориентированных заместителей принято изображать штриховой линией, а ß-ориентированных заместителей — сплошной, что отражено на схеме.
Известно, что период полураспада кортикостероидов составляет всего 70—90 мин. Кортикостероиды подвергаются или восстановлению за счет разрыва двойных связей (и присоединения атомов водорода), или окислению, которое сопровождается отщеплением боковой цепи у 17-го углеродного атома, причем в обоих случаях снижается биологическая активность гормонов. Образовавшиеся продукты окисления гормонов коркового вещества надпочечников называют 17-кетостероидами; они выводятся с мочой в качестве конечных продуктов обмена, а у мужчин являются также конечными продуктами обмена мужских половых гормонов. Определение уровня 17-кетостероидов в моче имеет большое клиническое значение. В норме в суточной моче содержится от 10 до 25 мг 17-кетостероидов у мужчин и от 5 до 15 мг — у женщин. Повышенная экскреция их наблюдается, например, при опухолях интерстициальной ткани семенников, тогда как при других тестикулярных опухолях она нормальная. При опухолях коркового вещества надпочечников резко увеличивается экскреция 17-кетостероидов с мочой — до 600 мг в сутки. Простая гиперплазия коркового вещества сопровождается умеренным повышением уровня кетостероидов в моче. Для дифференциальной диагностики опухолей или простой гиперплазии обычно пользуются раздельным определением а- и ß-17-кетостероидов. Пониженное выделение 17-кетостероидов с мочой отмечается при евнухоидизме, гипофункции передней доли гипофиза. При аддисоновой болезни у мужчин экскреция 17-кетостероидов резко снижена (от 1 до 4 мг/сут), а у женщин при этом заболевании она практически не наблюдается. Этот факт подтверждает отмеченное ранее положение, что 17-кетостероиды образуются не только из гормонов коркового вещества надпочечников, но и из мужских половых гормонов. При микседеме (гипофункция щитовидной железы) суточное количество экскретируемых 17-кетостероидов близко к минимальному уровню (2—4 мг). Следует указать, однако, что применение гормонов щитовидной железы, хотя и эффективно при лечении основного заболевания, оказывает незначительное влияние на количество экскретируемых с мочой 17-кетостероидов.
Гормоны коркового вещества надпочечников в настоящее время широко используются в клинической практике в качестве лекарственных препаратов. Применение кортизона с лечебной целью явилось следствием случайного наблюдения. Было замечено, что при беременности тяжесть симптомов ревматоидного артрита резко снижается, однако все эти симптомы вновь появляются после родов. Оказалось, что во время беременности происходят ускорение секреции гормонов коркового вещества надпочечников и поступление их в кровь. Параллельное гистологическое исследование надпочечников доказало резкое усиление роста и пролиферации клеток коркового вещества. Эти наблюдения навели на мысль об использовании гормонов коркового вещества надпочечников, в частности кортизона, при лечении ревматоидных артритов. Результаты лечения оказались настолько эффективными, что в первые годы применения кортизона некоторые авторы наблюдали почти 100% излечение артритов ревматического происхождения. Обладая противовоспалительной, антиаллергической и антииммунной активностью, глюкокортикоиды нашли широкое применение при лечении таких заболеваний, как бронхиальная астма, ревматоидный артрит, красная волчанка, пузырчатка, сенная лихорадка, различные аутоиммунные болезни, дерматозы и др. Однако длительное применение кортикостероидных препаратов может привести к серьезным нарушениям обменных процессов в организме.