Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Гормоны
Молекулярные механизмы передачи гормонального сигнала
Гуанилатциклазная мессенджерная система
Довольно долгое время циклический гуанозинмонофосфат (цГМФ) рассматривался как антипод цАМФ. Ему приписывали функции, противоположные цАМФ. К настоящему времени получено много данных, что цГМФ принадлежит самостоятельная роль в регуляции функции клеток. В частности, в почках и кишечнике он контролирует ионный транспорт и обмен воды, в сердечной мышце служит сигналом релаксации и т.д.
Биосинтез цГМФ из ГТФ осуществляется под действием специфической гуанилатциклазы по аналогии с синтезом цАМФ:
![]()
* Гликогенфосфорилаза печени также регулируется гормонами (адреналин и глюкагон) и, кроме того, концентрацией в крови глюкозы, которая оказалась, как и глюкозо-6-фосфат, аллостерическим ингибитором фосфорилазы а; связывание глюкозы (когда уровень глюкозы повышается в крови) с аллостерическим участком активной фосфорилазы а вызывает ряд конформационных изменений структуры, способствуя активированию фосфатазы фосфорилазы а (см. рис. 10.1), соответственно дефосфорилированию фосфорилазы а и превращению ее в неактивную фосфорилазу b.
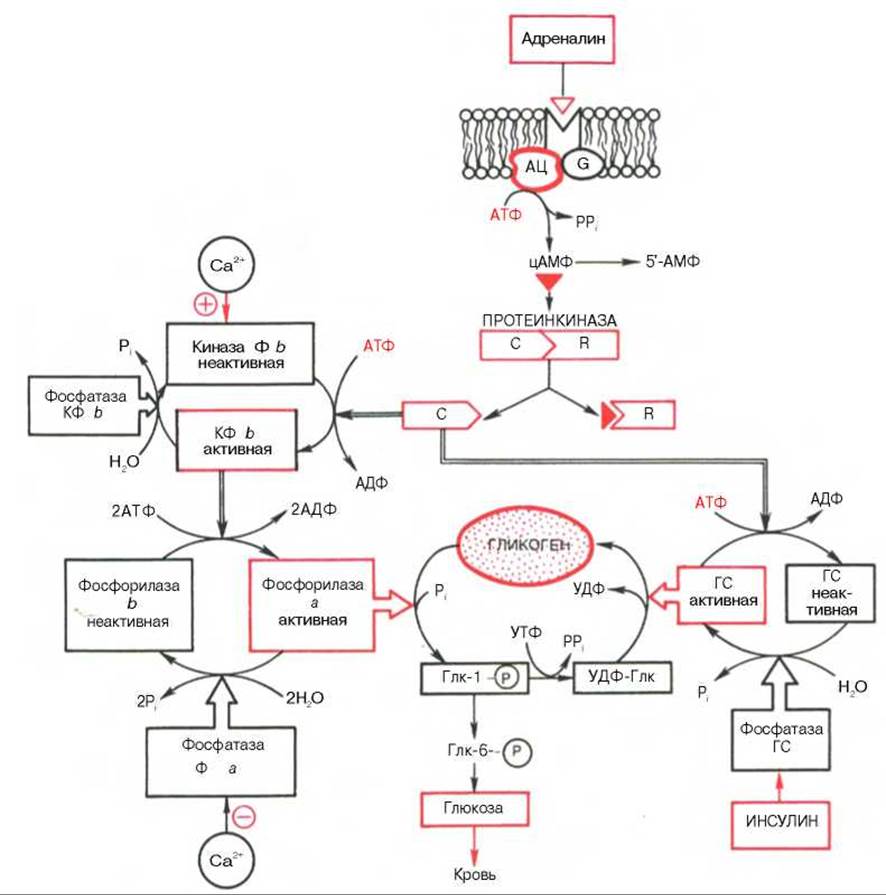
Рис. 8.8. Схематическое выражение центральной роли цАМФ и протеинкиназы в гормональной регуляции синтеза и распада гликогена.
Адреналинрецепторный комплекс: АЦ - аденилатциклаза, G - G-белок; С и R - соответственно каталитические и регуляторные субъединицы протеинкиназы; КФ - киназа фосфорилазы b Ф - фосфорилаза; Глк-1-P - глюкозо-1-фосфат; Глк-6-P - глюкозо-6-фосфат; УДФ-Глк - уридиндифосфатглюкоза; ГС - гликогенсинтаза.
Известны четыре разные формы гуанилатциклазы, три из которых являются мембраносвязанными и одна - растворимая открыта в цитозоле. Показано, что мембраносвязанные формы (мол. массой ~ 180000) состоят из 3 участков: рецепторного, локализованного на внешней поверхности плазматической мембраны; внутримембранного домена и каталитического компонента, одинакового у разных форм фермента. Гуанилатциклаза открыта во многих органах (сердце, легкие, почки, надпочечники, эндотелий кишечника, сетчатка и др.), что свидетельствует о широком ее участии в регуляции внутриклеточного метаболизма, опосредованном через цГМФ. Мембраносвязанный фермент активируется через соответствующие рецепторы короткими внеклеточными пептидами (18—20 аминокислотных остатков), в частности гормоном предсердным натрийуретическим пептидом (АНФ), термостабильным токсином грамотрицательных бактерий и др. АНФ, как известно, синтезируется в предсердии в ответ на увеличение объема крови, поступает с кровью в почки, активирует гуанилатциклазу (соответственно повышает уровень цГМФ), способствуя экскреции Na и воды. Гладкие мышечные клетки сосудов также содержат аналогичную рецептор-гуанилатциклазную систему, посредством которой связанный с рецептором АНФ оказывает сосудорасширяющее действие, способствуя снижению кровяного давления. В эпителиальных клетках кишечника активатором рецептор — гуанилатциклазной системы может служить бактериальный эндотоксин, который приводит к замедлению всасывания воды в кишечнике и развитию диареи.
Растворимая форма гуанилатциклазы (мол. масса 152000) является гемсодержащим ферментом, состоящим из 2 субъединиц. В регуляции этой формы гуанилатциклазы принимают участие нитровазодилататоры, свободные радикалы — продукты перекисного окисления липидов. Одним из хорошо известных активаторов является эндотелиальный фактор (EDRF), вызывающий релаксацию сосудов. Действующим компонентом, естественным лигандом, этого фактора служит оксид азота NO. Эта форма фермента активируется также некоторыми нитрозовазодилататорами (нитроглицерин, нитропруссид и др.), используемыми при болезнях сердца; при распаде этих препаратов также освобождается NO.
Оксид азота образуется из аминокислоты аргинина при участии сложной Са2+-зависимой ферментной системы со смешанной функцией, названной NO-синтазой:
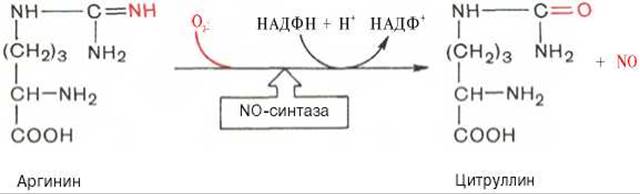
Оксид азота при взаимодействии с гемом гуанилатциклазы способствует быстрому образованию цГМФ, который снижает силу сердечных сокращений путем стимулирования ионных насосов, функционирующих при низких концентрациях Са2+. Однако действие NO кратковременное, несколько секунд, локализованное — вблизи места его синтеза. Подобный эффект, но более длительный оказывает нитроглицерин, который медленнее освобождает NO.
Получены доказательства, что большинство эффектов цГМФ опосредовано через цГМФ-зависимую протеинкиназу, названную протеинкиназой G. Этот широко распространенный в эукариотических клетках фермент получен в чистом виде (мол. масса 80000). Он состоит из 2 субъединиц — каталитического домена с последовательностью, аналогичной последовательности С-субъединицы протеинкиназы А (цАМФ-зависимой), и регуляторного домена, сходного с R-субъединицей протеинкиназы А (см. ранее). Однако протеинкиназы А и G узнают разные последовательности белков, регулируя соответственно фосфорилирование ОН-группы серина и треонина разных внутриклеточных белков и оказывая тем самым разные биологические эффекты.
Уровень циклических нуклеотидов цАМФ и цГМФ в клетке контролируется соответствующими фосфодиэстеразами, катализирующими их гидролиз до 5'-нуклеотидмонофосфатов и различающимися по сродству к цАМФ и цГМФ. Выделены и охарактеризованы растворимая кальмодулинзависимая фосфодиэстераза и мембраносвязанная изоформа, не регулируемая Са2+ и кальмодулином.