Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Биомембраны и биоэнергетика
Биоэнергетика
С позиций термодинамики (см. главу 4) метаболизм представляет собой совокупность процессов, в которой реакции, потребляющие энергию из внешней среды (эндэргонические), сопрягаются с энергодающими (экзэргоническими) реакциями, что позволяет живым существам оказывать постоянное сопротивление нарастанию энтропии. Выяснение биохимических механизмов, приводящих к генерации различных форм биологической энергии, является предметом биоэнергетики. Источником энергии служат реакции, в ходе которых соединения, содержащие атомы углерода в высоковосстановленном состоянии, подвергаются окислению, а специальные дыхательные переносчики присоединяют протоны и электроны (восстанавливаются) и в таком виде транспортируют атомы водорода к дыхательной цепи.
Биологические виды энергии. Энергетические превращения в живой клетке подразделяют на две группы: локализованные в мембранах и протекающие в цитоплазме. В каждом случае для «оплаты» энергетических затрат используется своя «валюта»: в мембране это ∆μН+ или ∆μNа+, а в цитоплазме — АТФ, креатинфосфат и другие макроэргические соединения. Непосредственным источником АТФ являются процессы субстратного и окислительного фосфорилирования. Процессы субстратного фосфорилирования наблюдаются при гликолизе и на одной из стадий цикла трикарбоновых кислот (реакция сукцинил-КоА —> сукцинат; см. главу 10). Генерация ∆μН+ и ∆μNa+, используемых для окислительного фосфорилирования, осуществляется в процессе транспорта электронов в дыхательной цепи энергосопрягающих мембран.
Энергия разности потенциалов на сопрягающих мембранах может обратимо превращаться в энергию АТФ. Эти процессы катализируются Н+-АТФ-синтазой в мембранах, генерирующих протонный потенциал, или Na+-АТФ-синтазой (Nа+-АТФазой) в «натриевых мембранах» алкалофильных бактерий, поддерживающих ∆μNа+ [Скулачев В.П., 1989]. На рис. 9.6 представлена схема энергетики живых клеток, использующих ∆μН+ в качестве мембранной формы конвертируемой энергии. На схеме видно, что свет или энергия субстратов дыхания утилизируется ферментами фотосинтетической или дыхательной редокс-цепи (у галобактерий — бактериородопсином). Генерируемый потенциал используется для совершения полезной работы, в частности для образования АТФ. Будучи макроэргическим соединением, АТФ выполнняет функцию аккумулирования биологической энергии и ее последующего использования для выполнения клеточных функций. «Макроэргичность» АТФ объясняется рядом особенностей его молекулы. Это прежде всего высокая плотность зарядов, сконцентрированная в «хвосте» молекулы, обеспечивающая легкость диссоциации терминального фосфата при водном гидролизе. Продукты этого гидролиза представляют собой АДФ и неорганический фосфат и далее - АМФ и неорганический фосфат. Это обеспечивает высокую величину свободной энергии гидролиза терминального фосфата АТФ в водной среде.
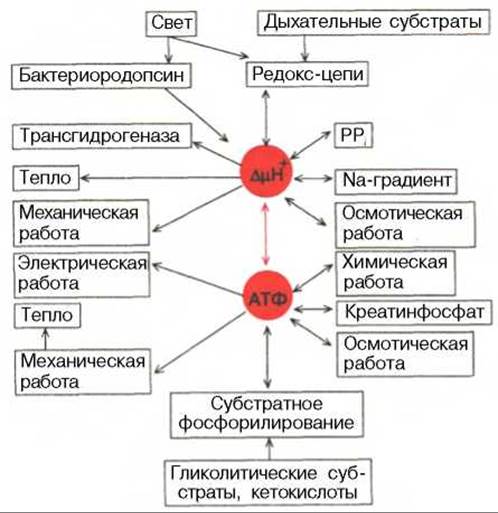
Рис. 9.6. Взаимозаменяемость различных видов биологической энергии при выполнении клеточной работы [Скулачев В.П., 1989].
Красной стрелкой показана взаимозаменяемость в клетке двух клеточных видов энергии - АТФ и ∆μН+, для которых имеются также специальные буферные системы: креатинфосфат для АТФ (клетки животных) и градиент ионов Na (алкалофильные бактерии).
Тканевое дыхание и биологическое окисление. Распад органических соединений в живых тканях, сопровождающийся потреблением молекулярного кислорода и приводящий к выделению углекислого газа и воды и образованию биологических видов энергии, называется тканевым дыханием. Тканевое дыхание представляют как конечный этап пути превращений моносахаров (в основном глюкозы) до указанных конечных продуктов, в который на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов (жирные кислоты), белков (аминокислоты) и нуклеиновых оснований. Итоговая реакция тканевого дыхания будет выглядеть следующим образом:
С6Н12О6 + 6O2= 6СO2+ 6Н2О + 2780 кДж/моль. (1)
Впервые сущность дыхания объяснил А.-Л. Лавуазье (1743-1794), обративший внимание на сходство между горением органических веществ вне организма и дыханием животных. Постепенно становились ясными принципиальные различия между этими двумя процессами: в организме окисление протекает при относительно низкой температуре в присутствии воды, и его скорость регулируется обменом веществ. В настоящее время биологическое окисление определяется как совокупность реакций окисления субстратов в живых клетках, основная функция которых - энергетическое обеспечение метаболизма. В развитие концепций биологического окисления в XX в. важнейший вклад внесли А.Н. Бах, О. Варбург, Г. Крепс, В.А. Энгельгардт, В.И. Палладин, В.А. Белицер, С.Е. Северин, В.П. Скулачев.
Потребление кислорода тканями зависит от интенсивности реакций тканевого дыхания. Наибольшей скоростью тканевого дыхания характеризуются почки, мозг, печень, наименьшей — кожа, мышечная ткань (в покое). Уравнение (2) описывает суммарный результат многоступенчатого процесса, приводящего к образованию молочной кислоты (см. главу 10) и протекающего без участия кислорода:
С6Н12О6 = 2С3Н6О3 + 65 кДж/моль. (2)
Этот путь отражает, по-видимому, энергетическое обеспечение простейших форм жизни, функционировавших в бескислородных условиях. Современные анаэробные микроорганизмы (осуществляющие молочнокислое, спиртовое и уксуснокислое брожение) получают для жизнедеятельности энергию, производимую в процессе гликолиза или его модификаций.
Использование клетками кислорода открывает возможности для более полного окисления субстратов. В аэробных условиях продукты бескислородного окисления становятся субстратами цикла трикарбоновых кислот (см. главу 10), в ходе которого образуются восстановленные дыхательные переносчики НАДФН, НАДН и флавиновые коферменты. Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. При взаимодействии этих кофакторов с атомами водорода имеет место обратимое гидрирование (присоединение атомов водорода):
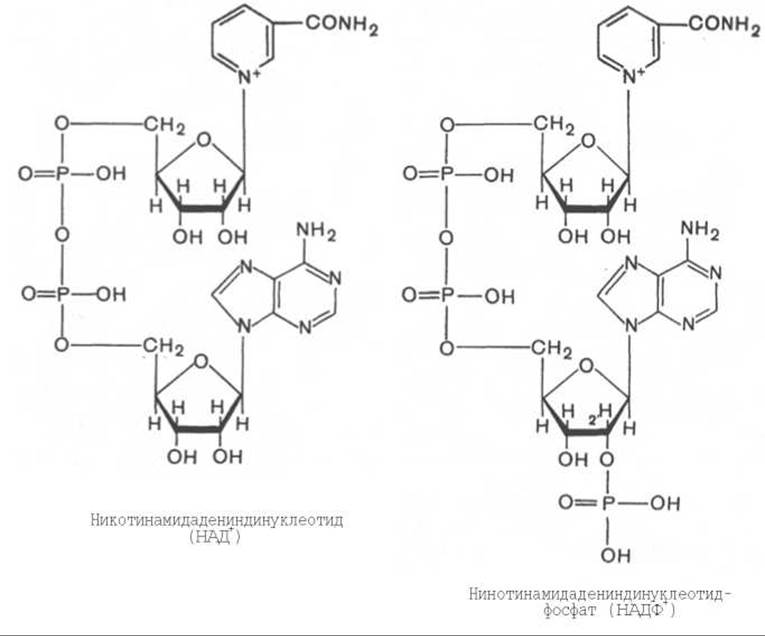
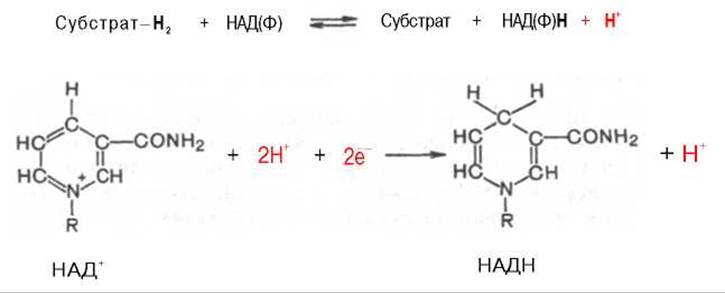
При этом в молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, а второй протон остается в среде.
Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно:
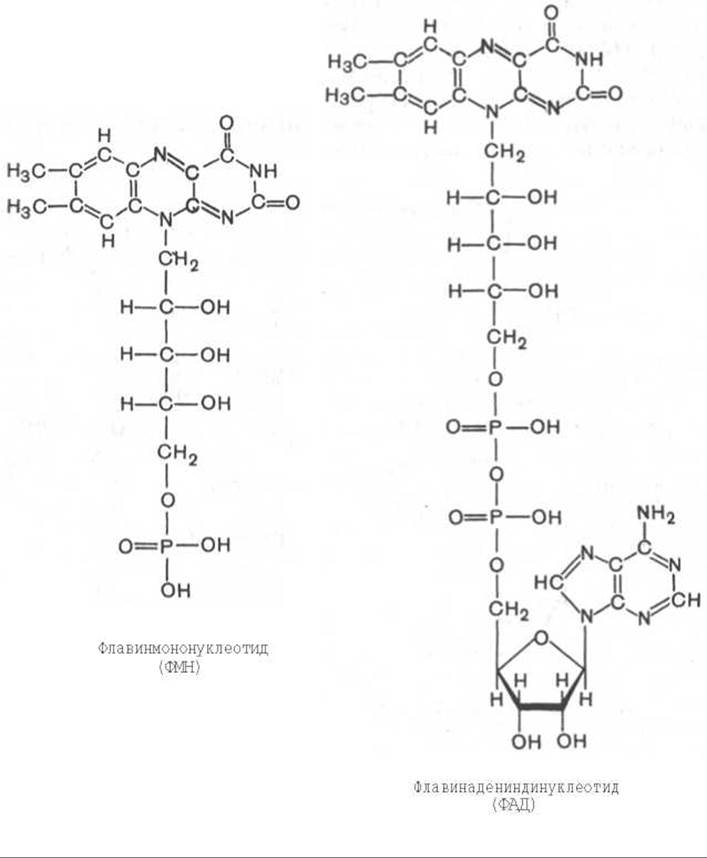
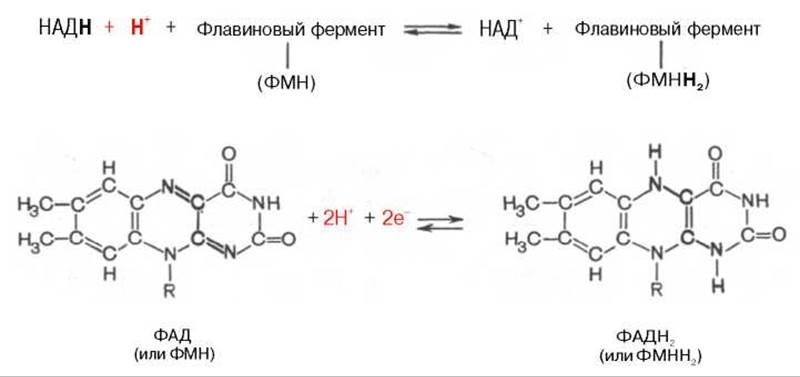
Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дыхательной цепи митохондрий или иных энергосопрягающих мембран (см. далее).
Организация и функционирование дыхательной цепи. В клетках эукариот дыхательная цепь расположена во внутренней мембране митохондрий, у дышащих бактерий — в цитоплазматической мембране и специализированных структурах — мезосомах, или тилакоидах. Компоненты дыхательной цепи митохондрий в порядке убывания окислительно-восстановительного потенциала можно расположить, как показано в табл. 9.1.
Таблица 9.1. Окислительно-восстановительный потенциал компонентов дыхательной цепи в стандартных условиях (концентрация компонентов 1М, рН 7,25°С)
Восстановленная форма |
Окисленная форма |
E°, В |
НАДН + Н+ |
НAД+ |
- 0,32 |
ФAДН2 |
ФAД+ |
- 0,05 |
Убихинол (KoQ-H2) |
Убихинон |
+ 0,04 |
Цитохром b (Fe2+) |
Цитохром b (Fe3+) |
+ 0,07 |
» с1 (Fe2+) |
» с1 (Fe3+) |
+ 0,23 |
» с (Fe2+) |
» с (Fe3+) |
+ 0,25 |
» a (Fe2+) |
» a (Fe3+) |
+ 0,29 |
» a3 (Fe2+) |
a3 (Fe3+) |
+ 0,55 |
H2O |
1/2O2 |
+ 0,82 |
Молярные соотношения компонентов дыхательной цепи являются постоянными, ее компоненты встроены в митохондриальную мембрану в виде 4 белково-липидных комплексов: НAДН-КоQН2-редуктаза (комплекс I), сукцинат-КоQ-редуктаза (комплекс II), КоQН2-цитохром с-редуктаза (комплекс III) и цитохром a-цитохромоксидаза (комплекс IV) (рис. 9.7).
Если субстратом окисления служат а-кетокислоты, в переносе электронов на НAД+ участвуют липоатсодержащие дегидрогеназы. В случае окисления пролина, глутамата, изоцитрата и других субстратов перенос электронов происходит непосредственно на НAД+. Восстановленный НАД в дыхательной цепи окисляется НAДН-дегидрогеназой, содержащей железосерный белок (FeS) и ФМН и прочно связанной с дыхательной цепью.
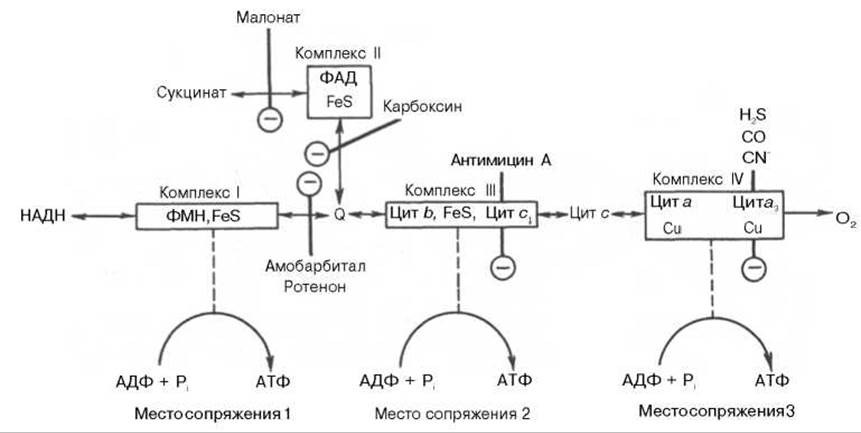
Рис. 9.7. Взаимное расположение компонентов дыхательной цепи с указанием мест фосфорилирования и специфических ингибиторов.
KoQ (убихинон), необходимый компонент дыхательной цепи, является производным бензохинона с боковой цепью, которая у млекопитающих чаще всего представлена 10 изопреноидными единицами (см. главу 7). Как любой хинон, KoQ способен находиться и в восстановленном, и окисленном состоянии. Это свойство определяет его роль в дыхательной цепи - служить коллектором восстановительных эквивалентов, поставляемых в дыхательную цепь через флавиновые дегидрогеназы. Содержание его значительно превосходит содержание других компонентов дыхательной цепи.
Дополнительным участником дыхательной цепи является железосерный белок FeS (негемовое железо). Он участвует в окислительно-восстановительном процессе, протекающем по одноэлектронному типу. Первый участок локализации FeS находится между ФМН и KoQ, второй - между цитохромами b и c1. Это соответствует тому факту, что со стадии ФМН путь протонов и электронов разделяется: первые накапливаются в митохондриальном матриксе, а вторые идут на гидрофобные переносчики - KoQ и цитохромы.
Цитохромы в дыхательной цепи выстроены в порядке возрастания окислительновосстановительного потенциала. Они представляют собой гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Ионы железа в составе гема при получении и отдаче электронов обратимо изменяют свою валентность.
В процессах тканевого дыхания наиболее важную роль играют цитохромы b, с1, с, а и а3. Цитохром а3 представляет собой терминальный участок дыхательной цепи — цитохромоксидазу, которая осуществляет окисление цитохрома с и образование воды. Элементарный акт представляет собой двухэлектронное восстановление одного атома кислорода, т.е. каждая молекула кислорода одновременно взаимодействует с двумя электронтранспортными цепями. При транспорте каждой пары электронов во внутримитохондриальном пространстве может накапливаться до 6 протонов (рис. 9.8).
Строение дыхательной цепи интенсивно исследуется. В числе последних достижений молекулярной биохимии — установление тонкой структуры дыхательных ферментов с помощью рентгеноструктурного анализа. С помощью электронного микроскопа с наивысшим доступным в настоящее время разрешением можно «увидеть» структуру цитохромоксидазы (рис. 9.9).
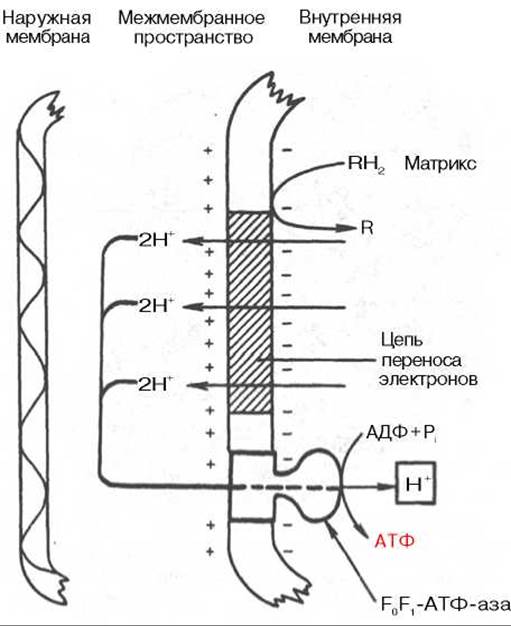
Рис. 9.8. Механизм образования АТФ согласно хемиосмотической гипотезе. R - субстраты - доноры водорода.
Окислительное фосфорилирование и дыхательный контроль. Функция дыхательной цепи — утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов (главным образом в цикле трикарбоновых кислот). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окислительно-восстановительным потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи (см. рис. 9.7). В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая АрН, электроны движутся по цепи переносчиков от убихинола к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-синтазой. Таким образом, тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее.
Разность электрических потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника электронов, является движущей силой для образования АТФ и других видов полезной биологической энергии (см. рис. 9.6). Механизмы этих превращений описывает хемиосмотическая концепция превращения энергии в живых клетках. Она была выдвинута П. Митчеллом в 1960 г. для объяснения молекулярного механизма сопряжения транспорта электронов и образования АТФ в дыхательной цепи и быстро получила международное признание. За развитие исследований в области биоэнергетики П. Митчеллу в 1978 г. была присуждена Нобелевская премия. В 1997 г. П. Бойеру и Дж. Уокеру была присуждена Нобелевская премия за выяснение молекулярных механизмов действия главного фермента биоэнергетики - протонной АТФ-синтазы.
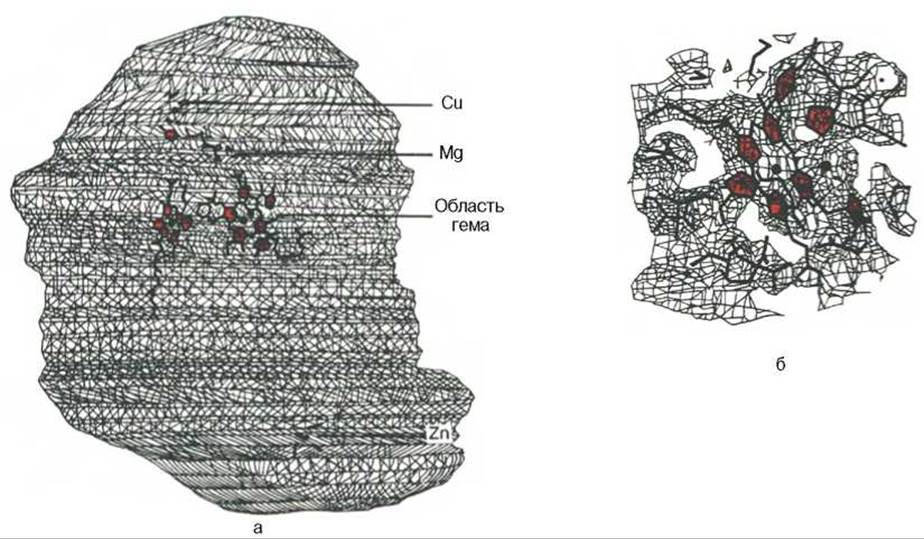
Рис. 9.9. Схематическое изображение цитохромоксидазы с разрешением 0,5 нм (а) и ее активного центра с разрешением 2,8 нм (б) [Tsukihara et al., Science.- 1966.- Vol. 269.- P. 1069] (Печатается с любезного разрешения редакции журнала).
Согласно хемиосмотической концепции, движение электронов по дыхательной цепи является источником энергии для транслокации протонов через митохондриальную мембрану. Возникающая при этом разность электрохимических потенциалов (∆μH+) приводит в действие АТФ-синтазу, катализирующую реакцию
АДФ + Рi = АТФ. (3)
В дыхательной цепи есть только 3 участка, где перенос электронов сопряжен с накоплением энергии, достаточным для образования АТФ (см. рис. 9.7), на других этапах возникающая разность потенциалов для этого процесса недостаточна. Максимальная величина коэффициента фосфорилирования, таким образом, составляет 3, если реакция окисления идет с участием НАД, и 2, если окисление субстрата протекает через флавиновые дегидрогеназы. Теоретически еще одну молекулу АТФ можно получить в трансгидрогеназной реакции (если процесс начинается с восстановленного НАДФ):
НАДФН + НАД+ = НАДФ+ + НАДН + 30 кДж/моль. (4)
Обычно в тканях восстановленный НАДФ используется в пластическом обмене, обеспечивая разнообразные синтетические процессы, так что равновесие трансгидрогеназной реакции сильно сдвинуто влево.
Эффективность окислительного фосфорилирования в митохондриях определяется как отношение величины образовавшегося АТФ к поглощенному кислороду: АТФ/О или Р/О (коэффициент фосфорилирования). Экспериментально определяемые значения Р/О, как правило, оказываются меньше 3. Это свидетельствует о том, что процесс дыхания не полностью сопряжен с фосфорилированием. Действительно, окислительное фосфорилирование в отличие от субстратного не является процессом, в котором окисление жестко сопряжено с образованием макроэргов. Степень сопряжения зависит главным образом от целостности митохондриальной мембраны, сберегающей разность потенциалов, создаваемую транспортом электронов. По этой причине соединения, обеспечивающие протонную проводимость (как 2,4-динитрофенол), являются разобщителями.
Несопряженное дыхание (свободное окисление) выполняет важные биологические функции. Оно обеспечивает поддержание температуры тела на более высоком уровне, чем температура окружающей среды. В процессе эволюции у гомойотермных животных и человека сформировались специальные ткани (бурый жир), функцией которых является поддержание постоянной высокой температуры тела за счет регулируемого разобщения окисления и фосфорилирования в митохондриальной дыхательной цепи. Процесс разобщения контролируется гормонами.
В норме скорость митохондриального транспорта электронов регулируется содержанием АДФ. Выполнение клеткой функций с затратой АТФ приводит к накоплению АДФ, который в свою очередь активирует тканевое дыхание. Таким образом, клеткам свойственно реагировать на интенсивность клеточного метаболизма и поддерживать запасы АТФ на необходимом уровне. Это свойство называется дыхательным контролем.
За сутки человек потребляет около 550 л (24,75 моля) кислорода. Если считать, что в тканевом дыхании за этот период восстанавливается 40 г атомов кислорода (20 молей), а величину Р/О принять за 2,5, то в митохондриях должно синтезироваться 100 молей, или около 50 кг АТФ! При этом часть энергии окисления субстратов расходуется на совершение полезной работы, не превращаясь в АТФ (см. рис. 9.6).
Приведенные данные показывают, как важно организму поддержание процессов жизнедеятельности.
Свободное окисление. Одна из задач свободного (несопряженного) окисления — превращения природных или неприродных субстратов, называемых в этом случае ксенобиотиками (ксено — несовместимый, биос — жизнь). Они осуществляются ферментами диоксигеназами и монооксигеназами. Окисление протекает при участии специализированных цитохромов, локализованных чаще всего в эндоплазматическом ретикулуме, поэтому иногда этот процесс называют микросомальным окислением [Арчаков А.И., 1975].
В реакциях свободного окисления участвуют также кислород и восстановленные дыхательные переносчики (чаще всего НАДФН). Акцептором электронов является цитохром Р-450 (иногда цитохром b5). Окисление субстрата протекает по следующей схеме:
SH + O2 —> SOH. (5)
Механизм действия оксигеназ включает изменение валентности входящих в их состав ионов двухвалентных металлов (железа или меди). Диоксигеназы присоединяют к субстрату молекулярный кислород, активируя его за счет электрона атома железа в активном центре (железо при этом становится трехвалентным). Оксигенация протекает как атака субстрата образующимся супероксид-анионом кислорода. Одной из биологически важных реакций такого типа является превращение ß-каротина в витамин А. Монооксигеназы требуют участия в реакции НАДФН, атомы водорода которого взаимодействуют с одним из атомов кислорода, поскольку только один электрон связывается с субстратом. К широко распространенным монооксигеназам относятся разнообразные гидроксилазы. Они принимают участие в окислении аминокислот, оксикислот, полиизопреноидов.
В процессе свободного окисления вследствие особенностей используемых цепей передачи электронов не происходит образования АТФ; биологическая роль этих процессов заключается в метаболизме ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную функцию модификации чужеродных соединений. К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные свойства. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма (см. главу 12 и 13).