Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Биомембраны и биоэнергетика
Мембранные механизмы регуляции метаболизма
Биологические мембраны представляют собой динамическую структуру, компоненты которой подвержены быстрому метаболизму. Благодаря этому липидное окружение мембранных белков обладает способностью в соответствии с изменением условий функционирования изменять свои физикохимические свойства: упаковку, микровязкость, латеральную подвижность компонентов в бислое и т.д. Подавляющее большинство мембранных белков функционирует в составе олигомерных ансамблей, например в дыхательной цепи митохондрий. Транспортные белки также организуют ассоциаты в бислое: димеры (Са2+-АТФаза), тетрамеры (Nа+/К+-АТФаза) или даже более высокоорганизованные надмолекулярные комплексы.
Примером таких комплексов являются сложные мембранные структуры, включающие рецепторы и преобразователи сигналов, действие которых начинается с восприятия внешнего импульса (первичного посредника) на внешней стороне клеточной мембраны и завершается образованием вторичного посредника на внутренней стороне мембраны. Рассмотрим передачу и трансформацию сигнала от первичного посредника, роль которого, как правило, выполняют разнообразные гормоны, не проникающие через клеточную мембрану (см. главу 8).
Первичный посредник взаимодействует с соответствующим рецептором, что приводит к изменению конформации последнего и, как следствие, к увеличению латеральной подвижности в мембране. Это повышает вероятность взаимодействия активированного рецептора с преобразователем (роль преобразователей выполняют специфические мембраносвязанные белки, содержащие ГТФ в связанном состоянии, — G-белки, или ГТФ-связывающие белки) [Авдонин П.В., Ткачук В.А., 1994].
G-белки — центральная часть регуляторного мембранного ансамбля, представлены сложным олигомерным комплексом. Они относятся к гетеротримерным протеолипидам, состоящим из a-, ß- и у-субъединиц. ß-субъединица комплекса тесно ассоциирована с а- и у-субъединицами. Последние модифицированы жирнокислотными радикалами — миристоильным радикалом в случае а-субъединицы (присоединен через остаток глутаминовой кислоты) и геранильным радикалом в случае у-субъединицы (присоединен к радикалу цистеина). Такая модификация прочно ассоциирует G-белки с мембранным бислоем. Следовательно, регуляторные белки функционируют в тесной связи с мембраной, и их свойства зависят от физико-химических характеристик мембраны.
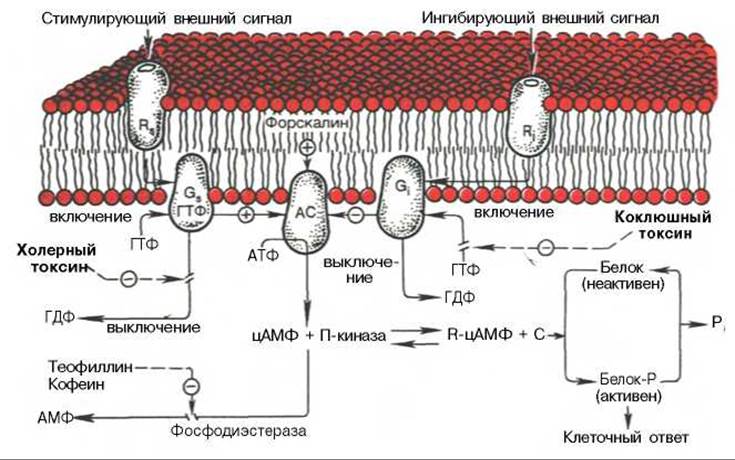
Рис. 9.11. Трансмембранная передача информации с участием аденилатциклазы (АС) и ГТФ-связывающих белков.
GS - стимулирующий и Gi - ингибирующий ГТФ-связывающие белки; RS и R - соответствующие рецепторы для GS и Gi. Показаны участки активации сигнала форскалином, теофиллином и кофеином, а также ингибирования холерным и коклюшным токсинами.
Установлено, что нарушение взаимодействия между белковыми молекулами в олигомерном ансамбле Na+/К+-АТФазы, происходящее, например, при ее свободнорадикальной модификации в ишемическом мозге, устраняет способность АТФ регулировать активность этого фермента.
Приведенные примеры указывают на важное биологическое значение олигомерных ассоциатов мембранных белков, состоящее в том, что при изменении физико-химических свойств мембраны соответственно изменяется и характер взаимодействия мембранных структур. Таким образом формируются обратные связи для приспособления обмена веществ к потребностям организма.
G-белки делятся на несколько типов, причем один из них выполняет стимулирующую, а остальные — ингибирующую функции. Взаимодействие соответствующего G-белка с ферментом—усилителем сигнала приводит к изменению свойств фермента и соответственно к изменению его активности. В случае циклического АМФ (рис. 9.11) возможна как активация аденилатциклазы, так и ее ингибирование (в зависимости от типа G-белков, участвующих в трансформации сигнала). Итогом будет изменение скорости синтеза цитоплазматического цАМФ — активатора протеинкиназ, регулирующих функцию клеточных белков в результате их фосфорилирования. В неактивном состоянии протеинкиназа представляет собой димер из каталитической и регуляторной субъединиц. Активация протеинкиназы обеспечивается связыванием цАМФ с регуляторной субъединицей, что вызывает диссоциацию и активацию каталитической субъединицы.
Субстратами протеинкиназ являются разнообразные белки, фосфорилирование которых изменяет их активность. Например, активация протеинкиназы А со стороны цАМФ приводит к фосфорилированию гликогенсинтазы и гликогенфосфорилазы. При этом активность первого фермента подавляется, а второго усиливается (см. главу 10). Таким образом, появление в кровяном русле адреналина, активирующего аденилатциклазу миоцитов, улучшает энергетическое обеспечение сокращений сердечной мышцы.
Известно несколько типов протеинкиназ, активируемых различными эффекторами. Субстраты протеинкиназ — огромное количество белков, фосфорилирование которых приводит к изменению их активности. Более того, обнаружены протеинфосфатазы, которые, осуществляя гидролиз фосфатной группы, возвращают белковую молекулу в исходное состояние. Во многих случаях мишенью действия киназ являются другие киназы, которые фосфорилируют фосфатазы, в свою очередь регулируя их функцию. Таким образом, регуляция метаболизма имеет каскадный характер.