Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Метаболизм липидов
Окисление жирных кислот
Установлено, что окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза.
В 1904 г. Ф. Кнооп (F. Knoop) выдвинул гипотезу ß-окисления жирных кислот на основании опытов по скармливанию собакам различных жирных кислот, в которых один атом водорода в концевой метильной группе (w-углеродного атома) был замещен радикалом (С6Н5—).
Ф. Кнооп высказал предположение, что окисление молекулы жирной кислоты в тканях организма происходит в ß-положении. В результате от молекулы жирной кислоты последовательно отщепляются двууглеродные фрагменты со стороны карбоксильной группы.
Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного ß-окисления масляная кислота становится ацетоуксусной. Последняя затем гидролизуется до двух молекул уксусной кислоты. Теория ß-окисления жирных кислот, предложенная Ф. Кноопом, в значительной мере послужила основой современных представлений о механизме окисления жирных кислот.
Доставка жирных кислот к месту их окисления — к митохондриям — происходит сложным путем: при участии альбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков (fatty acid binding proteins, FABP) — транспорт в пределах цитозоля; при участии карнитина — транспорт жирной кислоты из цитозоля в митохондрии.
Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой:
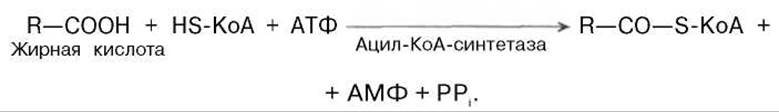
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Считают, что активация жирной кислоты протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, представляющим собой эфир жирной кислоты и АМФ. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ.
Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану:
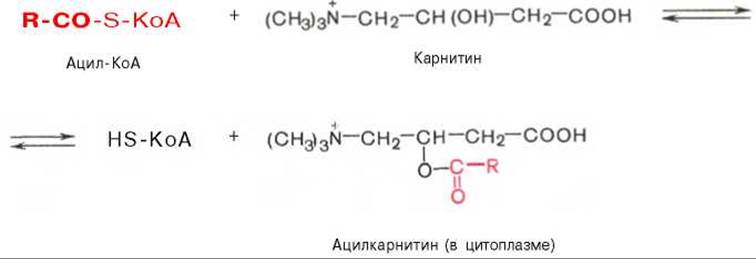
Реакция протекает при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Уже на той стороне мембраны, которая обращена к матриксу, ацильная группа переносится обратно на КоА, что термодинамически выгодно, поскольку О-ацильная связь в карнитине обладает высоким потенциалом переноса группы. Иными словами, после прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция — расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:
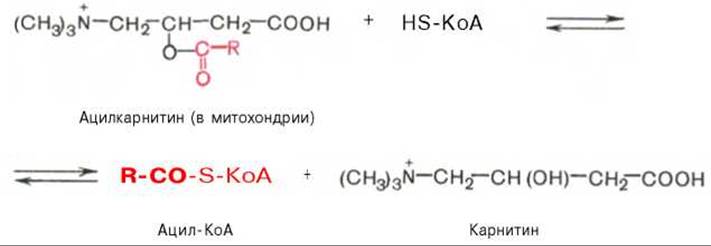
Внутримитохондриальное окисление жирных кислот. Процесс окисления жирной кислоты в митохондриях клетки включает несколько последовательных энзиматических реакций.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в а- и ß-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окисление ацил-КоА-дегидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:
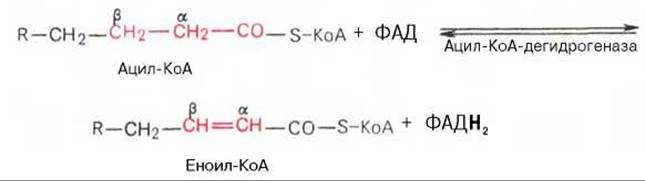
Существует несколько ФАД-содержащих ацил-КоА-дегидрогеназ, каждая из которых обладает специфичностью по отношению к ацил-Ко А с определенной длиной углеродной цепи.
Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется ß-оксиацил-КоА (или 3-гидроксиацил-КоА):
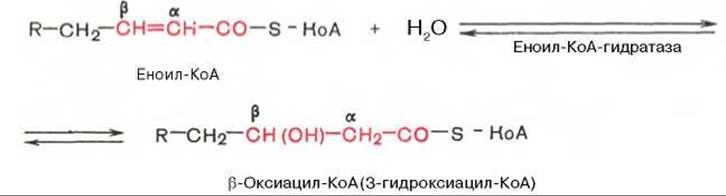
Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата (см. с. 348). В результате гидратации транс-∆2-двойной связи образуется только L-изомер 3-гидроксиацил-КоА.
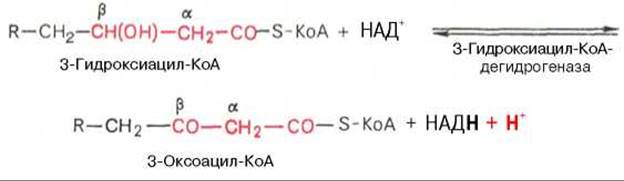
Вторая стадия дегидрирования. Образовавшийся ß-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакцию катализируют НАД+-зависимые дегидрогеназы:
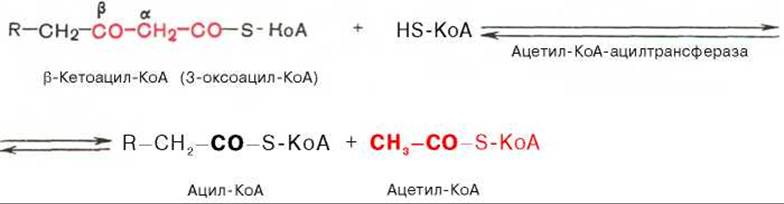
Тиолазная реакция. В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакция представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (ß-кетотиолазой):
Образовавшийся ацетил-КоА подвергается окислению в цикле трикарбоновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь ß-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА (рис. 11.2). Например, при окислении пальмитиновой кислоты (С16) повторяется 7 циклов ß-окисления. Запомним, что при окислении жирной кислоты, содержащей n углеродных
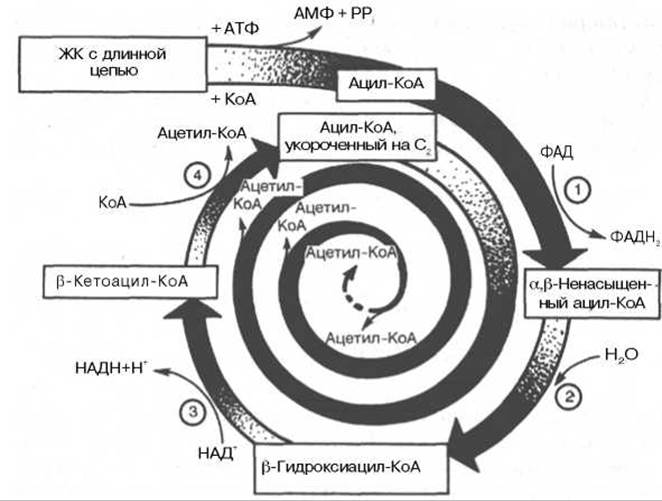
Рис. 11.2. Окисление жирной кислоты («спираль Линена»). Подробно представлен первый цикл окисления - укорочение цепи жирной кислоты на два углеродных атома. Остальные циклы аналогичны первому (по А.Н. Климову и Н.Г. Никульчевой).
1 - ацил-КоА-дегидрогеназа (КФ 1.3.99.3); 2 - еноил-КоА-гидратаза (КФ 4.2.1.17.); 3 - ß-гидроксиацил-КоА-дегидрогеназа (КФ 1.1.1.35); 4 - тиолаза (КФ 2.3.1.9).
атомов, происходит n/2—1 цикл ß-окисления (т.е. на один цикл меньше, чем n/2, так как при окислении бутирил-КоА сразу происходит образование
2 молекул ацетил-КоА) и всего получится n/2 молекул ацетил-КоА. Следовательно, суммарное уравнение ß-окисления активированной кислоты можно записать так:

Баланс энергии. При каждом цикле ß-окисления образуются одна молекула ФАДН2 и одна молекула НАДН. Последние в процессе окисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН2 — 2 молекулы АТФ и НАДН — 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе ß-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Таким образом, всего при полном ß-окислении пальмитиновой кислоты образуется 35 + 96 = 131 молекула АТФ. С учетом одной молекулы АТФ, потраченной в самом начале на образование активной формы пальмитиновой кислоты (пальмитоил-КоА), общий энергетический выход при полном окислении одной молекулы пальмитиновой кислоты в условиях животного организма составит 131 — 1 = 130 молекул АТФ. Изменение свободной энергии AF при полном сгорании 1 моля пальмитиновой
кислоты составляет 2338 ккал, а богатая энергией фосфатная связь АТФ характеризуется величиной 7,6 ккал/моль. Нетрудно подсчитать, что примерно 990 ккал (7,6 х 130), или 42% от всей потенциальной энергии пальмитиновой кислоты при ее окислении в организме, используется для ресинтеза АТФ, а оставшаяся часть, очевидно, теряется в виде тепла.
Следовательно, эффективность накопления энергии в результате окисления жирных кислот при стандартных условиях составляет ~ 40%, что близко к соответствующей величине для гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования.