Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Метаболизм липидов
Метаболизм кетоновых тел
Биосинтез насыщенных жирных кислот
В настоящее время в достаточной степени изучен механизм биосинтеза жирных кислот в организме животных и человека, а также катализирующие этот процесс ферментные системы. Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из уже синтезированной в цитоплазме клетки пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома.
Иными словами, митохондриальная система биосинтеза жирных кислот, включающая несколько модифицированную последовательность реакций ß-окисления, осуществляет только удлинение существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-КоА активно протекает в цитозоле, т.е. вне митохондрий, по совершенно другому пути.
Внемитохондриальная система биосинтеза de novo жирных кислот (липогенез). Эта система находится в растворимой (цитозольной) фракции клеток многих органов, в частности печени, почек, мозга, легких, молочной железы, а также в жировой ткани. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn2+ и НСО3- (в качестве источника СО2); субстратом является ацетил-КоА, конечным продуктом — пальмитиновая кислота. Потребности в кофакторах процессов биосинтеза и ß-окисления жирных кислот значительно различаются.
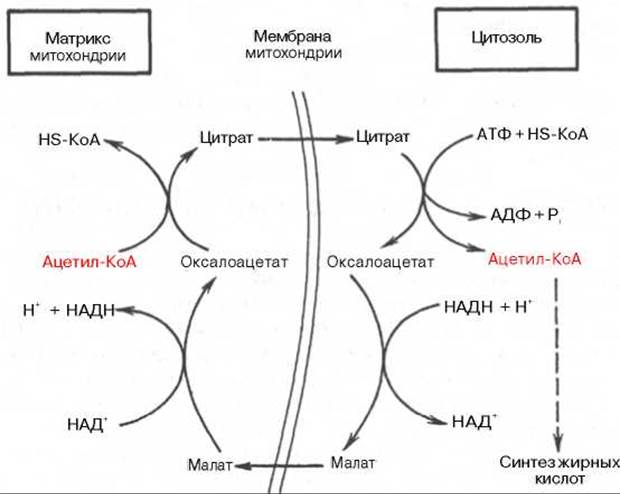
Как отмечалось, строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Было выявлено, что цитрат стимулирует синтез жирных кислот в цитозоле клетки. Известно также, что образующийся в митохондриях в процессе окислительного декарбоксилирования пирувата и окисления жирных кислот ацетил-КоА не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитрат-лиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата. Последний при помощи дикарбоксилаттранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл:
Существует еще один путь переноса внутримитохондриального ацетил-КоА в цитозоль клетки — с участием карнитина. Как отмечалось, карнитин играет роль переносчика ацильных групп из цитозоля в митохондрии при окислении жирных кислот. По-видимому, он может выполнять эту роль и в обратном процессе, т.е. в переносе ацильных радикалов, в том числе ацетильного радикала, из митохондрий в цитозоль клетки. Однако, когда речь идет о синтезе жирных кислот, данный путь переноса ацетил-КоА не является главным.
Образование малонил-КоА. Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-карбоксилаза. Фермент содержит в качестве простетической группы биотин. Авидин — ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом.
Установлено, что ацетил-КоА-карбоксилаза состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотинпереносящий белок, транскарбоксилазу, а также регуляторный аллостерический центр, т.е. представляет собой полиферментный комплекс.
Реакция протекает в два этапа: I — карбоксилирование биотина с участием АТФ и II — перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА:
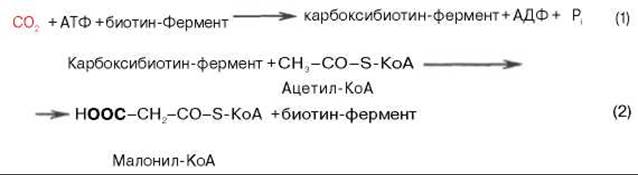
Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты.
Энзиматические системы, осуществляющие синтез жирных кислот, называются жирно-кислотными синтетазами. Они широко встречаются в природе и могут быть изолированы из различных одноклеточных организмов, растений и животных тканей.
Жирно-кислотные синтетазы делятся на 2 группы. К первой группе относятся полиэнзимные, не поддающиеся фракционированию комплексы с мол. м. порядка 500000, в которых все индивидуальные энзимы собраны в компактную структуру. В частности, в эту группу входят жирно-кислотные синтетазы животных тканей и дрожжей.
Вторая группа включает жирно-кислотные синтетазы, из которых отдельные энзимы могут быть выделены методами белкового фракционирования. Такие синтетазы встречаются у ряда микроорганизмов (в частности, у E.coli) и растений. Иными словами, в этих случаях все индивидуальные ферменты синтетазной системы находятся в виде автономных полипептидов.
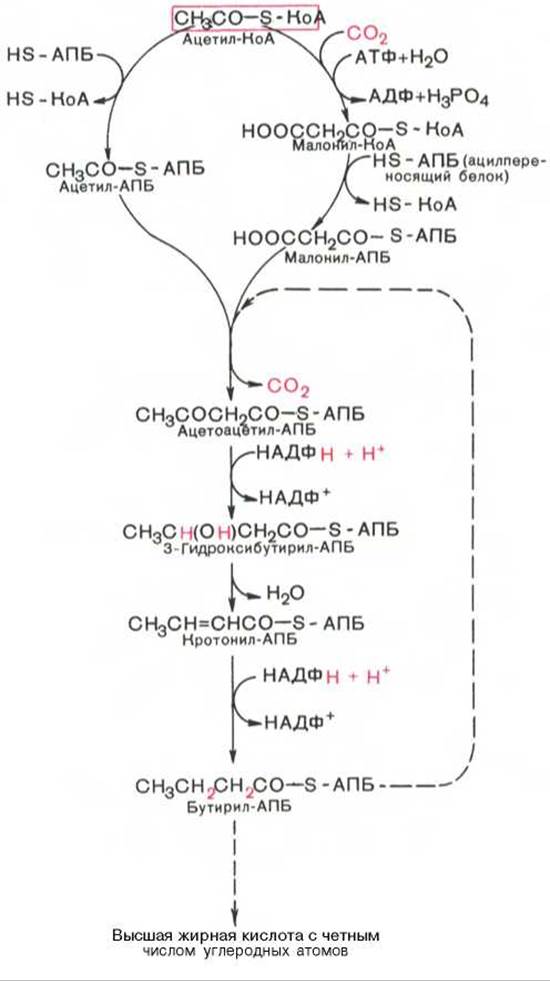
Мультиферментный комплекс, называемый синтетазой (синтазой) жирных кислот, состоит из 6 ферментов, связанных с так называемым ацилпереносящим белком (АПБ). Этот белок относительно термостабилен, имеет две свободные HS-группы (цистеина и фосфопантетеинового остатка, присоединенного к ОН-группе серина) и вовлекается в процесс синтеза высших жирных кислот практически на всех его этапах. Мол. масса АПБ составляет около 10000. Данный белок в синтетазной системе выполняет роль КоА. Заметим, что в животных тканях не удалось обнаружить свободного АПБ, подобного микробному. Из печени выделен полиэнзимный комплекс, содержащий все энзимы, необходимые для синтеза жирных кислот. Энзимы комплекса настолько прочно связаны друг с другом, что все попытки изолировать их в индивидуальном виде не увенчались успехом. Приводим последовательность реакций, происходящих при синтезе жирных кислот:
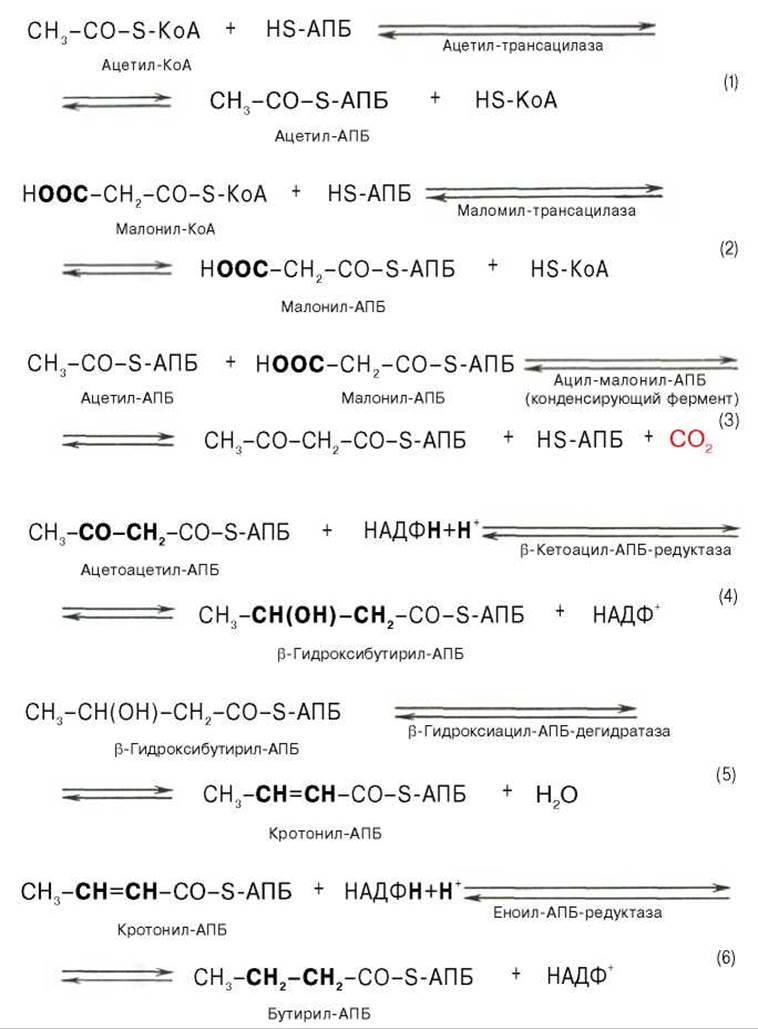
Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С16). В этом случае образованием бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы малонил-АПБ к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется дистальная карбоксильная группа малонил-АПБ в виде СО2. Например, образовавшийся в первом цикле бутирил-АПБ взаимодействует с малонил-АПБ:
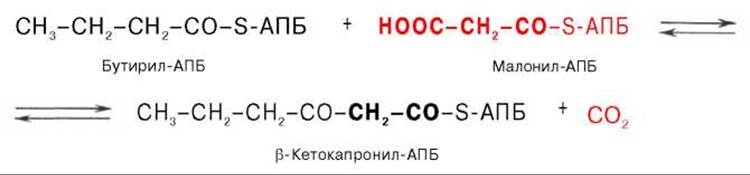
Завершается синтез жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Например:
![]()
Суммарное уравнение синтеза пальмитиновой кислоты можно записать так:
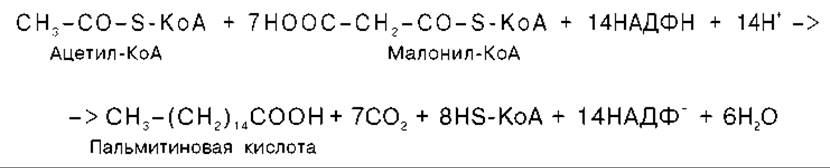
Или, учитывая, что на образование одной молекулы малонил-КоА из ацетил-КоА расходуются одна молекула АТФ и одна молекула СО2, которая затем отщепляется, суммарное уравнение можно представить в следующем виде:

Основные этапы биосинтеза жирных кислот можно представить в виде схемы:
В общем виде синтез жирных кислот у кишечной палочки представлен на рис. 11.4. Последовательность и характер реакций в синтезе жирных кислот, начиная с образования ß-кетоацил-АПБ (на рис. 11.4 — ацетоацетил-АПБ) и кончая завершением одного цикла удлинения цепи на два углеродных атома, являются как бы обратными реакциями окисления жирных кислот. На самом деле пути синтеза и окисления жирных кислот не пересекаются даже частично. Это становится очевидным, если принять во внимание некоторые особенности синтеза и окисления жирных кислот.
По сравнению с ß-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление — в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(—)-изомер 3-гидроксикислоты, а не L(+)-изомер, как это имеет место при ß-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН. Последний в организме частично (на 50%) образуется в реакциях пентозофосфатного цикла, частично — в других реакциях, в частности в реакциях:
![]()
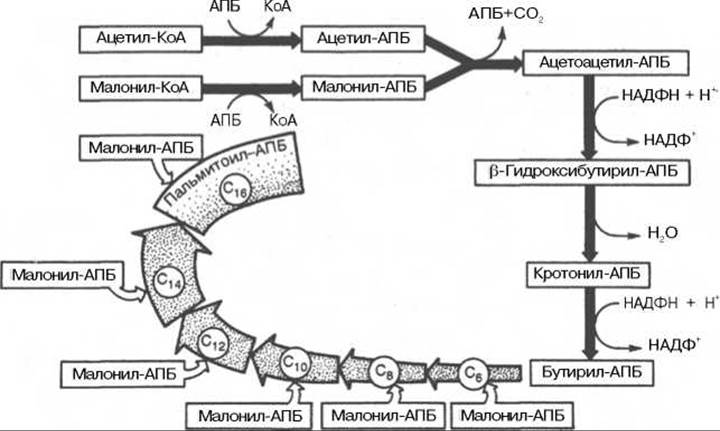
Рис. 11.4. Синтез пальмитиновой кислоты у кишечной палочки при участии одной молекулы ацетил-КоА и 7 молекул малонил-КоА. Подробно представлен первый цикл синтеза - образование бутирил-АПБ. Остальные 6 циклов аналогичны первому.
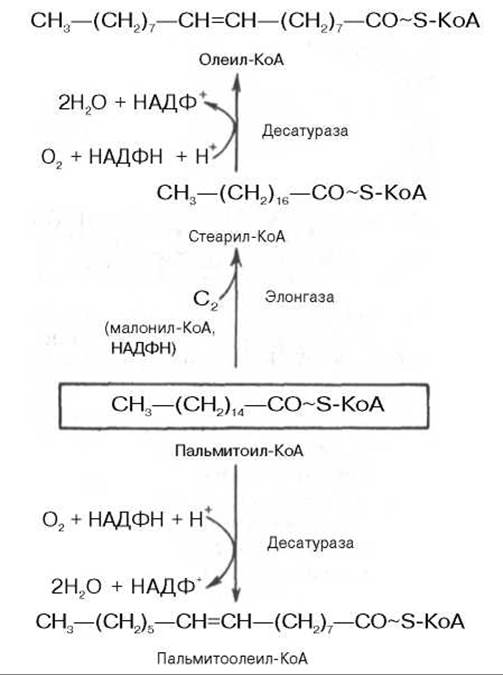
Образование ненасыщенных жирных кислот. Элонгация жирных кислот.
В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные.
Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты — пальмитоолеиновая и олеиновая — синтезируются из пальмитиновой и стеариновой кислот.
Эти превращения протекают в микросомах клеток печени и жировой ткани при участии молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название десатураз.
Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Энзиматическая система, катализирующая удлинение жирных кислот, получила название элонгазы. На схеме представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.