Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Обмен простых белков
Специфические пути обмена некоторых аминокислот
Обмен глицина и серина
Помимо общих путей обмена, характерных для большинства аминокислот, в настоящее время в животных тканях довольно подробно выяснены индивидуальные пути превращения почти всех аминокислот, входящих в состав белковых молекул. Некоторые из этих превращений в количественном отношении имеют второстепенное значение, но образующиеся из них продукты реакции могут играть важную, а иногда и решающую роль в процессах обмена веществ. Далее рассматривается выборочно обмен тех аминокислот, специфические (так называемые частные) пути превращения которых в организме человека и животных определяют во многих отношениях его физиологическое состояние.
Глицин является единственной из всех входящих в состав белков аминокислот, в молекуле которой отсутствует асимметричный атом углерода. Тем не менее метаболически он связан с химическими компонентами организма в большей степени, чем любая другая аминокислота.
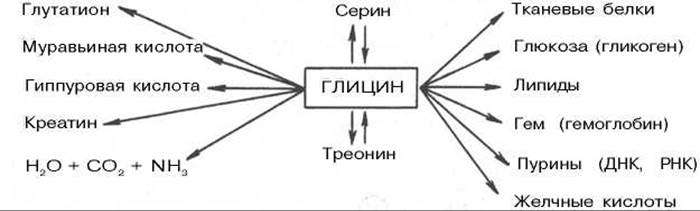
На схеме видно, что глицин в некоторых синтезах играет незаменимую роль, в частности в образовании белков, пуриновых нуклеотидов, гема гемоглобина, парных желчных кислот, креатина, глутатиона и др. Большинство этих реакций представлено в соответствующих разделах учебника. Здесь укажем на реакции, при помощи которых осуществляются взаимопревращения глицина, серина и треонина, а также на реакции катаболизма глицина. Показано, что в реакции взаимопревращения глицина и серина участвует тетрагидрофолиевая кислота; эту реакцию катализирует пиридоксалевый фермент серин-оксиметилтрансфераза:
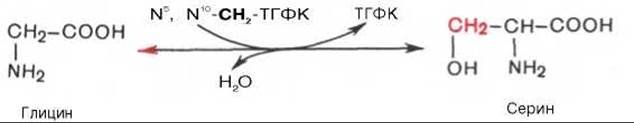
Имеются также доказательства взаимопревращения треонина и глицина в треонинальдолазной реакции:

Основным путем катаболизма глицина в животных тканях, однако, считается распад его на СО2, NH3 и N5, N10-метилентетрагидрофолиевую кислоту по уравнению:
![]()
Механизм этой реакции, недавно раскрытый К. Тада, включает участие митохондриальной глицинрасщепляющей ферментной системы, отличной от глицинсинтазы и состоящей из 4 белков: Р-белка, содержащего пиридоксальфосфат (глициндекарбоксилаза); Н-белка, содержащего липоевую кислоту; Т-белка, требующего присутствия ТГФК, и L-белка, названного липамиддегидрогеназой:
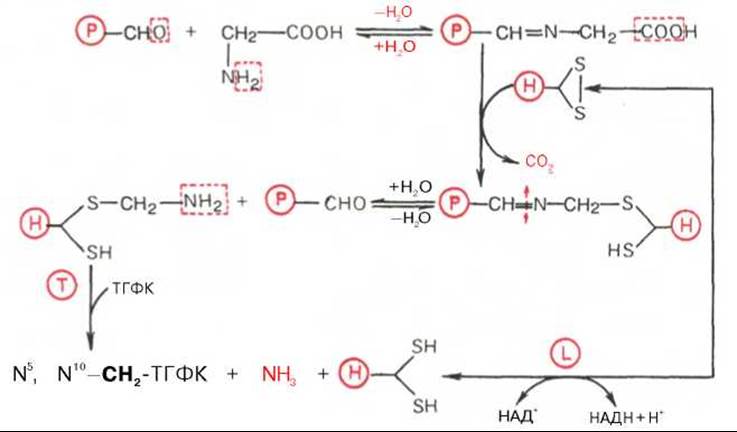
Биологический смысл данного пути катаболизма глицина состоит, вероятнее всего, в образовании активного одноуглеродного фрагмента (N5, N10—СН2—ТГФК), используемого в уникальных реакциях синтеза метионина, пуриновых нуклеотидов, тимидиловой кислоты и др. Получены доказательства, что наследственная некетогенная глицинемия (повышение уровня глицина в крови) обусловлена недостаточностью Р- или Т-белка глицинрасщепляющей ферментной системы печени или мозга и что каждый из этих белков контролируется отдельным геном.
Серин легко превращается в пируват под действием сериндегидратазы. В связи с этим в тканях имеются условия для превращения глицина (через серин) в пируват. Этим путем осуществляется участие глицина в обмене углеводов. Важную роль играет серин в биосинтезе сложных белков — фосфопротеинов, а также фосфоглицеридов. Помимо фосфатидилсерина, углеродный скелет и азот серина используются в биосинтезе фосфатидилэтаноламина и фосфатидилхолина (см. главу 11).
Ряд других эссенциальных функций глицина, в частности участие в образовании 6-аминолевулиновой кислоты при синтезе порфиринов (гема) и пуриновых нуклеотидов, рассматривается далее (см. главу 13).