Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Обмен сложных белков
Обмен нуклеиновых кислот
Биосинтез пуриновых нуклеотидов
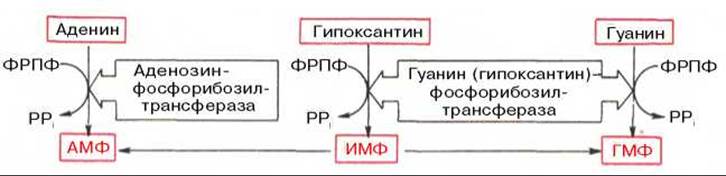
Пуриновые основания, образующиеся в процессе переваривания нуклеиновых кислот в кишечнике, в дальнейшем практически не используются, поэтому их синтез осуществляется из низкомолекулярных предшественников, продуктов обмена углеводов и белков. Впервые работами Дж. Бьюкенена, Дж. Гринберга экспериментально доказано включение ряда меченых атомов, в частности 15N- и 14С-глицина, 15N-аспартата, 15К-глутамина и др., в пуриновое кольцо мочевой кислоты. Скармливая птицам эти и другие меченые соединения, Дж. Бьюкенен анализировал места включения метки в пуриновое кольцо; полученные данные были в дальнейшем уточнены и подтверждены рядом других исследователей. Результаты этих исследований можно представить в виде схемы:
* В животных тканях открыты специфические нуклеозидфосфорилазы, действующие на нуклеозиды.
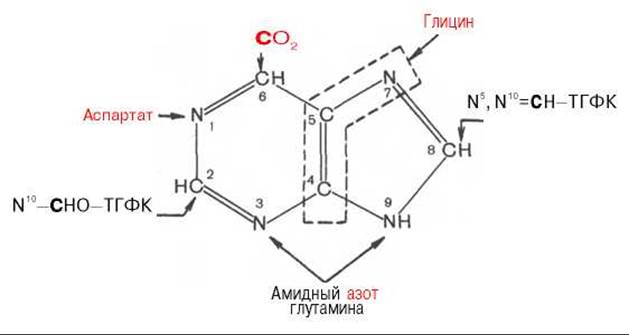
Из схемы видно, что 4-й и 5-й атомы углерода и 7-й атом азота в ядре имеют своим источником глицин. Два атома азота (N-3 и N-9) происходят из амидной группы глутамина, один атом азота (N-1) — из азота аспарагиновой кислоты; углеродный атом (С-2) происходит из углерода N10-формил-ТГФК, атом углерода в 8-м положении — из N5, N10-метенил-ТГФК и, наконец, углерод С-6 имеет своим источником СО2.
В настоящее время благодаря исследованиям Дж. Бьюкенена, Дж. Гринберга, А. Корнберга и сотр. полностью расшифрована последовательность включения перечисленных веществ в пуриновое кольцо, установлена природа всех промежуточных соединений и ферментных систем, катализирующих химические реакции синтеза. Интересным оказался факт почти полного совпадения путей синтеза пуриновых оснований в печени животных и у микроорганизмов, в частности у Е. coli и Neurospora crassa. Следует, однако, отметить, что конечным результатом синтеза оказалось не свободное пуриновое основание, а рибонуклеотид — инозиновая кислота (ИМФ), из которой далее синтезируются АМФ и ГМФ. На схеме представлена последовательность всех 11 химических реакций этого синтеза с указанием ферментных систем, коферментов, источников энергии и других известных к настоящему времени кофакторов (см. с. 472).
Как видно из приведенной схемы, синтез инозиновой кислоты начинается с D-рибозо-5-фосфата, который, как известно, является продуктом пентозофосфатного цикла и на который переносится в необычной реакции пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофосфат (ФРПФ) взаимодействует с глутамином, являющимся донором NH2-группы, в результате чего образуется ß-5-фосфорибозил-амин, причем в процессе реакции наряду с освобождением пирофосфата и свободной глутаминовой кислоты происходит изменение его конфигурации (из а- в ß-). Таким образом, данная стадия становится ключевой реакцией в синтезе пуринов. На следующей стадии присоединяется вся молекула глицина к свободной NH2-группе ß-5-фосфорибозил-амина (реакция нуждается в доставке энергии АТФ) с образованием глицинамидрибонуклеотида. Затем, на следующей стадии, цепь удлиняется за счет присоединения формильной группы из N5, N10-метенил-ТГФК с образованием формилглицинамидрибонуклеотида. На формильную группу последнего переносится далее амидная группа глутамина и синтезируется формилглицинамидинрибонуклеотид (реакция также идет с потреблением энергии АТФ). На следующей стадии замыкается пятичленное имидазольное кольцо и образуется 5-аминоимидазолрибонуклеотид, который способен акцептировать СО2 с образованием рибонуклеотида 5-аминоимидазол-4-карбоновой кислоты.
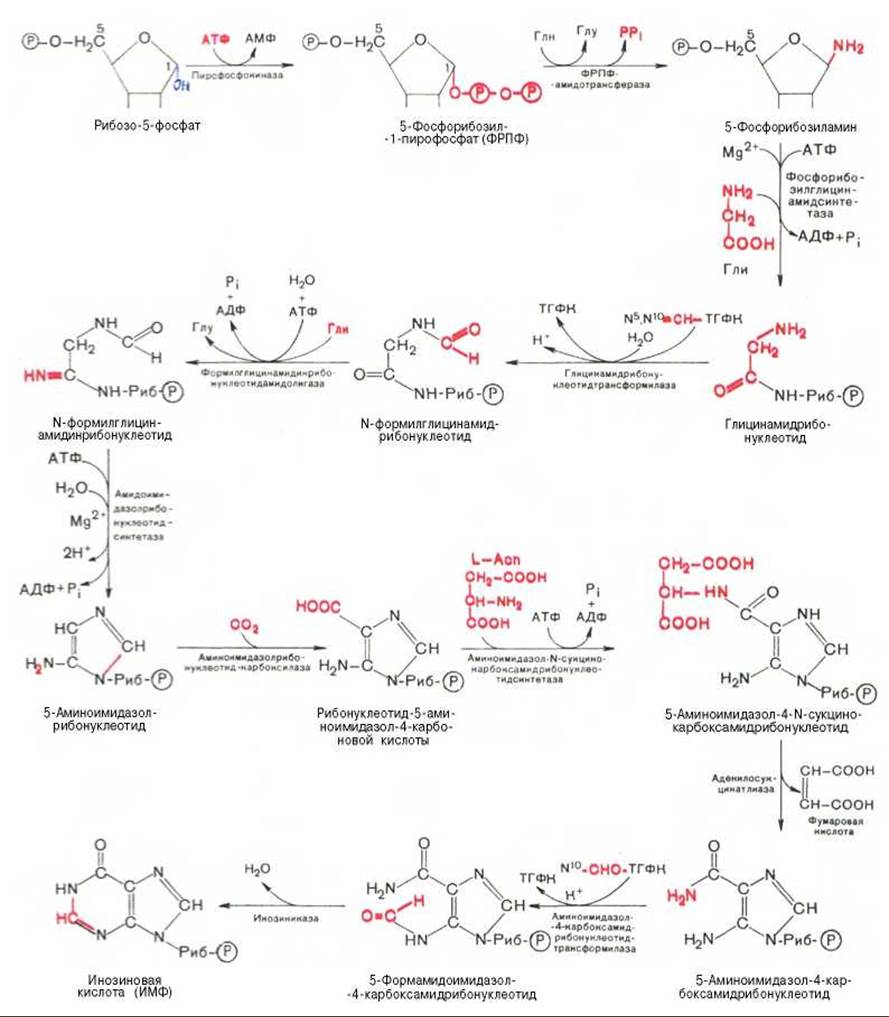
В последующем двухступенчатом процессе, в котором участвуют аспарагиновая кислота и АТФ, образуется 5-аминоимидазол-4-карбоксамид- рибонуклеотид и освобождается фумаровая кислота. В этих реакциях азот аспарагиновой кислоты включается в 1-е положение будущего пуринового ядра. Последний углеродный атом пиримидинового остатка кольца пурина вводится в виде формильного остатка (источник N10-формил-ТГФК), который присоединяется к 5-NH2-группе. После этого отщепляется молекула воды и второе кольцо замыкается. В результате образуется первый пуриновый нуклеотид - инозиновая кислота (ИМФ), которая является предшественником пуриновых нуклеотидов в составе нуклеиновых кислот.
АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих мононуклеотидов участвуют по два фермента, различных по своему механизму действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа и ГМФ-синтетаза, а образование АМФ из того же предшественника катализируется последовательным действием аденилосукцинатсинтетазы и аденилосукцинат-лиазы. Механизм двухэтапного синтеза АМФ и ГМФ можно представить в виде химических реакций.
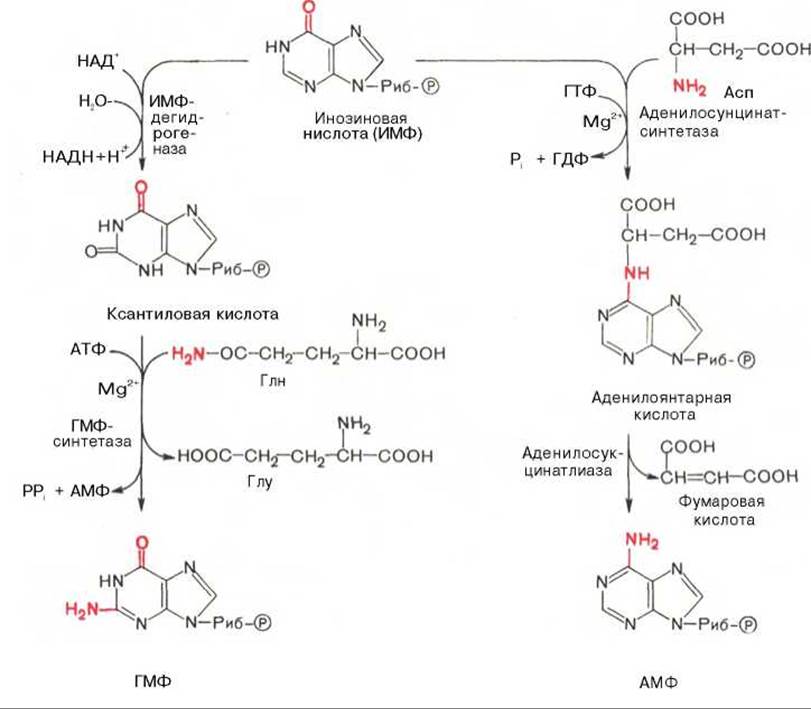
В ферментативном синтезе АМФ из ИМФ специфическое участие принимает аспарагиновая кислота, являющаяся донором NH2-группы, и ГТФ в качестве источника энергии; промежуточным продуктом реакции является аденилоянтарная кислота. Биосинтез ГМФ, напротив, начинается с дегидрогеназной реакции ИМФ с образованием ксантозиловой кислоты; в аминировании последней используется только амидный азот глутамина.
Превращение АМФ и ГМФ в соответствующие нуклеозидди- и нуклеозидтрифосфаты также протекает в 2 стадии при участии специфических нуклеозидмонофосфат- и нуклеозиддифосфаткиназ*:
ГМФ + АТФ <=> ГДФ + АДФ;
ГДФ + АТФ <=> ГТФ + АДФ.
* Следует напомнить, что основным механизмом синтеза самого АТФ из АДФ и неорганического фосфата в живых организмах является окислительное фосфорилирование (см. главу 9).
Следует указать на существование в клетках весьма тонкого механизма регуляции синтеза пуриновых нуклеотидов. Синтез их тормозится конечными продуктами по принципу обратной связи, т.е. ингибированием первой стадии переноса аминогруппы глутамина на ФРПФ. Фермент, катализирующий эту стадию, оказался аллостерическим регуляторным ферментом. Вторая особенность механизма регуляции заключается в том, что избыток ГМФ в клетках оказывает аллостерическое торможение только на свой собственный синтез, не влияя на синтез АМФ, и, наоборот, накопление АМФ подавляет свой синтез, не ингибируя синтеза ГМФ.