Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Обмен сложных белков
Обмен нуклеиновых кислот
Биосинтез нуклеиновых кислот
Проблема биосинтеза нуклеиновых кислот является предметом пристального внимания многих исследователей и целых научных коллективов. Следует прежде всего отметить исключительную трудность решения этой важнейшей проблемы, связанную с неполными представлениями о природе белковых факторов и механизмах регуляции синтеза нуклеиновых кислот.
До сих пор не раскрыты в деталях молекулярные механизмы передачи генетической информации, закодированной в нуклеотидной последовательности ДНК. Различают три основных этапа реализации генетической информации. На первом этапе — этапе репликации происходит образование дочерних молекул ДНК, первичная структура которых идентична родительской ДНК (копирование ДНК). Репликация ДНК является ключевой функцией делящейся клетки и частью таких биологических процессов, как рекомбинация, транспозиция и репарация. На втором этапе, названном транскрипцией, генетическая информация, записанная в первичной структуре ДНК, переписывается в нуклеотидную последовательность РНК (синтез молекулы РНК на матрице ДНК). На третьем этапе — этапе трансляции генетическая информация, содержащаяся уже в нуклеотидной последовательности молекулы РНК, переводится в аминокислотную последовательность белка. Далее представлены основные итоги исследований и наши представления о биосинтезе полимерных молекул ДНК, РНК и белка, полученные к середине 1996 г.
Биосинтез ДНК
Прежде чем изложить современные представления о механизме биосинтеза ДНК, следует представить сведения о синтезе этого соединения в бесклеточной системе, которыми располагает биохимия. Известно, что для любого синтеза полимерной органической молекулы, осуществляемого in vitro или in vivo, требуется энергия. Источником энергии в реакциях полимеризации мононуклеотидов является энергия, освобождаемая всеми четырьмя типами дезоксирибонуклеозидтрифосфатов, участвующих в синтезе ДНК. Образующийся пирофосфат под действием пирофосфатазы также расщепляется на две молекулы ортофосфата, давая дополнительную энергию для биосинтеза ДНК.
Помимо энергии, биогенез ДНК требует наличия специфических ферментов, катализирующих отдельные этапы синтеза, и множества белковых факторов, абсолютно необходимых для регулирования процесса репликации и проявления каталитической активности ферментов.
Ферментные системы синтеза ДНК у про- и эукариот до конца не выяснены. По имеющимся данным, в репликации ДНК, включающей узнавание точки начала процесса, расплетение родительских цепей ДНК в репликационной вилке, инициацию биосинтеза дочерних цепей и дальнейшую их элонгацию и, наконец, окончание (терминация) процесса, участвует более 40 ферментов и белковых факторов, объединенных в единую ДНК-репликазную систему, называемую реплисомой.
После открытия в 1958 г. А. Корнбергом у Е. coli фермента, катализирующего биосинтез ДНК и названного ДНК-полимеразой I, в течение почти 10 лет считалось, что этот фермент является единственной полимеразой, принимающей участие в репликации ДНК in vitro*. Однако позже был открыт мутант Е. coli, лишенный ДНК-полимеразы I, но способный синтезировать ДНК с нормальной скоростью. Оказалось, что для репликации ДНК Е. coli необходимо участие нескольких ферментов. ДНК-полимераза I не наделена способностью инициировать синтез цепей ДНК de novo. Одним из хорошо изученных ферментов, участвующих в стадии инициации репликации ДНК, является специфическая клеточная РНК-полимераза, названная праймазой, которая катализирует синтез короткого олигорибонуклеотида (от 10 до 60 нуклеотидов), т.е. праймера, с которого затем начинается синтез ДНК. Праймазы различаются как по структуре, так и по специфичности действия. Получены новые данные о существенной роли праймасомы в каталитическом действии фермента. Праймасома представлена ансамблем из 7 различных субъединиц, включающих около 20 полипептидов общей мол. массой 70000. При помощи белка n' праймасома подвергается быстрому перемещению к отстающей цепи ДНК за счет энергии, генерируемой АТФазной активностью белка n'. В состав праймасомы входит также комплекс белков dna В и dna С, который вблизи репликационной вилки периодически участвует в формировании специфической вторичной структуры ДНК, подходящей для узнавания праймазой.
Основным ферментом, катализирующим биосинтез новообразованной ДНК (точнее, стадию элонгации репликации ДНК), является ДНК-полимераза III, представляющая собой мультимерный комплекс собственно ДНК-полимеразы (мол. масса около 900000) и ряда других белков. ДНК-полимераза III из Е. coli состоит минимум из 10 субъединиц. Одна из них — ß-субъединица получена в кристаллическом виде, и выяснена ее третичная структура. Имеются доказательства, что в димерной форме ДНК-полимераза III катализирует сопряженный синтез ведущей (лидирующей) и отстающей цепей ДНК при репликации (см. далее). Более точно выяснена также роль ДНК-полимеразы I: она катализирует отщепление затравочного олигорибонуклеотидного праймера и заполнение образующихся после этого пробелов (ниш) дезоксирибонуклеотидами. Известно, что ДНК-полимеразы II из Е. coli (мол. масса 88000) выполняет «ремонтные» функции, исправляя повреждения цепей ДНК. Укажем также, что ДНК-полимераза I в качестве матрицы использует одноцепочечные участки, в то время как ДНК-полимераза III — двухцепочечные ДНК, в которых имеются короткие одноцепочечные последовательности.
* За выдающийся вклад в решение проблем биосинтеза ДНК и РНК А. Корнберг и С. Очоа были удостоены Нобелевской премии в 1959 г.
Важную функцию соединения двух цепей ДНК или замыкания двух концов одной цепи ДНК в процессе репликации либо репарации ДНК выполняет особый фермент — ДНК-лигаза, катализирующая за счет энергии АТФ образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы одной цепи и 5'-фосфатной группой другой цепи ДНК.
Функцию раскручивания (расплетения) двойной спирали ДНК в репликационной вилке, происходящего за счет энергии гидролиза АТФ, выполняет специфический rep-белок, названный хеликазой (мол. масса З00000). Образовавшиеся на определенное время одноцепочечные участки ДНК служат в качестве матрицы при репликации и стабилизируются при помощи особых белков, связывающихся с одноцепочечной ДНК (ДНК-связывающие белки) и препятствующих обратному комплементарному взаимодействию цепей ДНК (мол. масса 75600). В связи с этим их иногда называют дестабилизирующими двойную спираль белками. Имеются, кроме того, особые ферменты топоизомеразы (у прокариот одна из них названа ДНК-гиразой), которые играют особую роль в сверхспирализации, обеспечивая как репликацию, так и транскрипцию ДНК. Эти ферменты наделены способностью не только создавать супервитки, но и уничтожать суперспирализацию путем сшивания образующихся разрывов или разрезания ДНК. Наконец, открыты специальные ферменты, «редактирующие» ДНК, т.е. осуществляющие вырезание и удаление ошибочно включенных нуклеотидов или репарирующие повреждения ДНК, вызванные физическими или химическими факторами (рентгеновское излучение, УФ-лучи, химический мутагенез и др.).
Из клеток животных выделено несколько ДНК-полимераз, и в разных лабораториях они получили различные наименования.
К настоящему времени у эукариот, как и у бактерий (см. ранее), открыто несколько ДНК-полимераз. В репликации ДНК эукариот участвуют два главных типа полимераз — а и δ. Показано, что ДНК-полимераза а состоит из 4 субъединиц и является идентичной по структуре и свойствам во всех клетках млекопитающих, причем одна из субъединиц оказалась наделенной праймазной активностью. Самая крупная субъединица ДНК-полимеразы а (мол. масса 180000) катализирует реакцию полимеризации, преимущественно синтез отстающей цепи ДНК, являясь составной частью праймасомы. ДНК-полимераза б состоит из 2 субъединиц и преимущественно катализирует синтез ведущей цепи ДНК (см. далее). Открыта также ДНК-полимераза є, которая в ряде случаев заменяет б-фермент, в частности при репарации ДНК (исправление нарушений ДНК, вызванных ошибками репликации или повреждающими агентами). Следует отметить, что в эукариотических клетках открыты два белковых фактора репликации, обозначаемых RFA и RFC. Фактор репликации А выполняет функцию белка — связывание одноцепочечной ДНК (наподобие белковых факторов связывания разъединенных цепей ДНК при репликации у Е. coli), фактор С — функцию стабилизатора всего репликационного комплекса.
В генетической инженерии с целью получения белков в достаточных количествах и с заданными свойствами (например, для генотерапии наследственных и соматических болезней) широкое применение получили эндонуклеазы рестриктазы, катализирующие расщепление молекулы двухцепочечной ДНК по специфическим нуклеотидным последовательностям внутри цепи. Рестриктазы узнают определенные 4—7-членные последовательности, вызывая, таким образом, разрывы в определенных сайтах цепи ДНК. При этом образуются не случайные последовательности, а фрагменты ДНК строго определенной структуры с липкими концами (рекомбинантные ДНК), используемые далее для конструирования гибридных молекул и получения генно-инженерной, биотехнологической продукции (например, инсулина, гормона роста, интерферона, вакцин против вируса гепатита В, СПИДа и др.).
Общий механизм синтеза ДНК. Основываясь на данных о двухспиральной антипараллельной структуре, химическом составе ДНК (см. главу 3) и значении «активированной» формы энергии для биосинтеза полимерных молекул, А. Корнберг еще в 1955 г. указал на возможность синтеза ДНК энзиматическим путем в бесклеточной системе в присутствии изолированной из Е. coli ДНК-полимеразы и предшественников дезоксирибонуклеозидтрифосфатов. Реакция, практически осуществленная в 1967 г., сводится к синтезу новой молекулы ДНК:
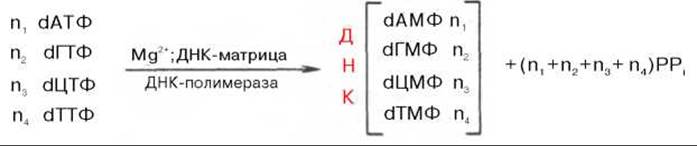
Химический смысл полимеризации состоит в том, что свободная З'-гидроксильная группа матрицы атакует а-фосфатную группу соответствующего присоединяемого нуклеозидтрифосфата (определяется природой азотистого основания затравки), при этом происходят отщепление остатка пирофосфата и образование фосфодиэфирной связи. Далее свободный 3'-гидроксил вновь присоединенного нуклеотида атакует а-фосфатную группу следующего нуклеозидтрифосфата, и таким путем продолжается процесс полимеризации, идущий в направлении 5'—>3', антипараллельно матрице, оканчивающейся 5'-фосфатом:
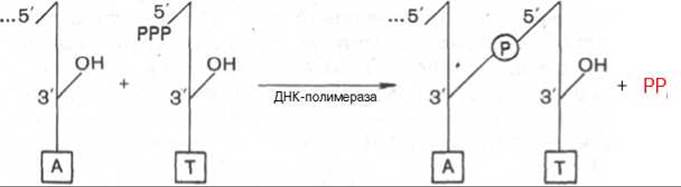
Реакция требует присутствия одноцепочечной ДНК или в крайнем случае небольшого полидезоксирибонуклеотида. В деталях выяснено значение предобразованной ДНК в механизмах действия ДНК-полимераз:
ДНК служит не только затравкой, но и матрицей, на которой фермент комплементарно и антипараллельно синтезирует дочернюю цепь ДНК. Это можно представить в виде схемы:
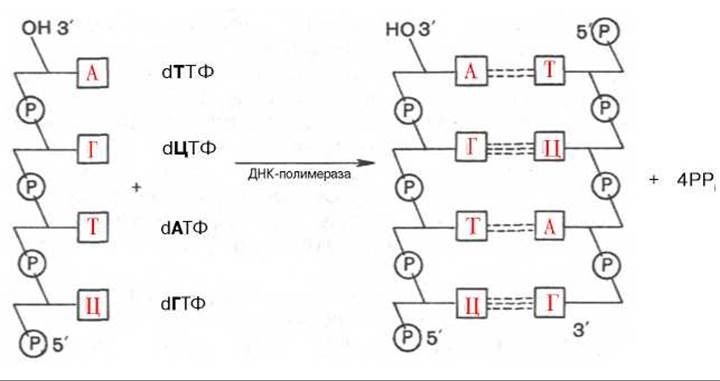
Были предприняты другие подходы к выяснению механизма полимеразной реакции. В лаборатории А. Корнберга был открыт фаг (φХ174, содержащий одноцепочечную кольцевую ДНК. Эту молекулу использовали в качестве матрицы в дНК-полимеразной реакции и получили биологически активную ДНК фага, использовав фермент ДНК-лигазу, обладающую способностью катализировать соединение (сшивку) концов разрывов в молекуле ДНК. Было показано, что в процессе репликации одноцепочечная ДНК фага (φХ174 проходит стадию образования двухцепочечной кольцевой ДНК. Применив ряд остроумных подходов, А. Корнберг и сотр. в опытах in vitro создали искусственную молекулу фага φХ174, обладающую способностью поражать (инфицировать) Е. coli, вызывая лизис бактерии. Последовательность событий может быть представлена на схеме, где исходная молекула кольцевой ДНК фага φХ174 обозначена плюсом (+), а вновь синтезируемая молекула — минусом (—) (рис. 13.1). М. Мезельсон и Ф. Сталь показали полуконсервативный механизм репликации ДНК, включающий образование дочерних молекул ДНК, в каждой из которых сохраняется лишь одна родительская цепь (рис. 13.2; 13.3).
Сложность процесса репликации ДНК объясняется тем, что обе цепи реплицируются одновременно, хотя имеют разное направление (5'—>3' и 3'—>5) кроме того, рост дочерних цепей также должен происходить в противоположных направлениях. Элонгация каждой дочерней цепи может осуществляться только в направлении 5'—>3'. Р. Оказаки высказал предположение, подтвержденное экспериментальными данными, что синтез одной из дочерних цепей осуществляется непрерывно в одном направлении, в то время как синтез другой дочерней цепи происходит прерывисто, путем соединения коротких фрагментов (в честь автора названы фрагментами Оказаки), в свою очередь синтезирующихся в противоположном направлении (рис. 13.4).
Как видно, синтез ведущей цепи ДНК идет всегда в направлении 5'—>3', соответствующем направлению движения репликационной вилки. Сохраняя правило синтеза дочерних молекул ДНК 5'—>3', синтез на второй цепи родительской ДНК идет в направлении, противоположном движению репликационной вилки. В зависимости от типа клетки фрагменты Оказаки имеют разные размеры — от нескольких сот до нескольких тысяч нуклеотидов (150—200 у эукариот и 1000—2000 у бактерий).
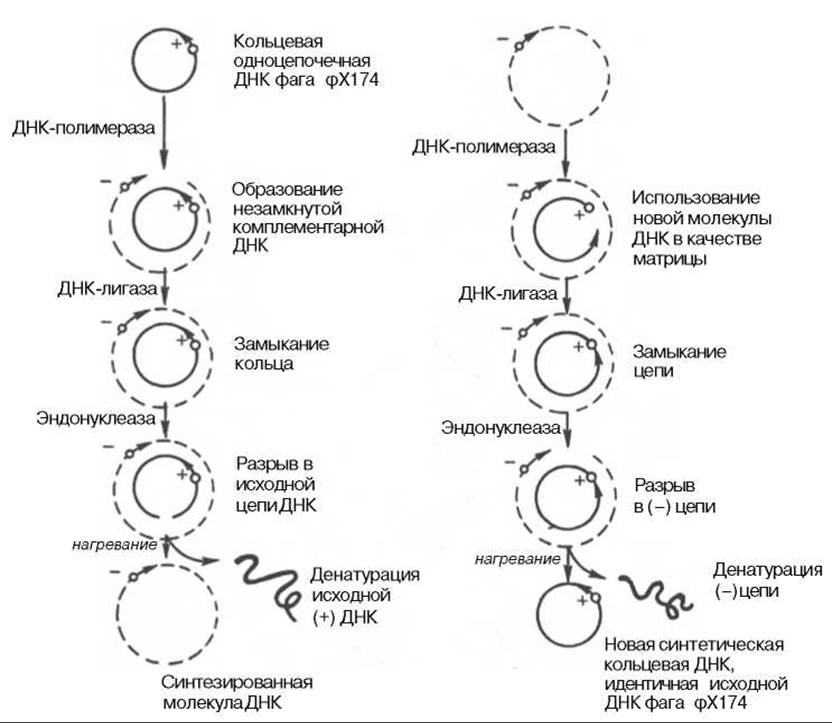
Рис. 13.1. Роль ДНК-полимеразы и ДНК-лигазы в синтезе кольцевой одноцепочечной ДНК фага фХ174.
Получены доказательства, что образование каждого фрагмента Оказаки требует наличия короткого затравочного комплементарного праймера — участка РНК, синтез которого катализируется праймазой. Затем при участии ДНК-полимеразы III синтезируются длинные участки ДНК. РНК-затравки далее вырезаются при участии ДНК-полимеразы I, а свободные места их (бреши) замещаются (достраиваются) комплементарными дезоксирибонуклеотидами под действием той же ДНК-полимеразы I; наконец, сшивание разъединенных участков отстающей цепи осуществляется при помощи ДНК-лигаз. Подобный механизм челночного синтеза ДНК легко объясняет фактические данные о накоплении коротких фрагментов ДНК у Е. coli во время репликации ДНК.
Особенности репликации ДНК у эукариот. Репликация ДНК у эукариот, по существу аналогичная репликации ДНК у прокариот, имеет ряд особенностей. Например, вместо одной точки репликации в ДНК эукариот имеются специфические точки «начала», так называемые автономно реплицирующие последовательности (около 300 нуклеотидных пар); в дрожжевой клетке таких элементов около 400. Кроме того, скорость движения репликационной вилки у эукариот (примерно 50 нуклеотидов в секунду) почти в 10 раз ниже, чем у E. coli. Для репликации ДНК генома человека из одной-единственной точки с подобной скоростью потребовалось бы более 500 ч; вместо этого репликация генома человека происходит в обоих направлениях и одновременно из множества точек (множество «начал» репликации), вовлекая от 30000 до 330000 пар оснований. Репликация продолжается до тех пор, пока не будут синтезированы две дочерние молекулы ДНК, в каждой из которых содержится одна родительская цепь (см. рис. 13.4). Таким образом, множественность точек «начала» репликации ДНК, вероятнее всего, является общим правилом для всех клеток эукариот.
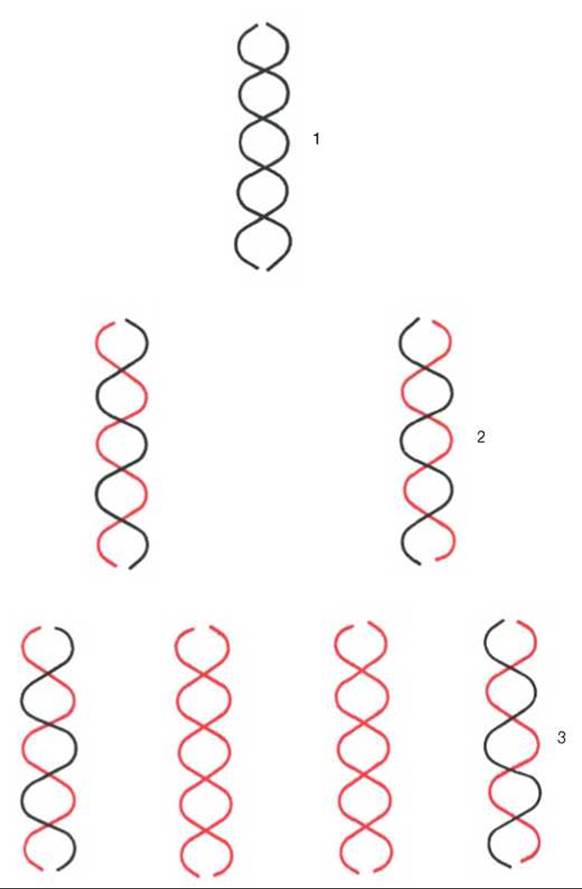
Рис. 13.2. Полуконсервативная репликация ДНК in vitro.
Каждая из двух цепей родительской ДНК служит матрицей для синтеза дочерних молекул ДНК. 1 - родительская молекула; 2 - дочерние молекулы (первая генерация); 3 - дочерние молекулы (вторая генерация).
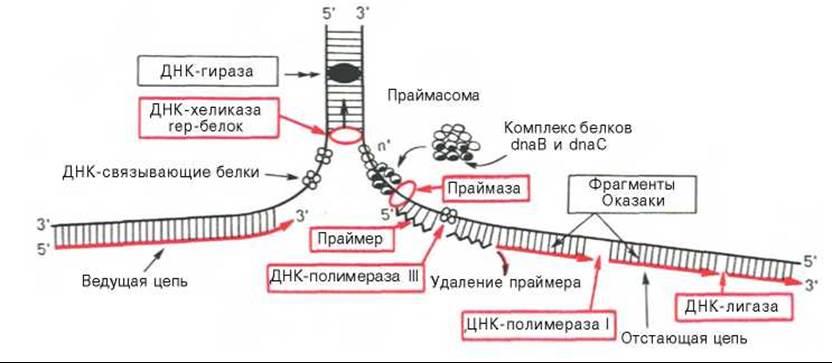
Рис. 13.3. Основные этапы репликации ДНК (схема).
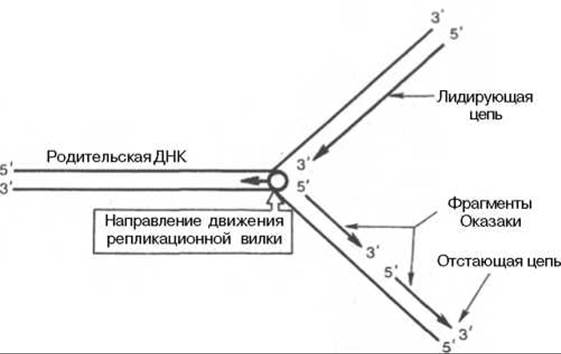
Рис. 13.4. Схематическое изображение непрерывного и прерывистого синтеза цепей ДНК при репликации.
Как было указано, инициация биосинтеза дочерних цепей ДНК требует предварительного синтеза на матрице ДНК необычного затравочного олигорибонуклеотида, названного праймером, со свободной гидроксильной группой у С-3' рибозы. Этот короткий олигорибонуклеотид синтезируется комплементарно на матрице ДНК при участии особого фермента — праймазы, наделенной РНК-полимеразной активностью.
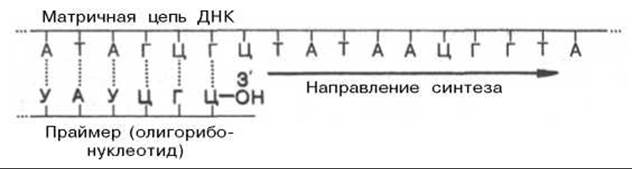
Предполагают, что именно с этой точки концевого 3'-гидроксила рибозы праймера начинается истинный синтез лидирующей дочерней цепи ДНК, комплементарной родительской. Синтез начинается с реакции между 3'-ОН-группой концевого рибонуклеотида праймера и а-фосфатной группой первого дезоксирибонуклеотидтрифосфата в строгом соответствии с комплементарностью родительской цепи ДНК, при этом освобождается пирофосфат. В дальнейшем этот фрагмент РНК, комплементарно присоединенный к новообразованной цепи ДНК, разрушается под действием ДНК-полимеразы I, и возникшая брешь застраивается олигодезоксирибонуклеотидом при помощи той же ДНК-полимеразы I. Вполне допустимо предположение, что синтез праймера из олигорибонуклеотида имеет глубокий биологический смысл, поскольку в этом случае могут устраняться ошибки, неизбежно возникающие при инициации репликации ДНК.
Этапы биосинтеза ДНК. Предложен ряд моделей механизма биосинтеза ДНК с участием указанных ранее ферментов и белковых факторов, однако детали некоторых этапов этого синтеза еще не выяснены. Основываясь главным образом на данных, полученных в опытах in vitro, предполагают, что условно механизм синтеза ДНК у Е. coli может быть подразделен на три этапа; инициацию, т.е. начало, элонгацию, т.е. продолжение, и терминацию, т.е. завершение (прекращение) синтеза. Каждый из этих этапов требует участия специфических ферментов и белковых факторов.
Этап I — инициация биосинтеза ДНК — является началом синтеза дочерних нуклеотидных цепей; в инициации участвует минимум восемь хорошо изученных и разных ферментов и белков. Первая фаза — это, как указано ранее, ферментативный биосинтез на матрице ДНК необычного затравочного олигорибонуклеотида (праймера) со свободной гидроксильной группой у С-3' рибозы. При инициации к цепям ДНК последовательно присоединяются ДНК-раскручивающие и ДНК-связывающие белки, а затем комплексы ДНК-полимераз и праймаз (см. рис. 13.3). Инициация представляется единственной стадией репликации ДНК, которая весьма тонко и точно регулируется, однако детальные механизмы ее до сих пор не раскрыты и в настоящее время интенсивно исследуются.
Этап II — элонгация синтеза ДНК — включает два кажущихся одинаковыми, но резко различающихся по механизму синтеза лидирующей и отстающей цепей на обеих материнских цепях ДНК. Синтез лидирующей цепи начинается с синтеза праймера (при участии праймазы) у точки начала репликации, затем к праймеру присоединяются дезоксирибонуклеотиды под действием ДНК-полимеразы III; далее синтез протекает непрерывно, следуя шагу репликационной вилки. Синтез отстающей цепи, напротив, протекает в направлении, обратном движению репликационной вилки и начинается фрагментарно. Фрагменты всякий раз синтезируются раздельно, начиная с синтеза праймера, который может переноситься с готового фрагмента при помощи одного из белковых факторов репликации в точку старта биосинтеза последующего фрагмента противоположно направлению синтеза фрагментов. Элонгация завершается отделением олигорибонуклеотидных праймеров, объединением отдельных фрагментов ДНК при помощи ДНК-лигаз и формированием дочерней цепи ДНК. Нельзя исключить, однако, возможности сопряженного и согласованного механизма синтеза лидирующей и отстающей цепей ДНК при участии полимераз и всего комплекса праймасом.
Этап III — терминация синтеза ДНК — наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации.
Синтез ДНК на матрице РНК. Выдающимся достижением биохимии нуклеиновых кислот является открытие в составе онковирусов (вирус Раушера и саркомы Рауса) фермента обратной транскриптазы, или ревертазы (РНК-зависимая ДНК-полимераза), катализирующего биосинтез молекулы ДНК на матрице РНК. Накоплены данные о том, что многие РНК-содержащие онкогенные вирусы, получившие наименование онкорнавирусов, содержат ревертазу в составе покровных белков. Фермент открыт также во многих клетках прокариотов и эукариотов, в частности в лейкозных клетках, пролиферирующих тканях, включая эмбриональные ткани. Ревертаза онкорнавирусов содержит ионы Zn2+ и активируется катионами Мn2+ и Mg2+. Предполагают, что синтез ДНК на матрице РНК происходит в 3 этапа. На I этапе фермент ревертаза синтезирует на матрице вирусной РНК комплементарную цепь ДНК, что приводит к формированию гибридной молекулы. Второй этап — разрушение исходной вирусной РНК из комплекса гибридной молекулы под действием РНКазы. Наконец, на III этапе на матрице цепи ДНК комплементарно синтезируются новые цепи ДНК. Ревертазной активностью обладают и ДНК-полимеразы: например, фермент из Е. coli способен катализировать синтез ДНК на матрице рРНК.
Открытие обратной транскриптазы имеет большое значение не только для выяснения закономерностей процесса малигнизации, но и для всей науки о живом, поскольку указывает на возможность передачи наследственной информации от РНК на ДНК, не подчиняясь основному постулату (поток информации идет только в одном направлении):
ДНК —> РНК —> Белок.
В настоящее время можно дополнить эту основную схему передачи генетической информации в живой клетке и представить ее в более полной форме:
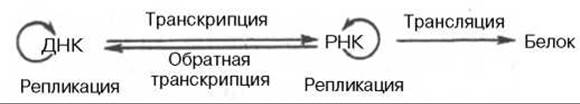
На схеме стрелки вокруг ДНК и РНК указывают на возможность молекул копировать самих себя в живых системах при участии соответствующих ферментов. Как знать, не станем ли мы свидетелями открытия принципиальной возможности поворота стрелки и на следующей стадии — от белка на РНК, что могло происходить на Земле при зарождении первичных живых существ?
Биосинтез РНК
Поток генетической информации называется экспрессией генов. Он включает процесс транскрипции — биосинтез матричных РНК (как и других типов клеточных РНК) на молекуле ДНК, и процесс трансляции — биосинтез белка на мРНК, т.е. генетическая информация ДНК реализуется путем программированного через мРНК синтеза белков, определяющих в конечном счете фенотипические признаки живых организмов. Подсчитано, что около 90—95% ДНК E. coli экспрессируется в мРНК, хотя большая часть последней не кодирует синтеза белка; небольшая часть ДНК кодирует синтез двух других клеточных РНК, т.е. рРНК и тРНК. Транскрипция, несмотря на кажущуюся схожесть с репликацией, в частности химическим механизмом, направлением синтеза и использованием матрицы, отличается рядом особенностей: не требует синтеза праймера, использует не всю молекулу ДНК, а только ее отдельные короткие сегменты (отдельные гены или группы генов) и, наконец, требует наличия только одной из цепей ДНК в качестве матрицы, которая полностью сохраняется (при репликации ДНК она сохраняется наполовину). Геном каждой клетки человека состоит из 3,5 ∙ 109 пар оснований; они могут обеспечить кодирование более 1,5 ∙ 106 пар генов. Однако имеющиеся данные о количестве и разнообразии белков в организме человека (около 100000) свидетельствуют о том, что значительная часть генома человека не транскрибируется и соответственно не переводится на аминокислотную последовательность белков. Известно также, что определенная часть нетранслируемого генома человека выполняет регуляторную функцию в процессе экспрессии генов. В молекуле ДНК различают, кроме уникальных неповторяющихся последовательностей, содержащих кодирующие гены, также множество повторяющихся последовательностей (повторы), биологический смысл которых до сих пор неясен (см. далее).
Современные представления о механизме синтеза РНК в клетках в значительной степени обязаны открытию в 1960 г. в двух лабораториях США (Дж. Хервиц и С. Вейс) особого фермента — РНК-полимеразы, катализирующей синтез РНК из свободных нуклеозидтрифосфатов. Фермент требует наличия ионов Mg2+ или Мn2+ и одновременного присутствия всех 4 типов рибонуклеозидтрифосфатов (АТФ, ГТФ, ЦТФ и УТФ). Самым удивительным свойством фермента оказалось то, что для включения нуклеотидов в РНК необходимо обязательное присутствие предобразованной ДНК-матрицы*. При тщательном изучении механизма синтеза РНК при участии РНК-полимеразы, называемой также ДНК-зависимой РНК-полимеразой (транскриптазой), было установлено, что молекула предобразованной ДНК, необходимая для реакции полимеризации, полностью определяет последовательность рибонуклеотидов во вновь синтезированной молекуле РНК. Другими словами, на матрице ДНК комплементарно строится полирибонуклеотид, являющийся копией первичной структуры ДНК, с той только разницей, что вместо тимидилового нуклеотида ДНК в РНК включается уридиловый нуклеотид. Реакция синтеза РНК в общем виде может быть представлена следующим образом:
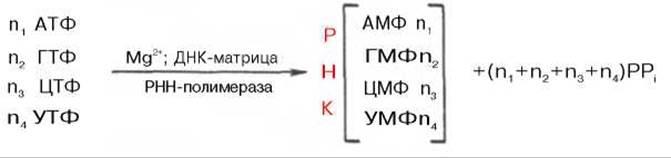
В синтезируемой молекуле РНК отдельные мононуклеотиды, как и в ДНК, связаны между собой 3'-5'-фосфодиэфирными мостиками. Кроме того, сам механизм действия фермента РНК-полимеразы во многом совпадает с таковыми ДНК-полимеразы: синтез также идет в направлении 5'—>3', цепь РНК имеет полярность, противоположную цепи предобразованной ДНК. Однако выявлены и существенные различия. РНК-полимераза Е. coli предпочтительнее функционирует в присутствии нативной двухцепочечной ДНК; в опытах in vitro обе цепи ДНК копируются РНК-полимеразой; in vivo транскрибируется, вероятнее всего, только одна цепь ДНК. Предполагают, что РНК-полимераза связывается с одной цепью нативной ДНК в определенной точке, вызывая расплетение биспиральной структуры на ограниченном участке, где и происходит синтез РНК. Данные свидетельствуют, что у E. coli, скорее всего, имеется единственная ДНК-зависимая РНК-полимераза, которая катализирует синтез всех типов клеточных РНК.
* Позже были открыты также ферменты (преимущественно в составе оболочек фагов и у ряда бактерий), катализирующие синтез РНК на матрице РНК.
РНК-полимераза Е. coli изучена наиболее подробно. Это олигомерный фермент, состоящий из двух одинаковых а-субъединиц (мол. масса 36000), двух разных ß (ß1 и ß2)-субъединиц (мол. масса соответственно 151000 и 155000), w-субъединицы (мол. масса 11000) и σ-субъединицы; общая мол. масса фермента около 390000. Считают, что функция σ-субъединицы (σ-фактор) — узнавание определенного участка на матрице ДНК, названного промотором, к которому присоединяется РНК-полимераза. В результате образуется так называемый открытый комплекс фермента с ДНК: двухцепочечная структура ДНК раскрывается («плавится»). Далее на одной из нитей ДНК, как на матрице, синтезируется мРНК; синтез заканчивается в определенной точке в конце гена или прерывается под действием особых белков. Другим субъединицам фермента приписывают функцию инициации биосинтеза РНК (а-субъединицам) и основную каталитическую функцию (связывание субстратов и элонгация синтеза) — ß-субъединицам. Кроме того, открыт ряд белков, принимающих участие в механизме синтеза РНК в клетке. В частности, исследуется природа репрессорных белков и белка-терминатора (р-фактора). Последний обладает способностью обратимо связываться с терминирующими участками ДНК (так называемые стопсигналы транскрипции), выключая действие РНК-полимеразы. При отсутствии этого белка образуются исключительно длинные цепи РНК.
У эукариот открыты три разные РНК-полимеразы (I, II и III) с большой молекулярной массой (от 500000 до 600000), каждая из которых наделена специфической функцией. РНК-полимераза I ответственна за синтез только рибосомных РНК (рРНК), точнее одного-единственного прерибосомного РНК-транскрипта, предшественника 5,8S, 18S и 28S рРНК; фермент связывается с разными промоторными участками. РНК-полимераза II — основной фермент, катализирующий синтез матричной РНК (мРНК). Он наделен способностью распознавать огромное множество промоторных участков, многие из которых имеют специфические ключевые последовательности, являющиеся местами (сайтами) связывания транскрипционных белковых факторов. РНК-полимераза III катализирует преимущественно синтез транспортных РНК (тРНК), а также 5S рРНК и ряда других низкомолекулярных РНК со специфической функцией. У эукариот работу РНК- полимеразы обеспечивает множество регуляторных белков (факторы транскрипции), объединенных вместе с ферментом в единый транскрипционный комплекс. В частности, открыты транскрипционные факторы типа J, активные только в виде идентичных димеров (J1J1 или J2J2) или разных димеров (J1J2); эти факторы кодируются отдельными генами и сами запускают работу ряда генов, регулирующих клеточное деление. В результате мутации генов, кодирующих синтез транскрипционных факторов, резко повышается прочность связывания J-факторов с ДНК, что обычно приводит к нерегулируемому опухолевому росту клеток.
Биогенез матричных РНК
Процесс образования молекулы мРНК на матрице ДНК — биогенез мРНК — в прокариотических клетках представляется относительно простым и включает главным образом транскрипцию соответствующего гена при участии РНК-полимеразы. Во многих случаях первичным продуктом экспрессии гена является молекула мРНК, уже способная к функционированию, т.е. у прокариот транскрипция и трансляция являются сопряженными процессами. Биосинтез тРНК у прокариот из первичного тРНК транскрипта проходит стадию процессинга аналогично синтезу мРНК и тРНК у эукариот (см. далее).
Биогенез мРНК у эукариот существенно отличается не только механизмом регуляции транскрипции, но и многоступенчатостью формирования активной молекулы. До открытия феномена сплайсинга (от англ. splicing — созревание, сращивание) мРНК было известно, что многие мРНК эукариот синтезируются в виде гигантских высокомолекулярных предшественников (пре-мРНК), которые уже в ядре подвергаются посттранскрипционному процессингу. Предполагали, что процессинг включает удаление длинных 5'- и 3'-концевых участков, которые якобы выполняют регуляторные функции. Как оказалось, ген эукариот является не непрерывной, а мозаичной структурой, содержащей наряду с кодирующими (экзоны) также некодирующие (интроны) последовательности. Фермент РНК-полимераза катализирует транскрипцию как экзонов (от англ. exit — выход, поскольку продукты транскрипции — участки мРНК — выходят из ядра в цитоплазму и выполняют функцию матрицы в синтезе белка), так и интронов с образованием гетерогенной ядерной РНК (гяРНК), называемой также первичным транскриптом. Термин «интроны» означает вставочные, нетранслирующие последовательности нуклеотидов в ДНК эукариот. Этот термин применим и к вставочным нуклеотидным последовательностям первичного РНК-транскрипта.
С открытием интрон-экзонного строения генов, характерного для эукариотических клеток, начался новый этап исследований на пути реализации генетической информации. Транскрипция гена, состоящего из чередующихся кодирующих и некодирующих нуклеотидных последовательностей, обеспечивала полное его копирование и приводила к синтезу РНК-предшественника. Поэтому было высказано предположение о существовании между транскрипцией и трансляцией еще одного важного звена — образования пригодной для трансляции «зрелой» молекулы мРНК. Этот этап получил название процессинга, или созревания, мРНК.
К настоящему времени считается установленным, что процессинг мРНК включает три основных процесса: 1) кэпирование — химическая модификация 5'-концевой последовательности мРНК; 2) сплайсинг — удаление некодирующих интронных последовательностей из мРНК и сшивание образующихся экзонов; 3) полиаденилирование — химическая модификация 3'-концевой последовательности мРНК (рис. 13.5).
В осуществлении каждого из указанных процесов специфическое участие принимает ряд белков и нуклеиновых кислот, хотя конкретные молекулярные механизмы этих превращений еще не полностью раскрыты. Все три указанных процесса имеют важное значение в формировании зрелой молекулы мРНК. Однако наибольший интерес исследователи проявляют к выяснению молекулярного механизма сплайсинга, который должен обеспечить, во-первых, постепенное и высокоточное вырезание интронов из первичного транскрипта и, во-вторых, сшивание образующихся фрагментов — экзонов — «конец в конец». Любые отклонения или смещения границ в процессе вырезания интронов и сшивания экзонов даже на один нуклеотид могут привести не только к глубокому искажению смысла в кодирующих последовательностях, но и к нарушению передачи генетической информации и развитию патологии.
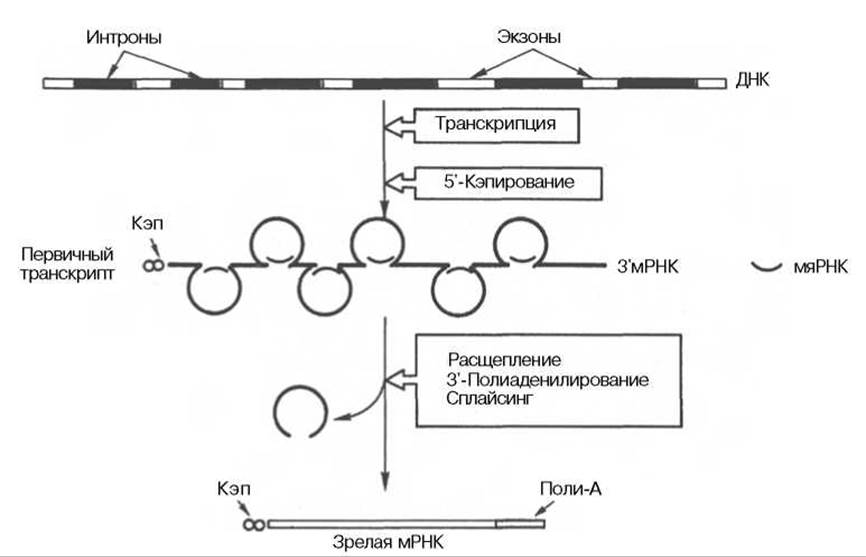
Рис. 13.5. Биогенез мРНК у эукариот.
Последовательность нуклеотидов в молекуле мРНК обычно начинается с пары 5'-ГУ и заканчивается парой АГ-3'. Эти последовательности, вероятнее всего, служат сайтами (местами) узнавания для ферментов сплайсинга. Поскольку 5'-ГУ ... АГ-3' последовательности не открыты в молекулах предшественников тРНК, было высказано предположение о существовании по меньшей мере двух типов ферментов сплайсинга; одного для мРНК и другого для тРНК. Имеются, кроме того, достоверные данные о том, что интроны часто оказываются длиннее экзонов и что внутри гена на интроны приходится значительно большая часть нуклеотидных пар. Подсчитано, например, что ген овальбумина содержит 7 интронов, в общей сложности насчитывающих 7700 пар оснований, в то время как сформировавшаяся после сплайсинга мРНК насчитывает всего 1859 оснований. Почти во всех эукариотических клетках синтезированные на структурных генах первичные транскрипты подвергаются процессингу, прежде чем выполнят свои уникальные функции в белковом синтезе. Во многих случаях процессинг имеет место главным образом в ядре, хотя этот процесс продолжается и после транспортировки молекул РНК из ядра в цитоплазму: например, терминальные реакции полиаденилирования и метилирования остатков нуклеозидов.
Химический смысл кэпирования сводится к присоединению остатка 7-метилгуанозина посредством трифосфатной группы к 5'-концу молекулы транскрипта, метилированию 2'-ОН-группы первого и второго нуклеотидов на 5'-конце мРНК. Полиаденилирование 3'-конца первичного транскрипта включает ряд стадий и участие эндонуклеазы и полиаденилатполимеразы. Эндонуклеаза расщепляет мРНК вблизи специфической сигнальной последовательности (5')ААУААА(3'), отличающейся высокой консервативностью. Полиаденилатполимераза синтезирует поли-А-конец (от 20 до 250 нуклеотидов) начиная с точки распада.
Функции 5'-кэп и 3'-поли-А раскрыты недостаточно полно. Показано, что 5'-кэп, соединяясь со специфическим белком, принимает участие в связывании мРНК с рибосомой, способствуя инициации синтеза белка. Допускают, что основное назначение 5'-кэп и поли-А — защита мРНК от энзиматического распада. Известно также, что не все цитоплазматические мРНК содержат участки поли-А на 3'-концах и что в цитоплазме клеток животных происходит как присоединение, так и удаление участка поли-А из молекулы мРНК. Следует отметить, что размер молекулы цитоплазматической мРНК даже после удаления 3'-поли-А оказывается все же намного большим, чем требуется для синтеза кодируемого белка. В частности, размер мРНК белка глобина (эритроциты кролика) составляет 550 нуклеотидов, в то же время кодирующий участок состоит из 430 нуклеотидов (размер поли-А — 40 нуклеотидов). Другой пример: размер мРНК тяжелого иммуноглобулина (из клеток миеломы мышей) составляет 1800 нуклеотидных остатков, а кодирующая часть — 1350 нуклеотидов (размер поли- А — 150—200 нуклеотидов). Интересно, что большинство указанных процессов, если не все, могут регулироваться независимо, изменяя уровень экспрессии гена. Более того, даже после завершения формирования мРНК изменения ее стабильности могут оказывать существенное влияние на экспрессию гена.
В последние годы интенсивно исследуются структура и назначение нетранслируемых участков генов — интронов. Они различаются по числу, размерам и топографии. Показано, например, что ген сывороточного альбумина хотя и содержит всего 6 интронов, но на их долю приходится до 80% этого гена; интроны имеют размеры от 90 до 20000 нуклеотидных пар. Ген коллагена содержит более 50 интронов. Исключение составляют лишь гены, кодирующие гистоны, не содержащие интронных структур. Различают 4 класса интронов. Первый класс открыт как в ядерных, так и в митохондриальных генах, кодирующих рибосомные рРНК; второй класс интронов открыт в первичных транскриптах митохондриальных матричных мРНК. Оказалось, что оба эти класса интронов не нуждаются ни в источнике энергии, ни в участии ферментов, но наделены способностью самосплайсинга. Третий — самый большой класс интронов обнаружен в первичных транскриптах ядерных мРНК, подвергающихся созреванию. Сплайсинг требует наличия комплекса белков и особой группы клеточных РНК, названных малыми ядерными РНК (мяРНК). Выделено и охарактеризовано 5 групп богатых уридином мяРНК, соответственно обозначаемых U1, U2, U4, U5 и U6, размерами от 100 до 200 нуклеотидов. Комплексы мяРНК и белков, названные малыми ядерными нуклеопро- теинами, объединяются в единую систему — сплайсосому, координирующую весь процесс сплайсинга. Предполагают, что мяРНК соединяются с обеими концами интрона, способствуя формированию специфической конформации, необходимой для узнавания ее участвующими в процессе ферментами, сближению двух экзонов, удалению интронов и воссоединению кодирующих экзонов. Четвертый класс интронов открыт в ряде тРНК. Сплайсинг этой группы интронов требует доставки энергии и присутствия эндонуклеаз и лигаз, катализирующих соответственно разрыв фосфодиэфирных связей с 5'- и 3'-концов интрона и соединяющих два экзона.
Укажем также на весьма интересные и новые данные о существовании в структуре мРНК-предшественника, помимо экзонов и интронов, особых, так называемых альтернативно сплайсируемых, последовательностей. Выявлены примеры неоднозначного протекания сплайсинга для ряда генов. Результат альтернативного сплайсинга — появление нескольких продуктов при экспрессии одного гена. Так, получены доказательства, что экспрессия одного и того же гена тропомиозина позволяет получить семь изоформных белков, специфичных для разных групп мышц (гладких и поперечнополосатых) или для фибробластов и миобластов. В то же время известны примеры формирования одного белкового продукта (например, олигомерного фермента глюкозо-6-фосфатдегидрогеназы) при экспрессии двух разных генов. Все эти данные свидетельствуют о том, что альтернативный сплайсинг может играть существенную роль в функционировании генома клеток высших организмов.
В нетранскрибируемых последовательностях генома перед экзонинтронами открыты специфические участки, названные промоторами, а также энхансерами (повышающие уровень транскрипции) и силан-серами (ослабляющие уровень транскрипции). При взаимодействии с белками они выполняют функции регуляторных сигналов при транскрипции. Этот способ регуляции широко используется клетками эукариот как в процессах дифференцировки, так и при индукции репрессии (см. главу 14).
Нельзя не упомянуть об открытии рибозимов, т.е. молекул РНК, выступающих в качестве катализатора. Пожалуй, это единственные из известных макромолекул, которые наделены как информационной, так и каталитической функцией. Открытие каталитических РНК поколебало само понятие «фермент». Оказалось, что некоторые РНК осуществляют посттранскрипционный процессинг, катализируя самосплайсинг, т.е. участвуют в разрезании и удалении интронов. Наделенные рядом свойств истинных и эффективных катализаторов рибозимы участвуют в двух типах реакций: в гидролизе (разрыве) фосфодиэфирной связи и в реакциях трансэтерификации. В качестве субстрата могут служить, помимо собственного, предшественник (про-РНК) и другие молекулы РНК. Сейчас интенсивно изучается третичная структура рибозимов, а первичная и вторичная структуры ряда из них уже расшифрованы. Эти исследования, несомненно, интересные сами по себе, могут пролить свет и на пути развития биологической эволюции.
Для полного понимания молекулярных механизмов сложного процесса биогенеза мРНК предстоит решить множество вопросов. В частности, необходимо выделить в чистом виде и охарактеризовать белковые факторы, принимающие участие в этой регуляторной системе. Далее следует раскрыть механизмы узнавания промотора, терминации и антитерминации, избирательного метилирования, а также тонкие молекулярные механизмы регуляции сплайсинга. Решение указанных проблем будет, несомненно, способствовать лучшему пониманию сущности механизмов регуляции экспрессии генов эукариотических клеток в норме и при патологии.
Биогенез транспортных РНК
Транспортные РНК в клетке выполняют адапторную функцию при трансляции информации мРНК в первичную структуру белка. Как было указано в главе 3, в молекуле тРНК содержится 8—10% необычных («минорных») азотистых оснований в составе нуклеотидов. Молекулы тРНК как у эукариот, так и у прокариот синтезируются в виде больших предшественников, часто содержащих последовательности более одной тРНК, которые затем подвергаются нуклеолитическому процессингу при участии специфических рибонуклеаз. Гены некоторых тРНК содержат вблизи участка ДНК, ответственного за синтез антикодоновой петли, интронные последовательности (около 18 нуклеотидов). Эти участки также транскрибируются, поэтому процессинг тРНК включает, помимо удаления 18-членного рибонуклеотидного интрона, также необходимый сплайсинг антикодоновой области. Дальнейшая модификация включает присоединение триплета ЦЦА и образование акцепторного участка (на 3'-конце молекулы), к которому присоединяется аминокислота. Имеются данные, что метилирование предшественников тРНК у эукариот осуществляется в ядре, в то время как ферментативные процессы удаления интрона и присоединения триплета ЦЦА происходят, скорее всего, в цитоплазме. Помимо акцепторного и антикодонового участков, тРНК содержит специфичные участки узнавания для ферментов — аминоацил-тРНК-синтетаз, а также участки для связывания с большими субчастицами рибосом (см. далее главу 14).
Биогенез рибосомных РНК
У прокариот синтез 23S, 16S и 5S рРНК осуществляется из более крупного 30S предшественника, получившего название прерибосомной РНК (пре-рРНК). Под действием специфических нуклеаз и метилаз из этого общего предшественника в результате процессинга сначала образуются промежуточные рибосомные РНК, которые, подвергаясь дальнейшей нуклеазной атаке и метилированию, превращаются в зрелые молекулы (рис. 13.6).
Для ряда эукариотических клеток доказана транскрипция двух высокомолекулярных рРНК (18S и 28S) и одной низкомолекулярной рРНК (5,8S) из одного общего предшественника (45S); последний представляет собой продукт генов рРНК, более тысячи копий которых содержит клетка. Первичный транскрипт 45S рРНК высокометилирован, причем метилированию в ядрышках подвергаются только те участки первичного транскрипта, из которых в процессе реакций процессинга образуются рРНК. Сам механизм процессинга первичного транскрипта резко отличается от процессинга гяРНК при образовании мРНК. Образовавшаяся, например, молекула 28S рРНК еще в ядрышке подвергается дальнейшему метилированию, затем она взаимодействует с синтезированными в цитоплазме рибосомными белками и формируется 60S рибосомная субчастица; 18S рРНК аналогичным способом участвуют в формировании 40S рибосомной субчастицы. Обе субчастицы стабильны в делящихся клетках и нестабильны в неделящихся клетках.
Следует указать, что синтез РНК при участии ДНК-зависимой РНК-полимеразы специфически тормозится антибиотиком актиномицином D, который обладает способностью связываться водородными связями с ДНК по месту остатков гуанина. Актиномицин D тормозит синтез РНК в интактных клетках. Он нашел широкое применение при определении процессов, зависящих от транскрипции ДНК.
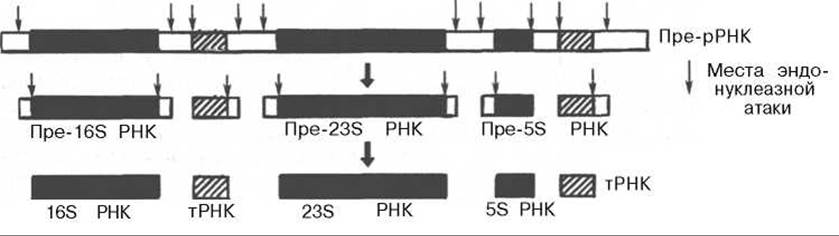
Рис. 13.6. Постсинтетическая модификация пре-рРНК прокариот (по Николову). 494
Синтез РНК на матрице РНК
ДНК-зависимая РНК-полимераза может осуществлять транскрипцию ДНК нормальных клеток и ДНК-вирусов. Как же осуществляется синтез РНК у тех вирусов, которые в геноме вместо ДНК содержат РНК? Оказывается, в этих случаях вирусная РНК индуцирует образование в клетках хозяина (например, у Е. coli) РНК-зависимой РНК-полимеразы, которая участвует в репликации вирусной РНК (отсюда второе название фермента — РНК-репликаза). Фермент также используется нуклеозидтрифосфаты для синтеза одноцепочечной вирусной РНК. Этот синтез должен пройти через стадию образования репликативной формы. Следовательно, на I стадии РНК-репликаза на матрице РНК-вируса специфически строит комплементарную, с противоположной полярностью цепь РНК. Последняя на II стадии служит матрицей для синтеза РНК, совершенно однотипной исходной вирусной РНК. Обе стадии катализируются одним и тем же ферментом, хотя в каждой из них участвуют различные белковые факторы. Следует особо подчеркнуть, что, поскольку РНК-репликаза имеет отношение только к вирусам, очевидно, на этом основании могут быть разработаны эффективные антивирусные лекарственные препараты.
Синтез РНК из нуклеозиддифосфатов. М. Грюнберг-Манаго и С. Очоа в 1955 г. в клетках Е. coli открыли особый фермент — полинуклеотид-фосфорилазу. Этот фермент наделен способностью синтезировать in vitro полимерную молекулу РНК из однотипных или разных рибонуклеозиддифосфатов (НДФ). Реакция, являющаяся обратимой, протекает по уравнению:
(НМФ)n + НДФ —> (НМФ)n+1 + Н3РO4.
Рибонуклеозидтрифосфаты и дезоксирибонуклеозидтрифосфаты не являются субстратами фермента. Фермент не нуждается в матрице, однако для синтеза необходима затравочная цепь РНК (НМФ)n со свободной З'-гидроксильной группой, к которой присоединяются остатки мононуклеотидов. Образовавшаяся полимерная молекула РНК не имеет заданной специфической последовательности мононуклеотидов, но содержит 3'—>5' фосфодиэфирные связи, легко разрываемые рибонуклеазой. Относительно биологической роли этого фермента у бактерий предполагают, что он катализирует, скорее всего, обратную реакцию — расщепление мРНК с образованием нуклеозиддифосфатов.
Полученные в лаборатории С.С. Дебова данные свидетельствуют о более широком распространении полирибонуклеотид-фосфорилазы в живых организмах, чем это признавалось ранее. Фермент открыт также в клетках животных. Кроме того, получены экспериментальные доказательства синтетической функции полинуклеотид-фосфорилазы. Вполне правомерно допущение, что этот фермент может принимать участие в синтезе коротких полирибонуклеотидов в клетках эукариот в норме и в некоторых экстремальных условиях. Кроме того, в лабораторных условиях фермент может найти применение для синтеза РНК-праймеров, используемых далее при синтезе ДНК.
Проблемы генетической инженерии. Генетическая инженерия, по определению А.А. Баева, представляет собой систему экспериментальных приемов, позволяющих создавать в лаборатории (в пробирке) искусственные биологические структуры. В качестве инструментов для генноинженерных операций применяются созданные самой природой ферменты: одни из них рассекают молекулу ДНК в строго определенных участках (рестриктазы), другие, напротив, сшивают разрозненные участки в единое целое (лигазы). Конечной целью генетической инженерии является получение организмов (животных и растений) с новыми наследственными свойствами с помощью лабораторных приемов. Для достижения этой пока еще отдаленной цели необходимо проведение огромной работы на уровне отдельного гена или генов. Ген, представленный определенным участком ДНК и соответствующий определенному белку, можно или выделить из другого организма, или синтезировать химическим либо биологическим путем. Впервые в 1969 г. из Е. coli был выделен участок ДНК с геном, ответственным за синтез фермента, катализирующего усвоение молочного сахара (лактозы), — так называемый лактозный оперон. Химический синтез гена аланиновой тРНК впервые осуществил Хар Гобинд Корана в 1970 г. Состоящий из 72 нуклеотидов, этот ген, однако, лишен функциональной активности, так как в клетках тРНК синтезируется не в готовом виде, а в форме предшественника. Эти данные послужили для Кораны основой для синтеза гена-предшественника тирозиновой тРНК (из 126 нуклеотидов), хотя сама тирозиновая тРНК состоит из 85 нуклеотидов. Ввиду громоздкости, а также недостаточной эффективности химического синтеза в последние годы все большее место занимают биологические методы синтеза генов при помощи обратной транскриптазы (ревертазы). Для этого необходимо иметь мРНК, с помощью которой можно воспроизвести соответствующий ген. Синтезированы ДНК-копии на мРНК, кодирующие синтез белка глобина (человека, кролика, мыши, голубя, утки), иммуноглобулина, белка хрусталика глаза и др. Однако на этом пути синтеза генов встречаются большие трудности, связанные с выделением из огромного разнообразия клеточных мРНК, нужной для синтеза гена.
Следующий этап генетической инженерии — перенос генов в клетку — осуществляется тремя способами: трансформацией (перенос генов посредством выделенной из клеток и освобожденной от примесей ДНК), трансдукцией (перенос генов посредством вирусов) и гибридизацией клеток, полученных из разных организмов (высших животных, микроорганизмов и др.) (рис. 13.7, 13.8). Заключительный этап этих экспериментов сводится к адаптации введенного гена в организме хозяина, но он почти не зависит от искусства экспериментатора.
Исследования в области генетической инженерии могут служить основой для решения практических задач здравоохранения и сельского хозяйства. Полученные в лаборатории искусственные гены, помимо широкого использования в микробиологической и фармацевтической промышленности для приготовления кормового белка и лекарственных препаратов (инсулин, интерферон, гормон роста, гормоны щитовидной железы, стимуляторы иммунитета и др.), возможно, смогут применяться при лечении многих наследственных заболеваний (их насчитывается около 5000), генетический дефект которых точно известен пока только для небольшого числа (не более 50) болезней.
Первые попытки применения лактозного гена при галактоземии (наследственное заболевание, связанное с непереносимостью галактозы вследствие отсутствия фермента гексозо-1-фосфат-уридилилтрансферазы; см.
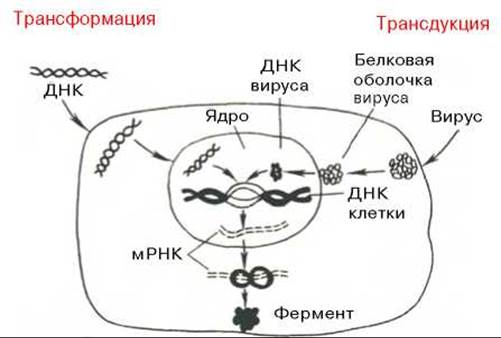
Рис. 13.7. Схематическое изображение двух способов введения генов в клетку — трансформации и трансдукции (по А. А. Баеву).
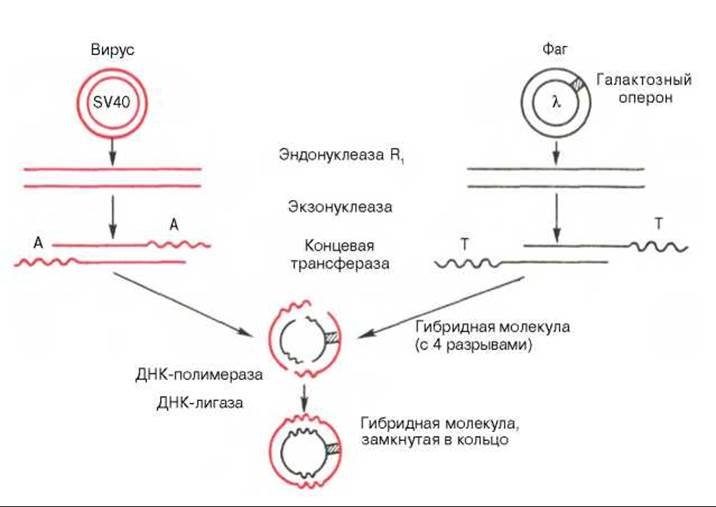
Рис. 13.8. Получение гибридной молекулы, содержащей одновременно ДНК вируса SV40, ДНК фага X, и галактозный оперон (схема по А.А. Баеву).
Под действием эндонуклеазы R1 Е. coli кольцевые ДНК разрываются в одной точке, в результате образуются линейные нити. Под действием другого фермента - экзонуклеазы (из фага) укорачиваются нити ДНК с противоположных концов. Далее при помощи фермента концевой трансферазы наращиваются нити ДНК, причем у одной ДНК новые концы состоят из адениловых (А), у другой - из тимидиловых (Т) остатков. При смешивании молекул концевые остатки А и Т образуют комплементарные пары, замыкая линейные молекулы в кольца. Вначале эти кольца содержат 4 разрыва, которые затем закрываются при участии еще одного фермента - ДНК-лигазы.
главу 10) вселяют надежду на реальные практические возможности генетической инженерии, хотя вполне обоснованы тревога и опасения, связанные с вмешательством человека в сферу тончайших биологических процессов наследственного аппарата целостного организма. В последние годы, после бурного периода расцвета, в генетической инженерии наблюдается некоторый спад, обусловленный недостаточностью знаний о структуре и функционировании генома клеток эукариот. Переход от исследований на клетках прокариот к исследованиям на клетках эукариот оказался затруднен рядом технических сложностей вследствие мозаичности структуры генов последних. В частности, открытие экзонов и интронов в геноме, явления сплайсинга (формирование зрелой матричной РНК) указывает на необходимость соблюдения высочайшей точности процедуры вырезания необходимого гена из ДНК генома соответствующими рестриктазами. В противном случае могут быть получены не структурные транслируемые гены, а интроны или участки экзонов, не кодирующие белок. После того как были разработаны методы искусственного синтеза и сшивки отдельных участков молекулы ДНК, появилась возможность конструирования и создания новых, неизвестных ранее в природе организмов с заранее заданными свойствами. Современная биотехнология явилась логическим развитием этого направления науки. Она сложилась на основе фундаментальных достижений биохимии, генетики и микробиологии, открыв широкие возможности для создания новых сортов растений, новых пород животных и т.п. Учитывая исключительную важность биотехнологии для народного хозяйства, в 1985 г. в нашей стране был создан и успешно работает межотраслевой научно-технический комплекс (МНТК) «Биоген». Комплекс был призван обеспечить создание и организацию промышленного производства новых биологически активных веществ и препаратов для медицины, ветеринарии, растениеводства на основе прогрессивных биотехнологических методов, в том числе методов клеточной и генетической инженерии.