Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Соединительная ткань
Межклеточный органический матрикс соединительной ткани
Протеогликаны
Протеогликаны — высокомолекулярные углеводно-белковые соединения. Они образуют основную субстанцию межклеточного матрикса соединительной ткани. На долю протеогликанов приходится до 30% от сухой массы соединительной ткани.
Полисахаридная группа протеогликанов сначала получила название мукополисахаридов. Эти вещества обнаруживали преимущественно в слизистых субстратах, поэтому к названию «полисахариды» был добавлен префикс «муко». В дальнейшем эти соединения стали называть гликозаминогликанами. Это название и принято в настоящее время.
Гликозаминогликаны (мукополисахариды)
Гликозаминогликаны соединительной ткани — это линейные неразветвленные полимеры, построенные из повторяющихся дисахаридных единиц. В организме гликозаминогликаны не встречаются в свободном состоянии, т.е. в виде «чистых» углеводов. Они всегда связаны с большим или меньшим количеством белка. В их состав обязательно входят остатки мономера либо глюкозамина, либо галактозамина. Второй главный мономер дисахаридных единиц также представлен двумя разновидностями: D-глюкуроновой и L-идуроновой кислотами. В настоящее время четко расшифрована структура шести основных классов гликозаминогликанов (табл. 21.2).
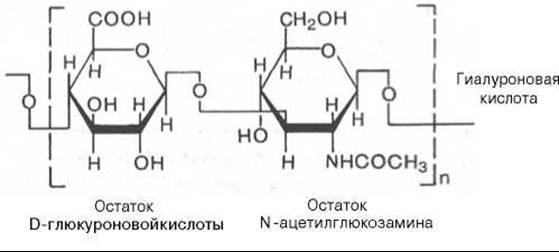
Гиалуроновая кислота впервые была обнаружена в стекловидном теле глаза. Из всех гликозаминогликанов гиалуроновая кислота имеет большую мол. массу (100000—10000000). Доля связанного с гиалуроновой кислотой белка в молекуле (частице) протеогликана составляет не более 1—2% от его общей массы. Считают, что основная функция гиалуроновой кислоты в соединительной ткани — связывание воды.
В результате такого связывания межклеточное вещество приобретает характер желеобразного матрикса, способного «поддерживать» клетки. Важна также роль гиалуроновой кислоты в регуляции проницаемости тканей. Приводим структуру повторяющейся дисахаридной единицы в молекуле гиалуроновой кислоты:
* Десмозин, изодесмозин и лизиннорлейцин, по-видимому, не исчерпывают список соединений, образующих поперечные связи в молекуле эластина.
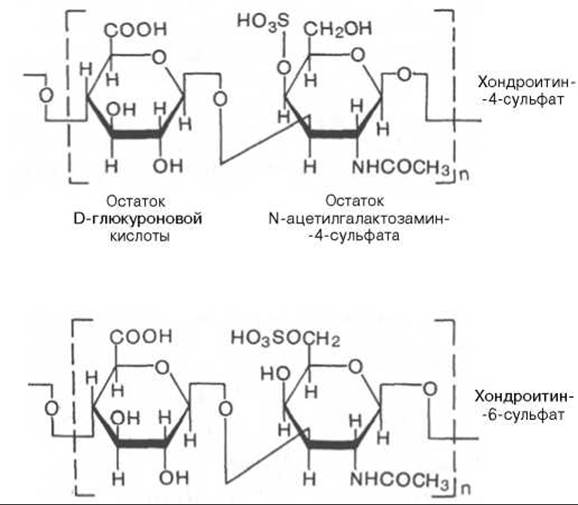
Хондроитин-4-сульфат и хондроитин-6-сульфат построены по одному плану. Отличие между ними заключается в локализации сульфатной группы. Несмотря на минимальные различия в химической структуре, физикохимические свойства хондроитин-4-сульфата и хондроитин-6-сульфата существенно различаются; последние различаются также распределением в разных видах соединительной ткани (табл. 21.3).
Таблица 21.2. Структура различных классов гликозаминогликанов
Класс гликозаминогликанов |
Компоненты, входящие в состав дисахаридных единиц |
Структура гликозаминогликанов |
Гиалуроновая кислота |
1. D-глюкуроновая кислота 2. N-ацетил-D-глюкозамин |
D-глюкуроновая кислота (ß1—>3) N- ацетилглюкозамин (ß 1—>4) D-глюкуроновая кислота (ß1—>3) N-ацетилглюкозамин (ß1—>4) ... |
Хондроитин-4-сульфат (хондроитин-сульфат А) |
1. D-глюкуроновая кислота 2. N-ацетил-D-галактозамин-4-сульфат |
D-глюкуроновая кислота (ß1—>3) N- ацетилгалактозамин-4-сульфат (ß1—>4) D-глюкуроновая кислота (ß1—>3) N- ацетилгалактозамин-4-сульфат (ß1—>4)... |
Хондроитин-6-сульфат (хондроитин-сульфат С) |
1. D-глюкуроновая кислота 2. N-ацетил-D-галактозамин-6-сульфат |
D-глюкуроновая кислота (ß1—>3) N- ацетилгалактозамин-6-сульфат (ß1—>4) D-глюкуроновая кислота (ß1—>3) N- ацетилгалактозамин-6-сульфат (ß1—>4)... |
Дерматансульфат 1 |
1. L-идуроновая кислота 2. N-ацетил-D-галактозамин-4-сульфат |
L-идуроновая кислота (ß1—>3) N-ацетилгалактозамин-4-сульфат (ß1—>4) L- идуроновая кислота (ß 1—>3) N-ацетил-галактозамин-4-сульфат (ß1—>4) ... |
Кератансульфат |
1. D-галактоза 2. N-ацетил-D-глюкозамин-6-сульфат |
D-галактоза (ß1—>4) N-ацетилглюкозамин-6-сульфат (ß1—>3) D-галактоза (ß1 —>4) N-ацетилглюкозамин-6-сульфат (ß1—>3)... |
Гепаринсульфат2 и гепарин |
1. D-глюкуронат-2-сульфат 2. N-ацетил-D-глюкозамин-6-сульфат |
D-глюкуронат-2-сульфат (a1—>4) N-ацетилглюкозамин-6-сульфат (a1—>4) D-глюкуронат-2-сульфат (ß1—>4) N-ацетилглюкозамин-6-сульфат (a1—>4) |
1 В состав дисахаридной единицы может входить D-глюкуроновая кислота.
2 Может содержать N-сульфопроизводное глюкозамина вместо N-ацетилглюкозамина и различное количество идуроновой и глюкуроновой кислот.
Таблица 21.3. Преимущественная локализация различных глюкозаминогликанов в тканях
Ткань |
Гиалуроновая кислота |
Хондроитин-4-сульфат |
Хондроитин-6-сульфат |
Дерматансульфат |
Кератан-сульфат |
Гепарин |
Кожа |
+ |
+ |
||||
Хрящ |
+ |
+ |
+ |
+ |
||
Сухожилие |
+ |
+ |
||||
Связки |
+ |
|||||
Пупочный канатик |
+ |
+ |
+ |
|||
Стекловидное тело |
+ |
|||||
Синовиальная жидкость |
+ |
|||||
Сердечные клапаны |
+ |
+ |
||||
Спинальные диски |
+ |
+ |
||||
Кость |
+ |
+ |
+ |
|||
Печень |
+ |
|||||
Легкое |
+ |
|||||
Сосудистая стенка |
+ |
|||||
Хрящ эмбриона |
+ |
+ |
+ |
|||
Роговицаглаза |
+ |
+ |
Дерматансульфат особенно характерен для дермы (кожи). Он резистентен к действию гиалуронидаз (тестикулярной и бактериальной). В этом одно из отличий дерматансульфата от хондроитинсульфатов. Кроме того, в состав дисахаридной единицы дерматансульфата входит L-идуроновая, а не D-глюкуроновая кислота (в малом количестве D-глюкуроновую кислоту можно обнаружить в повторяющихся единицах дерматансульфата):
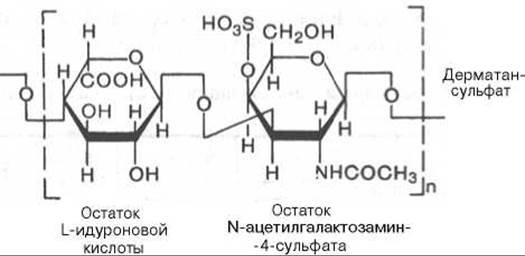
О биологической роли дерматансульфата почти ничего неизвестно. Роль этого гликозаминогликана не может быть сведена только к стабилизации коллагеновых пучков, так как дерматансульфат обнаруживается и в тканях эктодермального происхождения, не содержащих коллагена.
Кератансульфат впервые был выделен из роговой оболочки глаза быка, отсюда и название этого гликозаминогликана. В противоположность всем остальным гликозаминогликанам кератансульфат не содержит ни D-глюкуроновой, ни L-идуроновой кислоты:
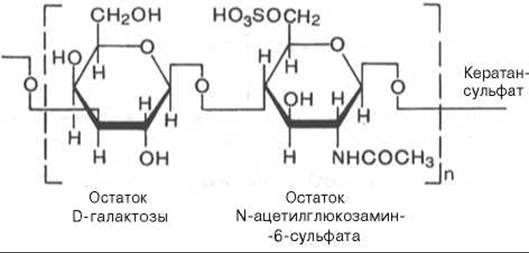
Установлено, что кератансульфат, выделенный из роговицы глаза (кератансульфат I), и кератансульфат, полученный из хрящевой ткани (кератансульфат II), различаются по степени сульфатированности и строению связи между кератансульфатом и пептидной частью протеогликана.
Гепарин известен прежде всего как антикоагулянт. Однако его следует относить к гликозаминогликанам, так как он синтезируется тучными клетками, которые являются разновидностью клеточных элементов соединительной ткани. Он может входить в состав протеогликанов; с гликозаминогликанами его объединяет и химическая структура*.
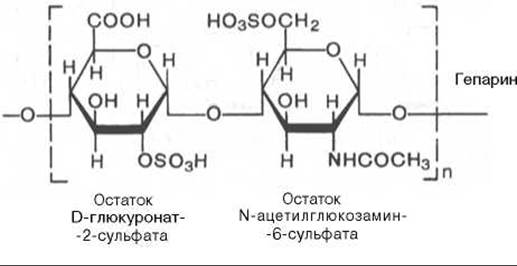
* Некоторые исследователи считают, что точная структурная формула гепарина еще неизвестна.
Гепаринсульфат в отличие от гепарина в дисахаридных единицах чаще содержит N-ацетильные группы, чем N-сульфатные. Кроме того, степень О-сульфатирования гепаринсульфата ниже, чем гепарина.
Биосинтез гликозаминогликанов. Известно, что синтез глюкозамина* и глюкуроновой кислоты, входящих в состав гиалуроновой кислоты, происходит из D-глюкозы. Непосредственные предшественники гиалуроновой кислоты — нуклеотидные (уридиндифосфонуклеотидные) производные N-ацетилглюкозамина и глюкуроновой кислоты.
Предшественником углеводных остатков сульфатированных гликозаминогликанов, как и у гиалуроновой кислоты, является молекула D-глюкозы. Далее происходит эпимеризация глюкозамина в галактозамин, а глюкуроновой кислоты при синтезе дерматансульфата — в идуроновую кислоту. Нуклеотидные производные этих соединений утилизируются при биосинтезе сульфатированных гликозаминогликанов, при этом сульфат включается в биосинтез гликозаминогликанов в виде 3'-фосфоаденозин-5'- фосфосульфата (ФАФС). В процессе биосинтеза гликозаминогликанов принимает участие большое количество различных ферментов, в том числе трансфераз.
Образование и катаболизм протеогликанов
В соединительной ткани все гликозаминогликаны находятся в соединении с белками. Термин «протеогликан» используют для обозначения веществ, в которых полипептидная и полисахаридная части молекулы соединены прочной ковалентной связью.
Примером протеогликана может служить гиалуропротеин, выделенный из синовиальной жидкости и содержащий всего 2,2—2,3% белка. У разных протеогликанов белковые компоненты различны; они не имеют ничего общего с фибриллярными белками соединительной ткани — коллагеном и эластином.
Считают, что в большинстве случаев остаток серина служит той точкой полипептидной цепи молекулы протеогликанов, к которой присоединяется гликозаминогликан.
В соединительной ткани протеогликаны образуют ряд «монтажей» последовательно возрастающей сложности, своего рода «иерархии» макромолекулярных агрегатов. Функции протеогликанов в соединительной ткани во многом определяются свойствами входящих в их состав гликозаминогликанов. Так, ионообменная активность гликозаминогликанов как полианионов обусловливает активную роль протеогликанов в распределении ряда катионов в соединительной ткани. Например, накопление кальция в очагах оссификации связано с одновременным накоплением хондроитинсульфатов, активно фиксирующих катионы кальция. Такие функции протеогликанов, как функция связывания экстрацеллюлярной воды и регуляции процессов диффузии, также в значительной мере зависят от свойств входящих в их состав гликозаминогликанов.
При помощи радиоактивных изотопов была установлена высокая скорость обмена протеогликанов. Процессы деполимеризации гликопротеиновых полимеров пока изучены мало. Из ферментов, способных гидролизовать гликозаминогликаны, наиболее изучена ß-гиалуронидаза. Последняя относится к лизосомальным ферментам. ß-Гиалуронидаза млекопитающих гидролизует ß-1,4-гликозидную связь между дисахаридными единицами гиалуроновой кислоты. В результате образуется дисахарид — глюкуроновая кислота (ß1 —>3) N-ацетилглюкозамин, который дальше гидролизуется под влиянием лизосомальной ß-гликозидазы. Хондроитин-сульфаты также способны расщепляться под влиянием ß-гиалуронидазы.
* Клетки соединительной ткани могут использоваться для биосинтеза гликозаминогликанов готовый глюкозамин.
К факторам, регулирующим метаболизм соединительной ткани, прежде всего следует отнести ферменты, гормоны и витамины.
Многие гормоны оказывают воздействие преимущественно на отдельные определенные разновидности соединительной ткани. В данном разделе рассматриваются гормональные влияния, которые носят общий характер. Так, ряд глюкокортикоидных гормонов (кортизон и его аналоги) угнетают биосинтез коллагена фибробластами, тормозят и другую важнейшую метаболическую функцию фибробластов — биосинтез гликозаминогликанов.
По-видимому, действие глюкокортикоидных гормонов на соединительную ткань не ограничивается угнетением биосинтетической активности фибробластов. Предполагают, что под их влиянием происходит активация ферментного катаболизма коллагена.
Минералокортикоидные гормоны (альдостерон, дезоксикортикостерон) надпочечников, напротив, стимулируют пролиферацию фибробластов и одновременно усиливают биосинтез «основного вещества» соединительной ткани.
Известно также, что тироксин вызывает усиленную деполимеризацию гиалуроновой кислоты, а соматотропный гормон передней доли гипофиза стимулирует включение пролина в полипептидную цепь тропоколлагена.