Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Химия сложных белков
Хромопротеины
Гемопротеины
К группе гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо- (или магний) порфирины, но различные по составу и структуре белки, обеспечивая тем самым разнообразие их биологических функций. Далее более подробно рассмотрено химическое строение гемоглобина, наиболее важного для жизнедеятельности человека и животных соединения.
Гемоглобин в качестве белкового компонента содержит глобин, а небелкового — гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина.
Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения — порфирина. Последний состоит из четырех замещенных пирролов:
соединенных между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется порфином. В молекуле гема порфин представлен в виде протопорфирина IX, содержащего четыре метильные группы (—СН3), две винильные группы (—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин, присоединяя железо, превращается в гем*.
![]()
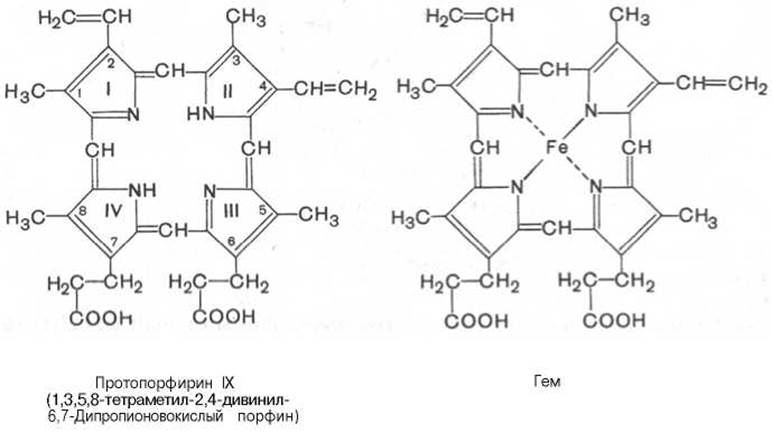
Из формулы видно, что железо связано с двумя атомами азота молекулы протопорфирина ковалентно и с двумя другими — координационными связями, обозначенными пунктирными линиями. В зависимости от химической природы групп, находящихся в боковой цепи, порфирины классифицируют на этио-, мезо-, копро- и протопорфирины. Последние наиболее распространены в природе. Из возможных 15 изомеров протопорфиринов благодаря наличию трех разных заместителей самым распространенным оказался протопорфирин IX.
Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1 (см. главу 9); в то же время в цитохромах а и a3, входящих в состав интегрального комплекса, названного цитохромоксидазой, содержится гем а, называемый также формилпорфирином:
* Структура гема расшифрована в основном благодаря работам М.В. Ненцкого и Г. Фишера.
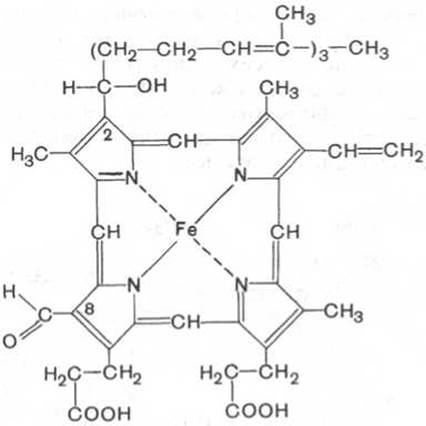
Гем а (формилпорфирин)
Гем а вместо метильной группы содержит формильный остаток (в 8-м положении) и вместо одной винильной группы (во 2-м положении) — изопреноидную цепь. Железо своими четырьмя связями образует комплекс с порфирином, а оставшиеся 5-я и 6-я координационные связи железа в молекулах гемоглобина и цитохромов связываются с белковыми компонентами по-разному. В частности, в гемоглобинах (и миоглобине) благодаря 5-й координационной связи железо соединяется с атомом азота имидазольной группы гистидина белковой молекулы. Шестая координационная связь железа предназначена для присоединения кислорода (с образованием оксигемоглобина и оксимиоглобина) или других лигандов: СО, цианидов и др. (рис. 2.1). В цитохромах, напротив, и 5-я, и 6-я координационные связи железа соединены с остатками гистидина и метионина (в цитохроме с обе винильные группы соединены еще и с остатками цистеина) белковой молекулы. Этим, вероятнее всего, могут быть объяснены функции железа в гемоглобине, валентность которого не изменяется при присоединении кислорода (в отличие от валентности железа в цитохромах): в гемоглобине железо остается двухвалентным независимо от присоединения или отдачи кислорода.
Структурная организация гемоглобина (и миоглобина) была описана в главе 1. Дж. Кендрью и М. Перутц расшифровали конформацию этих молекул (Нобелевская премия 1962 г.). Дыхательная функция гемоглобина крови подробно рассматривается в курсе физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте кислорода от легких к тканям и диоксида углерода от тканей к легким. Это элементарное проявление жизни—дыхание, хотя и выглядит простым, основано на взаимодействии многих типов атомов в гигантской молекуле гемоглобина. Подсчитано, что в одном эритроците содержится около 340000000 молекул гемоглобина, каждая из которых состоит примерно из 103 атомов С, Н, О, N, S и 4 атомов железа.
Атом железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле гемоглобина взрослого человека НbА (от англ. adult — взрослый) содержатся четыре полипептидные цепи, которые вместе составляют белковую часть молекулы — глобин. Две из них, называемые a-цепями, имеют одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие, обозначаемые ß-цепями, также идентично построены и содержат по 146 аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина состоит из 574 аминокислот. Во многих положениях а- и ß-цепи содержат разные аминокислотные последовательности, хотя и имеют почти одинаковые пространственные структуры. Получены доказательства, что в структуре гемоглобинов более 20 видов животных 9 аминокислот в последовательности оказались одинаковыми, консервативными (инвариантными), определяющими функции гемоглобинов; некоторые из них находятся вблизи гема, в составе участка связывания с кислородом, другие — в составе неполярной внутренней структуры глобулы.
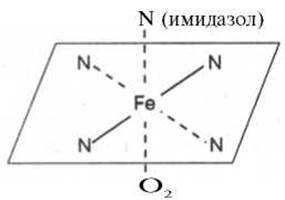
Рис. 2.1. Координационные связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом азота имидазольного кольца гистидина и с кислородом соответственно) - по разные стороны перпендикулярно к этой плоскости.
В дополнение к основному гемоглобину HbA1 в крови взрослого человека доказано существование мигрирующего с меньшей скоростью при электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц: двух a-цепей и двух 6-цепей. На долю НbА2 приходится около 2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух a-цепей и двух Y-цепей. Фетальный гемоглобин отличается от HbA1 не только составом аминокислот, но и физико-химическими свойствами: спектральным показателем, электрофоретической подвижностью, устойчивостью к щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на HbA (все же в крови взрослого человека открывается до 1,5% HbF от общего количества гемоглобина). Последовательность аминокислот в Y- и 6-цепях гемоглобинов окончательно не расшифрована.
Установление первичной структуры субъединиц молекулы гемоглобина стимулировало исследования по расшифровке структуры так называемых аномальных гемоглобинов. В крови человека в общей сложности открыто около 150 различных типов мутантных гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации генов. Обычно мутации делят на 3 класса в соответствии с топографией измененного участка молекулы. Если замена аминокислоты происходит на поверхности молекулы гемоглобина, то это мутация первого класса; подобные мутации обычно не сопровождаются развитием тяжелой патологии, и болезнь протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При замене аминокислоты вблизи гема нарушается связывание кислорода — это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем классе мутации; подобные мутации приводят к нарушению пространственной структуры и соответственно функции гемоглобина.
Аномальные гемоглобины, различающиеся по форме, химическому составу и величине заряда, были выделены при помощи электрофореза и хроматографии. Передающиеся по наследству изменения чаще всего являются результатом мутации единственного триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена кислой аминокислоты на основную или нейтральную (табл. 2.1). Поскольку это замещение осуществляется в обеих полипептидных цепях одной из пар (а или ß), образовавшийся аномальный гемоглобин будет отличаться от нормального величиной заряда и соответственно электрофоретической подвижностью.
Таблица 2.1. Замены аминокислот в аномальных гемоглобинах человека
Тип гемоглобина |
Состав пептидных цепей |
Нормальный остаток и его положение в цепи |
Замена |
А1 |
a2ß2 |
||
A2 |
a2δ2 |
||
С |
a2ß2 |
Глу 6 в ß-цепи |
Лиз |
Da |
a2ß2 |
Глу 23 в a-цепи |
? |
Dß |
a2ß2 |
Лей 28 в ß-цепи |
Глу |
Еß |
a2ß2 |
Глу 26 в ß-цепи |
Лиз |
F |
a2y2 |
||
G |
a2ß2 |
Глу 43 в ß-цепи |
Ала |
G2H |
a2β2 |
Асп 68 в a-цепи |
Лиз |
Н |
ß2 |
||
I |
a2ß2 |
Лиз 16 в a-цепи |
Асп |
M |
a2ß2 |
Вал 67 в ß-цепи |
Глу |
О |
a2ß2 |
Глу 116 в a-цепи |
Лиз |
S |
a2ß2 |
Глу 6 в ß-цепи |
Вал |
В табл. 2.1 представлены некоторые типы аномальных гемоглобинов, составы их полипептидных цепей с указанием известной или вероятной локализации замены либо в а-, либо в ß-цепях. Замены необычной аминокислотой в аномальных гемоглобинах имеют место как в а-, так и в ß-цепях. Исключение составляет гемоглобин Н, все 4 полипептида которого представлены ß-цепями, идентичными по структуре ß-цепям нормального гемоглобина A1.
Следует указать, что некоторые мутации, вызывающие существенное изменение структуры и соответственно функции гемоглобина, оказываются летальными, и индивидуумы с подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях болезнь протекает бессимптомно.
Болезни гемоглобинов (их насчитывают более 200) называют гемоглобинозами. Принято делить их на гемоглобинопатии, в основе развития которых лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии, обусловленные наследственным нарушением синтеза какой-либо нормальной цепи гемоглобина. Различают также железодефицитные анемии.

Рис. 2.2. Нормальные и серповидные эритроциты.
Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа (рис. 2.2). Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дезокси-форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в ß-цепях молекулы гемоглобина HbS (см. табл. 2.1, рис. 2.2). Это результат мутации в молекуле ДНК, кодирующей синтез ß-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НЬА:
![]()
Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственной болезни — серповидно-клеточной анемии.
Талассемии, строго говоря, не являются гемоглобинопатиями. Это генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина. Если угнетается синтез ß-цепей, то развивается ß-талассемия; при генетическом дефекте синтеза a-цепей развивается a-талассемия. При ß-талассемии в крови наряду с HbA1 появляется до 15% НbА2 и резко повышается содержание HbF — до 15—60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму. Механизм изменения формы эритроцитов объяснить пока не удалось.
В медицинской практике часто проводят анализ кровяных пигментов, который основан на исследовании спектроскопических свойств гема гемоглобина, точнее продуктов его окисления (хлорида гемина и гематина, образующихся соответственно при обработке гемоглобина уксусной кислотой в присутствии хлорида натрия или разведенными растворами щелочей). При восстановлении гематина сульфитом аммония в присутствии глобина образуется производное гемоглобина — гемохромоген, в котором денатурированный глобин соединен с гемом. Полученный комплекс имеет характерный спектр поглощения. Этот метод широко применяется в судебно-медицинской практике при исследовании кровяных пятен.
Из многообразия производных гемоглобина, представляющих несомненный интерес для врача, следует прежде всего указать на оксигемоглобин НbО2 — соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Поэтому кривая насыщения гемоглобина кислородом имеет сигмоидную форму, свидетельствующую о кооперативности связывания кислорода. Эта кооперативность обеспечивает не только связывание максимального количества кислорода в легких, но и освобождение кислорода в периферических тканях; этому способствует также наличие Н+ и СО2 в тканях с интенсивным обменом. В свою очередь кислород ускоряет высвобождение СО2 и Н+ в легочной ткани. Эта аллостерическая зависимость между присоединением Н+, О2 и СО2 получила название эффекта Бора.
Помимо кислорода, гемоглобин легко соединяется с другими газами, в частности с СО, NO и др. Так, при отравлении оксидом углерода гемоглобин прочно с ним связывается с образованием карбоксигем глобина (НbСО). При этом вследствие высокого сродства к СО гемоглобин теряет способность связывать кислород и наступает смерть от удушья, недостаточного снабжения тканей кислородом. Однако при быстром повышении парциального давления кислорода во вдыхаемом воздухе можно добиться частичного вытеснения СО из связи с гемоглобином и предотвратить летальный исход.
При отравлении оксидами азота, парами нитробензола и другими соединениями часть гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо. Метгемоглобин также теряет способность к переносу кислорода от легких к тканям, поэтому при метгемоглобинемии (вследствие отравления окислителями) в зависимости от степени отравления может наступить смерть от недостатка кислорода. Если вовремя оказать помощь, т.е. повысить парциальное давление кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести больного из опасного состояния.
Следует отметить, что самым надежным методом качественного определения различных производных гемоглобина является исследование их спектров поглощения.
У беспозвоночных роль переносчика кислорода часто выполняют пигменты негеминовой природы — гемэритрин и гемоцианин. Они не относятся к гемсодержащим хромопротеинам, хотя в их названиях содержится корень «гем». Эти белки, как и гемоглобин, несмотря на то что выполняют одну и ту же функцию, сильно различаются между собой по молекулярной массе и четвертичной структуре, химической природе активного центра, характеру связывания железа (гемэритрин) и меди (гемоцианин) с кислородом и др. (табл. 2.2).
Таблица 2.2. Некоторые свойства белков-переносчиков кислорода (по Г. Эйхгорну)
Свойства |
Гемоглобин |
Гемэритрин |
Гемоцианин |
Металл |
Fe |
Fe |
|
Степень окисления металла в дезоксигенированном белке |
II |
II |
I |
Стехиометрия взаимодействия с кислородом |
Fe:O2 |
2Fe:O2 |
2Сu:О2 |
Цвет оксигенированного белка |
Красный |
Розово-фиолетовый |
Синий |
Цвет дезоксигенированного белка |
Пурпурно красный |
Бесцветный |
Бесцветный |
Способ связи железа или меди с белком |
Порфириновое кольцо |
Радикалы аминокислотных остатков |
Радикалы аминокислотных остатков |
Молекулярная масса |
65000 |
108000 |
400000 20000000 |
Число субъединиц |
4 |
8 |
Много |
Трансферрины (сидерофилины) — группа сложных белков, полученных из разных источников и характеризующихся способностью специфично, прочно и обратимо связывать ионы железа Fe (III) и других переходных металлов. Наиболее подробно из этой группы белков изучен трансферрин сыворотки крови. Функция трансферрина заключается в транспорте ионов железа в ретикулоциты, в которых осуществляется биосинтез гемоглобина. Система трансферрин — ретикулоцит считается весьма перспективной для изучения взаимодействия металла с белком и белковой молекулы с клеткой.