Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Ферменты
Краткая история развития учения о ферментах
Активный центр ферментов
При изучении механизма химической реакции, катализируемой ферментами, исследователя всегда интересует не только определение промежуточных и конечных продуктов и выяснение отдельных стадий реакции, но и природа тех функциональных групп в молекуле фермента, которые обеспечивают специфичность действия фермента на данный субстрат (субстраты) и высокую каталитическую активность. Речь идет, следовательно, о точном знании геометрии и третичной структуры фермента, а также химической природы того участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Участвующие в ферментативных реакциях молекулы субстратов часто имеют небольшие размеры по сравнению с молекулами ферментов, поэтому было высказано предположение, что при образовании фермент-субстратных комплексов в непосредственный контакт с молекулой субстрата, очевидно, вступает ограниченная часть аминокислот пептидной цепи. Отсюда возникло представление об активном центре фермента. Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 4.2). Установлено, что у сложных ферментов в состав активного центра входят также простетические группы.
В активном центре условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную («якорную») площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. В свою очередь молекула субстрата также содержит функционально различные участки: например, субстраты эстераз или протеиназ — одну специфическую связь (или группу атомов), подвергающуюся атаке со стороны фермента, и один или несколько участков, избирательно связываемых ферментом.
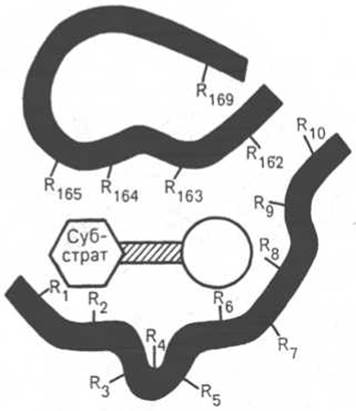
Рис. 4.2. Активный центр фермента (схема) (по Малеру и Кордесу).
Темные полосы - участки полипептидной цепи фермента; R - аминокислотные остатки и их порядковые номера (с N-конца).
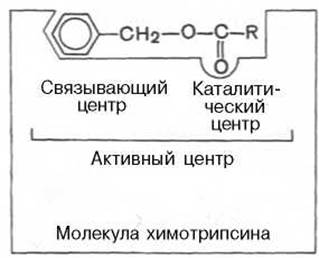
Получены экспериментальные доказательства наличия в активном центре химотрипсина двух остатков гистидина и остатка серина, схематически представленных в трехмерной структурной модели предшественника этого фермента (рис. 4.3). Выявление химической природы и вероятной топографии групп активного центра — проблема первостепенной важности. Она сводится к определению природы аминокислот, их последовательности и взаиморасположения в активном центре. Для идентификации так называемых существенных аминокислотных остатков используют специфические ингибиторы ферментов (часто это субстратподобные вещества или аналоги коферментов), методы «мягкого» (ограниченного) гидролиза в сочетании с химической модификацией, включающей избирательное окисление, связывание, замещение остатков аминокислот и др.
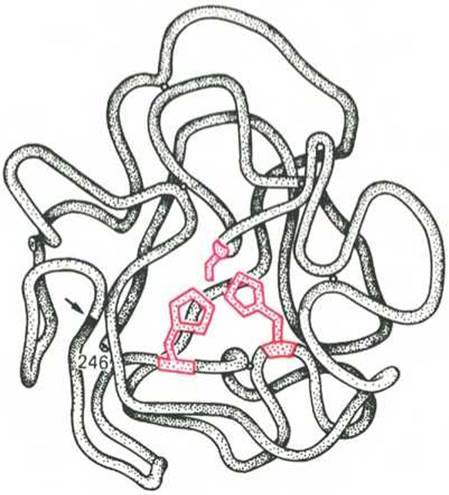
Рис. 4.3. Гипотетическая модель третичной структуры молекулы предшественника химотрипсина (по Нейрату).
Цветом выделены остатки серина и гистидина; стрелкой обозначено место отщепления N-концевого участка полипептидной цепи.
При помощи методов ингибиторного анализа были предприняты попытки установить закономерности состава и структуры активных центров у ферментов, относящихся к разным группам. В частности, при использовании диизопропилфторфосфата (ДФФ), принадлежащего к так называемым нервным ядам, наблюдается полное выключение активного центра холинэстеразы — фермента, катализирующего гидролиз ацетилхолина на холин и уксусную кислоту. Оказалось, что этот ингибитор имеет близкое структурное сходство с ацетилхолином и подобно ему взаимодействует с ОН-группой остатка серина в активном центре. Вызывая фосфорилирование серина в активном центре ряда других ферментов, ДФФ также инактивирует их действие:
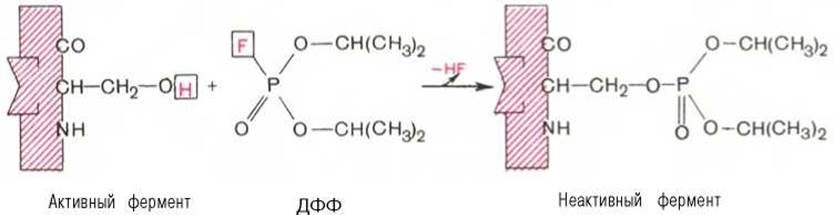
Показано, что ДФФ избирательно фосфорилирует в каждом чувствительном к нему ферменте только один остаток серина, наделенный функциональной активностью. Учитывая этот механизм действия ДФФ, сделаны попытки определения природы аминокислот в окружении «каталитического» остатка серина у ряда ферментов (табл. 4.2).
Из данных табл. 4.2 видно, что ферменты, сходные по типу действия, хотя и различаются специфичностью, могут иметь почти одинаковую последовательность аминокислотных остатков в тех участках, которые примыкают к остатку серина, несущему функционально активную гидроксильную группу. Существенное значение ОН-группы серина для акта катализа было доказано, кроме того, химическим ее блокированием или удалением, когда эстеразы полностью лишались ферментативной активности.
Таблица 4.2. Последовательность аминокислотных остатков, расположенных вокруг серина в молекулах ряда эстераз и протеиназ (по Малеру и Кордесу)
Фермент |
Последовательность остатков аминокислот вокруг серина |
Химотрипсин |
—Гли—Асп—Сер—Гли—Гли— |
Трипсин |
—Гли—Асп—Сер—Гли—Про—Вал— |
Тромбин |
—Асп—Сер—Гли— |
Эластаза |
—Асп—Сер—Гли— |
Бутирилхолинэстераза |
—Гли—Глу—Сер—Ала— |
Ацетилхолинэстераза |
—Глу—Сер—Ала— |
Алиэстераза печени |
—Гли—Глу—Сер—Ала—Гли—Гли— |
Щелочная фосфатаза (E. coli) |
—Тре—Асп—Сер—Ала—Сер—Ала— |
Субтилизин (В. subtilis) |
—Гли—Тре—Сер—Мет—Ала— |
Протеаза (Aspergillius orizae) |
—Тре—Сер—Мет—Ала— |
Фосфоглюкомутаза |
—Тре—Ала—Сер—Гис—Асп— |
Фосфорилаза |
—Глн—Иле—Сер—Вал—Арг— |
Предполагают, что формирование активного центра фермента начинается уже на ранних этапах синтеза белка-фермента (см. главу 14) на рибосоме, когда линейная одномерная структура пептидной цепи превращается в трехмерное тело строго определенной конфигурации. Образовавшийся белок приобретает информацию совершенно нового типа, а именно функциональную (в частности, каталитическую). Любые воздействия, приводящие к денатурации, т.е. нарушению третичной структуры, приводят к искажению или разрушению структуры активного центра и соответственно потере ферментом каталитических свойств. Если при подходящих внешних условиях удается восстановить нативную трехмерную структуру белка-фермента (ренатурировать его), то восстанавливается и его каталитическая активность. Это было показано впервые на примере рибонуклеазы поджелудочной железы (см. рис. 1.13).
Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos — другой, иной и steros — пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзиматической активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов*.
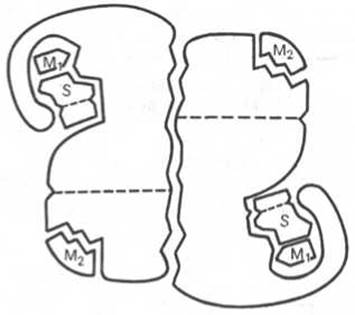
Рис. 4.4. Схематическое изображение аллостерического фермента, состоящего из двух протомеров, соединенных по типу гетерологической («голова»-«хвост») ассоциации (по Кошленду).
S — субстрат; М1 — модификатор, связывающийся в активном центре; М2 — модификатор, связывающийся в аллостерическом центре (эффектор).
Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте каждый из двух симметрично построенных протомеров содержит один активный центр, связывающий субстрат S, и один аллостерический центр, связывающий эффектор М2, т.е. 2 центра в одной молекуле фермента (рис. 4.4). Получены доказательства, что для субстрата аллостерические ферменты, помимо активного центра, содержат и так называемые эффекторные центры; при связывании с эффекторным центром субстрат не подвергается каталитическому превращению, однако он влияет на каталитическую эффективность активного центра. Подобные взаимодействия между центрами, связывающими лиганды одного типа, принято называть гомотропными взаимодействиями, а взаимодействия между центрами, связывающими лиганды разных типов, — гетеротропными взаимодействиями.
Таким образом, приведенные сведения о химической природе активного центра и аллостерических участках свидетельствуют о том, что в энзиматическом катализе, как и в реакции связывания субстрата, участвует не ограниченная и небольшая часть фермента, как предполагалось ранее, а значительно большая часть молекулы белка-фермента. Этими обстоятельствами, вероятнее всего, можно объяснить большие размеры и объемность трехмерной структуры молекулы фермента; эти же обстоятельства следует учитывать в программах создания искусственных низкомолекулярных аналогов ферментов (синзимов), обладающих свойствами нативных ферментов (см. ранее).
* Ряд авторов рекомендуют пользоваться термином «регуляторный центр» (регуляторный фермент) для ферментов, обладающих регуляторными функциями, поскольку в этом случае якобы отпадает необходимость уточнения наличия на поверхности фермента особого центра для связывания эффектора.