БИОХИМИЯ - В. В. Емельянов - 2016
РАЗДЕЛ 3. ОБМЕН УГЛЕВОДОВ
3.1. Биологическая роль углеводов
Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящими в состав живых организмов. У человека и животных углеводы выполняют важные функции:
- энергетическую (главный вид клеточного топлива). На их долю приходится более 50 % от суточного количества необходимых калорий. В энергетическом обмене главная роль принадлежит глюкозе и гликогену;
- структурную (обязательный компонент большинства внутриклеточных структур). К ним относятся пентозы нуклеотидов и нуклеиновых кислот, углеводы гликопротеинов и гликолипидов. В виде гликозаминогликанов углеводы входят в состав межклеточного матрикса;
- защитную (иммуноглобулины, участвующие в поддержании иммунитета, содержат углеводную компоненту). Глюкурониды участвуют в процессах детоксикации эндогенных ядов и ксенобиотиков;
- из углеводов в организме могут синтезироваться соединения других классов, в частности, липиды и некоторые аминокислоты.
Таким образом, углеводы, помимо основной энергетической, выполняют многообразные функции, каждая из которых жизненно важна для организма.
3.2. Переваривание и всасывание углеводов
Обмен (метаболизм) углеводов в организме человека начинается с расщепления в пищеварительном тракте поступающих с пищей полисахаридов и дисахаридов до моносахаридов и всасывания моносахаридов из кишечника в кровь.
При переваривании углеводов в желудочно-кишечном тракте происходит ферментативный гидролиз гликозидных связей и образование моносахаридов, главным из которых является глюкоза. Гидролиз крахмала начинается в полости рта при участии амилазы слюны, которая частично расщепляет внутренние а-1,4-гликозидные связи, образуя менее крупные, чем крахмал, молекулы - декстрины. Далее гидролиз крахмала продолжается в верхнем отделе кишечника под действием панкреатической амилазы, также расщепляющей α-1,4-гликозидные связи. В результате из крахмала образуются дисахаридные остатки мальтозы и изомальтозы. Гидролиз всех дисахаридов происходит на поверхности клеток тонкой кишки и катализируется специфическими ферментами: сахаразой, лактазой, мальтазой и изомальтазой.
Всасывание моносахаридов из кишечника в кровь осуществляется путем облегченной диффузии. Если концентрация глюкозы в кишечнике невелика, то ее транспорт может происходить за счет градиента концентрации ионов натрия, создаваемого Na+, K+-AТФ-азой.
Поступающая из просвета кишечника глюкоза с кровью воротной вены попадает в печень, где часть ее задерживается, а часть через общий кровоток транспортируется в другие органы и ткани.
Транспорт глюкозы из крови в клетки регулируется гормоном поджелудочной железы - инсулином. Действие инсулина приводит к перемещению белков-переносчиков из цитозоля клетки в плазматическую мембрану. Затем с помощью этих белков глюкоза поступает в клетку по градиенту концентрации.
Исключение составляют мозг и печень. Скорость поступления глюкозы в клетки этих органов не зависит от инсулина и определяется только концентрацией ее в крови. Эти ткани называются инсулинонезависимыми.
3.3. Метаболизм глюкозы
Глюкоза играет главную роль в метаболизме, так как именно она является основным источником энергии.
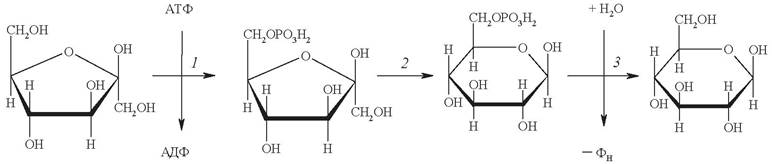
Превращения глюкозы в клетке начинаются с образования глюкозо-6-фосфата за счет переноса концевого остатка фосфата АТФ в положение 6 глюкозы (рис. 12). Поскольку образование глюкозо-6-фосфата происходит за счет разрыва макроэргической связи в молекуле АТФ, то реакция фактически необратима. Реакцию катализирует фермент гексокиназа, присутствующий почти во всех животных, растительных и бактериальных клетках.
Рис. 12. Реакция фосфорилирования глюкозы
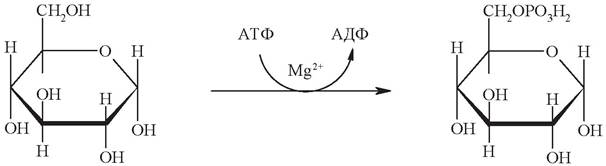
Гексокиназная реакция имеет важное биологическое значение. Глюкозо-6-фосфат, в отличие от самой глюкозы, не может проникать через клеточную мембрану, тем самым глюкоза «запирается» в клетке. Это создает условия для дальнейшего метаболизма глюкозы, поступившей в клетку.
С другой стороны, фосфорилирование глюкозы «расшатывает» симметричную и устойчивую циклическую форму глюкозы, делая ее более реакционноспособной. Тем самым облегчаются ее последующие преобразования.
Реакция фосфорилирования является ключевым звеном всего метаболизма глюкозы, выполняя лимитирующую и регуляторную функцию.
Лимитирующая роль гексокиназы обусловлена ее кинетическими свойствами. Фермент обладает исключительно высоким сродством к глюкозе (Км < 0,1 мМ), т. е. Ʋmaxдостигается при низкой концентрации глюкозы. Скорость всех дальнейших метаболических превращений глюкозы не может превышать Ʋmax гексокиназной реакции.
Единственное исключение - клетки печени, в которых наряду с гексокиназой есть еще ее изофермент глюкокиназа, обладающий в 1000 раз большим значением Км. Это значит, что насыщение глюкокиназы происходит только при высокой концентрации глюкозы.
Эти различия в свойствах ферментов объясняют, почему в период пищеварения глюкоза задерживается в основном в печени. После приема пищи содержание глюкозы в воротной вене резко возрастает: в тех же пределах увеличивается и ее внутрипеченочная концентрация. Глюкокиназа при высокой концентрации глюкозы в этот период максимально активна, что приводит к увеличению поглощения глюкозы печенью. Напротив, гексокиназа, обладая большим сродством к глюкозе, способна выхватывать ее из общего кровотока, где концентрация глюкозы ниже.
Регуляторная роль гексокиназы реализуется по принципу обратной связи. Продукт реакции глюкозо-6-фосфат является аллостерическим ингибитором своего фермента. Если дальнейшая утилизация глюкозо-6-фосфата уменьшается, то накапливающийся его избыток тормозит гексокиназу, замедляя использование новых порций поступающей глюкозы. Глюкокиназа избытком глюкозо-6-фосфата не угнетается.
Гексокиназная реакция лежит на перекрестке всех путей превращения углеводов (рис. 13).
Рис. 13. Пути превращения глюкозо-6-фосфата в печени
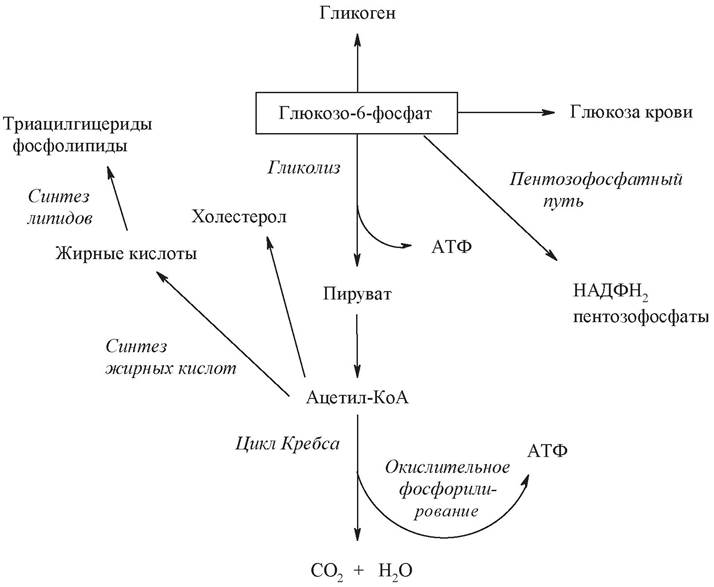
Основные пути метаболизма глюкозы:
- катаболизм глюкозы - гликолиз;
- синтез глюкозы - глюконеогенез;
- синтез и распад гликогена;
- синтез пентоз - пентозофосфатный путь.
- превращение глюкозы в жирные кислоты и холестерол.
3.3.1. Гликолиз
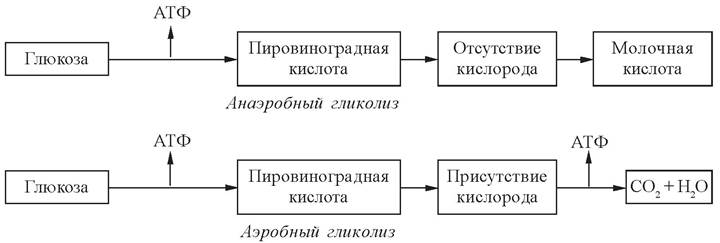
Гликолиз (от греч. glycys - сладкий и lysis - распад) - процесс окисления глюкозы, в результате которого происходит расщепление глюкозы с образованием 2 молекул пирувата (аэробный гликолиз) или 2 молекул лактата (анаэробный гликолиз). При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат.
Гликолиз - один из центральных путей катаболизма глюкозы не только в животных и растительных клетках, но также у многих микроорганизмов.
Биологическое значение гликолиза состоит в том, что это основной путь расщепления глюкозы до конечных продуктов СО2 и Н2О. Именно этот путь поставляет
клетке преобладающую долю АТФ - до 60-70 % при обычном пищевом рационе человека. Все десять реакций гликолиза протекают в цитозоле клетки и характерны для всех органов и тканей. Последовательность реакций гликолиза приведена на рис. 14.
Рис. 14. Схема реакций гликолиза
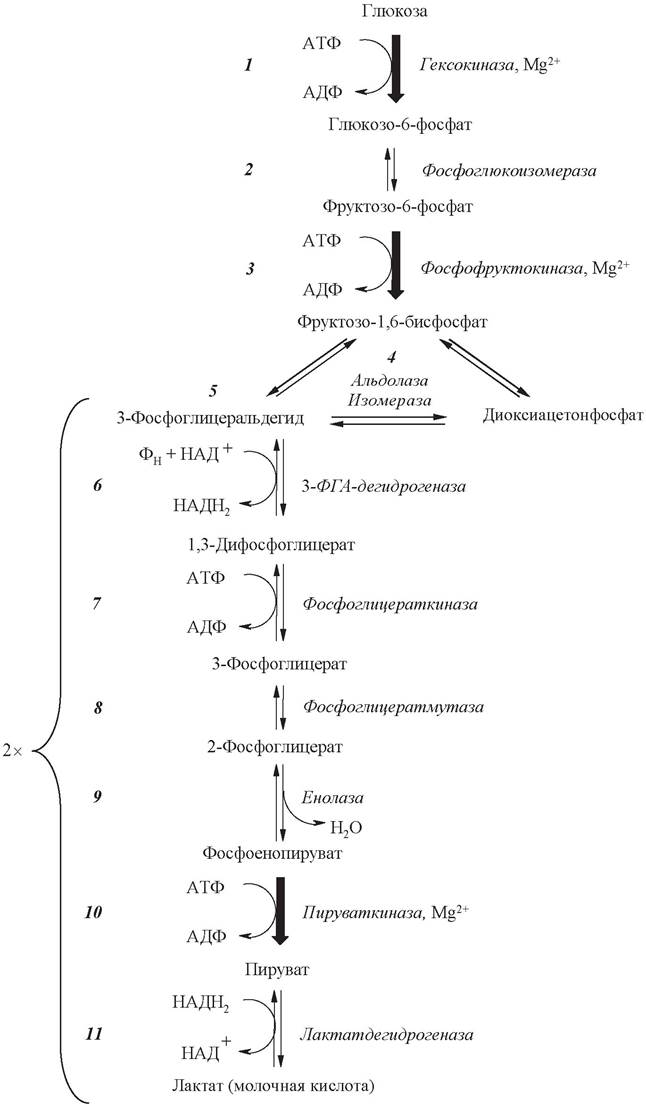
Первой реакцией гликолиза является рассмотренная выше АТФ-зависимая реакция фосфорилирования глюкозы до глюкозо-6-фосфата.
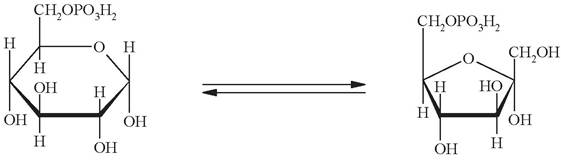
Вторая стадия - обратимая изомеризация глюкозо-6-фосфата во фруктозо-6-фосфат, катализируемая фосфоглюкоизомеразой:
Образовавшийся фруктозо-6-фосфат на третьей стадии фосфорилируется до фруктозо-1,6-дифосфата. Подобно гексокиназной, эта реакция необратима и является наиболее медленной реакцией гликолиза:
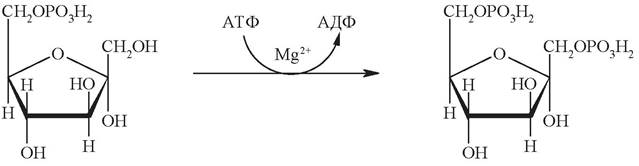
Фермент фосфофруктокиназа, катализирующий эту стадию, является важным ключевым ферментом гликолиза. Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ. При увеличении отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце концентрация АТФ относительно высокая, соответственно активность фосфофруктокиназы низкая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
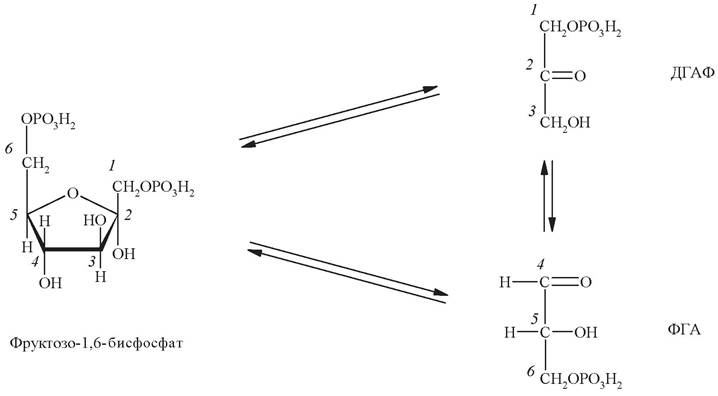
Четвертая стадия заключается в расщеплении фруктозо-1,6-дифосфата ровно пополам на две фосфотриозы. Эту обратимую реакцию катализирует альдолаза фруктозобисфосфата. Продукты реакции 3-фосфоглицеральдегид (ФГА) и дигидроксиацетонфосфат (ДГАФ) изомерны друг другу:
Пятую стадию обеспечивает фермент триозофосфатизомераза, ускоряющий превращение дигидроксиацетонфосфата в 3-фосфоглицеральдегид. В равновесном состоянии доля фосфоглицеральдегида не более 5 %. Однако в дальнейших реакциях используется именно этот изомер. Поэтому фактически триозофосфатизомераза обеспечивает достаточно быстрое восполнение 3-фосфоглицеральдегида по мере его убыли (т. е. катализирует реакцию, по существу, в одном направлении). На этом завершается первый этап гликолиза.
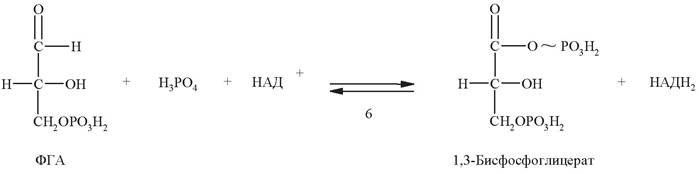
Шестая стадия - окисление альдегидной группы 3-фосфоглицеральдегида под действием 3-фосфоглицеральдегид-дегидрогеназы. Обычно окисление альдегидной группы происходит путем присоединения молекулы воды с последующим отнятием 2 атомов водорода, вследствие чего альдегидная группа превращается в карбоксильную. Однако при окислении 3-фосфоглицеральдегида специфика НАД+- зависимой дегидрогеназы обеспечивает использование не воды, а фосфорной кислоты. В результате образующаяся карбоксильная группа сразу же оказывается связанной с фосфатным остатком. Возникшая смешанная ангидридная связь является макроэргической:
Седьмая стадия представляет собой реакцию субстратного фосфорилирования. За счет энергии, выделяющейся при гидролизе макроэргической связи в 1,3- дифосфоглицерате происходит перенос отщепляемого фосфатного остатка на АДФ и образование молекулы АТФ. Эта реакция обратима. Фермент, катализирующий эту реакцию, называется фосфоглицераткиназа (по обратной реакции).
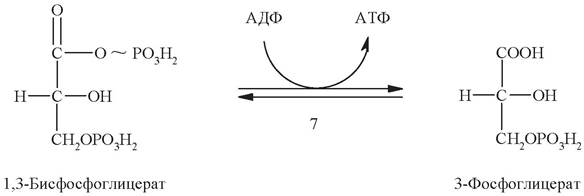
Далее под действием фермента фосфоглицератмутазы 3-фосфоглицерат изомеризуется в 2-фосфоглицерат:
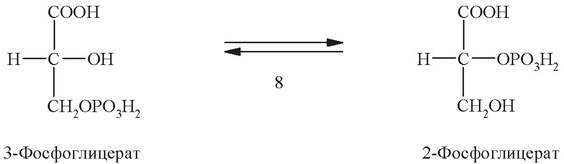
Девятая стадия - дегидратация 2-фосфоглицерата. Эту обратимую реакцию катализирует фермент енолаза:
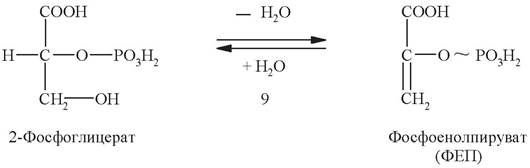
Результатом является образование сложного эфира фосфорной кислоты и енольной формы пирувата, называемого фосфоенолпируватом. Фосфоенолпируват содержит макроэргическую связь. Энергия, выделяющаяся при гидролизе этой связи, используется на следующей стадии для синтеза АТФ.
Десятая стадия является реакций субстратного фосфорилирования. Катализирует ее пируваткиназа:
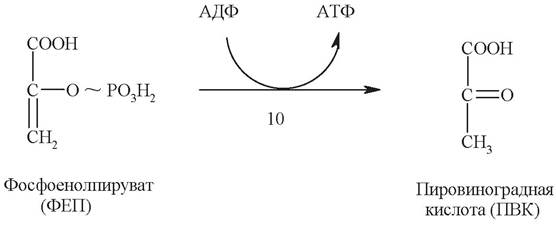
Перенос фосфатного остатка с молекулы фосфоенолпирувата на АДФ (с образованием АТФ) приводит, однако, к освобождению не енолпирувата, а его более стабильного кето-изомера - пирувата. Это делает пируваткиназную реакцию необратимой, энергетически подкрепляя ее.
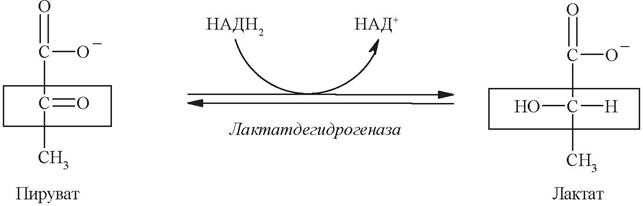
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат:
Подводя итог рассмотрению химизма процесса гликолиза, остановимся еще раз на его основных особенностях.
1. В гликолизе независимо от того, протекает он по анаэробному или аэробному пути, можно выделить два основных этапа.
Реакции 1-5 составляют первый этап гликолиза, суть которого - превращение стабильной молекулы глюкозы в две молекулы более реакционноспособного фосфоглицеральдегида. На этом этапе гликолиза расходуются две молекулы АТФ.
Второй этап гликолиза включает реакции, приводящие к превращению фосфоглицеральдегида в пируват или лактат (соответственно реакции 6-10 или 6-11). Эти реакции связаны с синтезом АТФ;
2. Большинство гликолитических реакций обратимо, за исключением трех (реакции 1, 3 и 10);
3. Все промежуточные соединения находятся в фосфорилированной форме. Источником фосфатной группы в реакциях фосфорилирования являются АТФ (реакции 1, 3) или Н3РО4 (реакция 6);
4. Регенерация НАД+, необходимого для окисления новых молекул фосфоглицеральдегида, происходит при аэробном гликолизе посредством дыхательной цепи. При этом водород транспортируется из цитозоля в митохондрии с помощью челночного механизма.
При анаэробном гликолизе НАД+ регенерируется в реакции восстановления пирувата в лактат, сопряженного с окислением НАДН2.
5. Образование АТФ при гликолизе может идти двумя путями: либо субстратным фосфорилированием, когда для образования АТФ из АДФ и Н3РО4 используется энергия макроэргической связи субстрата (реакции 7, 9), либо путем окислительного фосфорилирования за счет энергии переноса электронов и протонов в дыхательной цепи.
3.3.2. Расчет выхода АТФ при анаэробном окислении глюкозы
Клетки, недостаточно снабжаемые кислородом, могут частично или полностью существовать за счет энергии гликолиза. В анаэробных условиях гликолиз
является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата. На рис. 15 показаны участки гликолиза, на которых расходуется и образуется АТФ.
Рис. 15. Участки гликолиза, связанные с затратой и образованием АТФ в анаэробных условиях
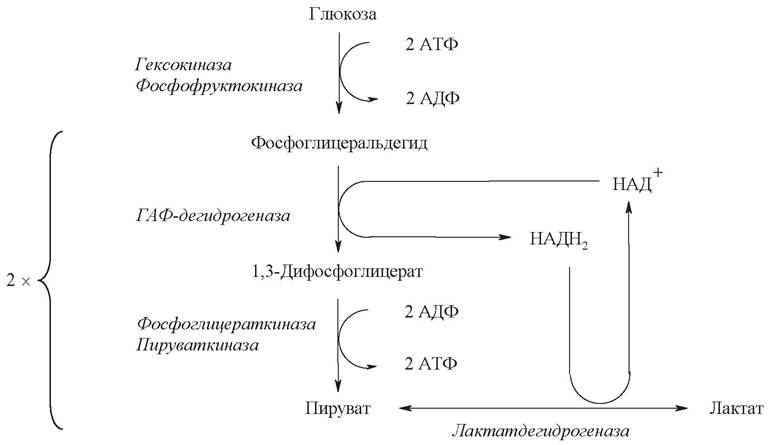
2 молекулы АТФ потребляются на активацию одной молекулы глюкозы (реакции 1 и 3).
В результате превращений каждого из двух С3-фрагментов в реакциях субстратного фосфорилирования (реакции 7 и 10) образуются 2 молекулы АТФ.
НАДН2, который образуется в ходе окисления фосфоглицеральдегида на пятой стадии, окисляется в лактатдегидрогеназной реакции с образованием молочной кислоты и в получении АТФ не участвует.
Таким образом, выигрыш энергии в анаэробных условиях составляет 2 моль АТФ на моль глюкозы:
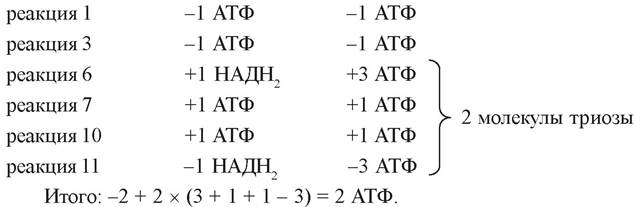
3.3.3. Расчет выхода АТФ при аэробном окислении
Большинство животных и растительных клеток в норме находится в аэробных условиях, и глюкоза полностью окисляется до СО2 и Н2О.
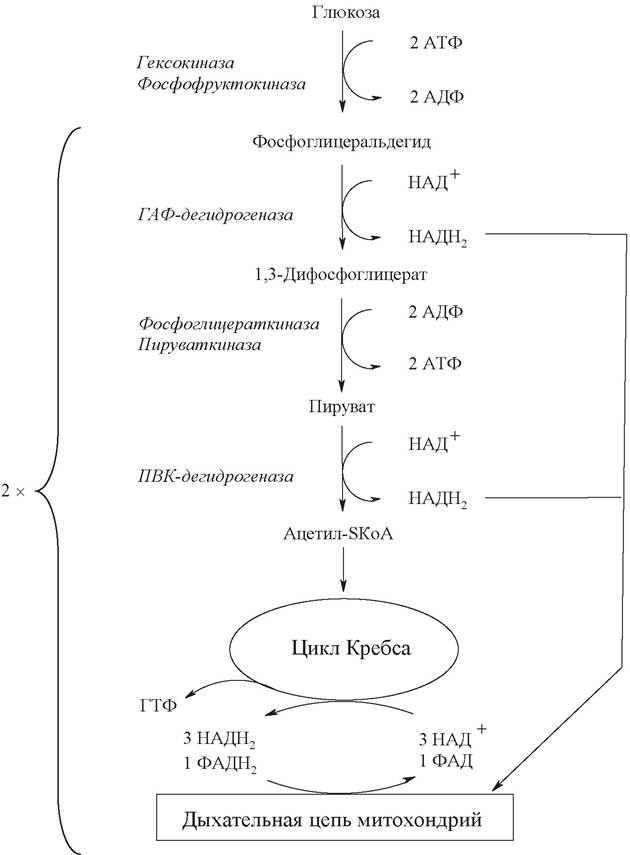
При наличии в клетке кислорода НАДН2, возникающий на 6-й стадии, направляется в митохондрии на процесс окислительного фосфорилирования. Там его окисление сопровождается синтезом 3 молекул АТФ.
Образовавшийся в гликолизе пируват в аэробных условиях под действием пируватдегидрогеназного комплекса превращается в ацетил-SКоА, при этом образуется 1 молекула НАДН2.
Ацетил-SКоА вовлекается в цикл Кребса и, окисляясь, дает 3 молекулы НАДН2, 1 молекулу ФАДН2 и 1 молекулу ГТФ. При окислении НАДН2 и ФАДН2 в дыхательной цепи образуется еще 11 молекул АТФ. В целом при сгорании 1 ацетильного остатка образуется 12 молекул АТФ.
Суммируя «гликолитический» АТФ, результаты окисления «гликолитического» и пируватдегидрогеназного НАДН2, энергетический выход цикла Кребса и умножая все на 2, получаем 38 молекул АТФ:

Очевидно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз (рис. 16).
Рис. 16. Участки аэробного окисления глюкозы, связанные с затратой и образованием АТФ
Однако мембрана митохондрий непроницаема для НАДН2, поэтому перенос водорода с цитозольного НАДН2 в митохондрии осуществляется за счет челночного транспорта. Суть этого механизма сводится к тому, что НАДН2 в цитозоле восстанавливает некоторое соединение, способное проникать в митохондрию. В митохондрии это соединение окисляется, восстанавливая внутримитохондриальный НАД+, и вновь переходит в цитозоль. В качестве челнока работает глицеролфосфатный механизм или малат-аспартатная система (рис. 17, 18).
Рис. 17. Глицеролфосфатный челнок: 1, 2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на дыхательную цепь; 3 - ФАД-зависимая глицеролфосфатдегидрогеназа
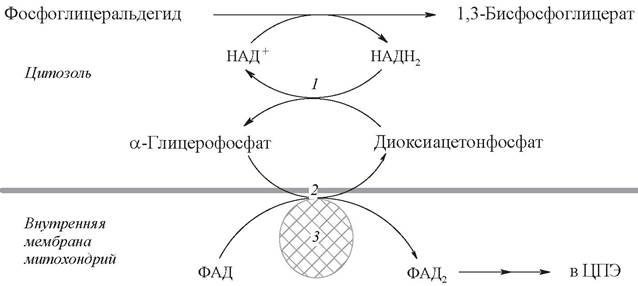
Рис. 18. Малат-аспартатный челнок: 1,2 - окислительно-восстановительные реакции, обеспечивающие транспорт водорода из цитозоля в митохондрии на дыхательную цепь; 3,4 - транслоказы, обеспечивающие транспорт малата, аспартата и глутамата через мембрану митохондрий
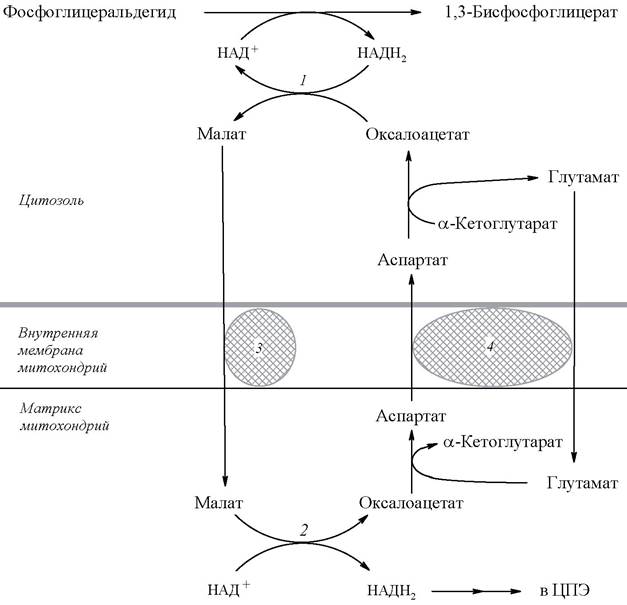
Если перенос водорода с НАДН2 происходит за счет глицеролфосфатного механизма, то реальное количество синтезируемых молекул АТФ меньше, так как энергия расходуется на транспорт НАДН2 из цитозоля через митохондриальную мембрану. Цитозольный НАДН2 сначала реагирует с цитозольным дигидроксиацетонфосфатом, образуя глицерол-3-фосфат, который легко проникает через мембрану митохондрии. Внутри митохондрии глицерол-3-фосфат окисляется до диоксиацетонфосфата с участием не НАД, а ФАД-зависимой глицерол-3-фосфат-дегидрогеназы. Восстановленный флавопротеин (фермент-ФАДН2) вводит приобретенные им электроны в дыхательную цепь на уровне KoQ. Таким образом, пара электронов (из одной молекулы цитозольного НАДН2), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ и общий энергетический выход составляет не 38, а 36 молекул АТФ.
С помощью данного челночного механизма перенос восстановленных эквивалентов от цитозольного НАДН2 в митохондрии осуществляется лишь в скелетных мышцах и мозге.
В клетках печени, почек и сердца действует более сложная малат-аспартатная челночная система (см. рис. 18).
Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и аспартатаминотрансферазы как в цитозоле, так и в митохондриях. Цитозольный НАДН2 восстановливает оксалоацетат до малата при участии фермента малатдегидрогеназы.
Малат с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембрану митохондрии в матрикс. Здесь малат за счет внутримитохондриального НАД+ окисляется в оксалоацетат, а восстановленный НАДН2 передает свои электроны в цепь дыхательных ферментов.
В свою очередь, образовавшийся оксалоацетат в присутствии глутамата и фермента АСТ вступает в реакцию трансаминирования. Образующиеся аспартат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий. Трансаминирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл.
В целом процесс включает легкообратимые реакции, происходит без потребления энергии, в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ.
При переходе от анаэробных условий к аэробным накопление лактата в клетке прекращается в связи с его окислением в пируват. Первым это явление отметил Л. Пастер, сформулировав тезис о том, что с началом дыхания (т. е. потребления кислорода) брожение останавливается. Он определял брожение как жизнь без доступа кислорода.
Механизм эффекта Пастера (блокирование брожения дыханием, сопровождаемое резким падением скорости утилизации глюкозы) объясняется тем, что в присутствии кислорода НАДН2 и пируват сразу после их образования утилизируются митохондриями. При переключении на аэробное окисление происходит убыль ранее накопленного лактата. Утилизация лактата, накопившегося в период дефицита кислорода, лежит в основе явления, которое получило название «ликвидация кислородной задолженности». Суть этого явления состоит в том, что после интенсивной мышечной работы легочное дыхание не сразу возвращается к норме, а некоторое время остается усиленным. Избыточное потребление кислорода в этот период определяется количеством лактата, накопившегося во время работы, недостаточно обеспеченной кислородом.
Таким образом, в отсутствие или при недостатке кислорода лактат не может не образоваться, а при достаточном снабжении кислородом он не может образоваться (рис. 19).
Рис. 19. Схемы аэробного и анаэробного гликолиза
В ряде случаев выработка лактата может происходить в аэробных условиях. В частности, он может образовываться в аэробных условиях в злокачественных опухолях. Причины отсутствия эффекта Пастера в раковых клетках до сих пор не выяснены. Эритроциты также вырабатывают лактат в обычных аэробных условиях. Это связано с отсутствием митохондрий в этих клетках и, как следствие, невозможностью утилизации восстановленных коферментов и пирувата. Поэтому эритроциты обеспечивают себя энергией только за счет двух молекул АТФ, образующихся в реакции субстратного фосфорилирования (7-я стадия).
Вопросы для проверки усвоения материала
1. Углеводы: определение, классификация, биологическое значение. Моносахариды: классификация, важнейшие представители, химические свойства. Изомерия моносахаридов (на примере глюкозы и фруктозы), биологическое значение.
2. Дисахариды и полисахариды: важнейшие представители, химические свойства, биологическое значение.
3. Пути обмена глюкозо-6-фосфата в клетке: гликолиз, глюконеогенез, пентозофосфатный путь, синтез гликозаминогликанов, синтез и распад гликогена, сущность и биологическое значение.
4. Реакции гликолиза, ферменты, регуляция. Аэробный и анаэробный гликолиз, энергетический баланс. Брожение, сходство с гликолизом и отличие от него.
5. Пути обмена пировиноградной и молочной кислот в различных тканях, цикл Кори. Связь обмена углеводов с циклом Кребса, обменом липидов и аминокислот. Роль гормонов и нервной системы в регуляции углеводного обмена.
Письменное домашнее задание
Обязательное
1. Напишите структурные формулы 4 циклических форм D-рибозы и ее производных - спирта D-рибитола, D-рибоновой кислоты и D-2-дезоксирибозы. Какие
типы реакций приводят к образованию указанных соединений? Каково биологическое значение рибозы и дезоксирибозы?
2. Рафиноза - α-D-галактопиранозил-(1 —> 6)-α-D-глюкопиранозил-(1 —> 2)-β-D- фруктофуранозид - резервный трисахарид растений, в больших количествах содержится в бобовых и сахарной свекле, но не обладает сладким вкусом. При гидролизе, катализируемом ферментом α-галактозидазой, из рафинозы образуется дисахарид, сладкий на вкус. Напишите структурную формулу рафинозы. Определите, данный трисахарид является восстанавливающим или невосстанавливающим. Напишите уравнение реакции гидролиза и назовите ее продукты.
3. В организме человека метаболизм фруктозы происходит путем фосфорилирования с затратой АТФ, образовавшийся фруктозо-6-фосфат включается в гликолиз. Напишите схему и рассчитайте энергетический баланс полного окисления фруктозы до СО2 и Н2О.
4. К культуре клеток печени добавили препарат глюкозы, меченый радиоактивным изотопом 14С по 6-му атому углерода. Через некоторое время максимальное накопление радиоактивного изотопа было зарегистрировано в цитоплазме клеток. Указанный опыт повторили, добавив к культуре клеток вещество - стимулятор митоза. В этих условиях большая часть введенной активности была сосредоточена в ядрах клеток. Как можно объяснить наблюдавшуюся закономерность, зная пути метаболизма глюкозы в клетке? В каких еще веществах могут быть обнаружены меченые атомы углерода?
Дополнительное
1. В клубнях ряда растений содержится полимер β-D-фруктопиранозы инулин, при гидролизе которого образуется рафтилоза - олигосахарид, содержащий не более 10 фруктозных звеньев. Напишите структурную формулу рафтилозы, содержащей 3 мономера, соединенных β (2 —> 1)-гликозидными связями, и дайте ей систематическое название. Определите, данный трисахарид является восстанавливающим или невосстанавливающим.
2. К культуре клеток печени добавили препарат молочной кислоты, меченый радиоактивным изотопом 14С по атому углерода карбоксильной группы. При обработке культуры гормоном № 1 радиоактивная метка на короткое время концентрировалась в митохондриальной фракции, а затем длительно фиксировалась в цитозоле. При обработке культуры гормоном № 2 метка попадала в митохондрии и покидала их только в виде СО2. Какие гормоны использовались в 1 и 2 случаях? Как можно объяснить наблюдавшиеся закономерности, зная пути обмена лактата в печени?
Типовой вариант тестового контроля по теме «Обмен углеводов»
Инструкция: при отсутствии дополнительных указаний в вопросе теста выберите один верный вариант ответа.
1. Укажите особенности строения моносахарида:
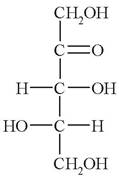
а) кетоза, пентоза, D-изомер;
б) альдоза, пентоза, L-изомер;
в) кетоза, гексоза, L-изомер;
г) альдоза, гексоза, D-изомер;
д) кетоза, пентоза, L-изомер.
2. Выберите восстанавливающий дисахарид, состоящий из галактозы и глюкозы:
а) мальтоза;
б) сахароза;
в) лактоза;
г) целлобиоза;
д) рафиноза.
3. Укажите биологическую роль крахмала:
а) структурный полисахарид растений;
б) резервный полисахарид животных;
в) структурный полисахарид животных;
г) резервный полисахарид растений;
д) структурный полисахарид членистоногих.
4. Какая химическая реакция происходит с глюкозой при кипячении с реактивом Фелинга:
а) окисление;
б) восстановление;
в) гидролиз;
г) образование фосфорного эфира;
д) образование гликозида.
5. Выберите группу веществ - субстратов глюконеогенеза:
а) ацетилкоэнзим А и этанол;
б) глицерин и лактат;
в) кетогенные аминокислоты и холестерин;
г) жирные кислоты и кетоновые тела;
д) глюкоза и гликоген.
6. Дайте название ферменту, катализирующему следующую реакцию:
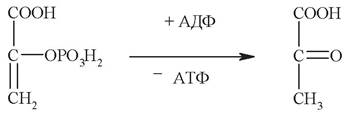
а) гексокиназа;
б) фосфофруктокиназа;
в) фосфоглицератмутаза;
г) пируваткиназа;
д) лактатдегидрогеназа.
7. Какие процессы обеспечивают поддержание физиологических концентраций глюкозы в крови при голодании:
а) секреция инсулина снижается, что активирует распад гликогена и глюконеогенез;
б) секреция инсулина повышается, что активирует гликолиз и синтез гликогена;
в) секреция инсулина снижается, что ингибирует распад гликогена и глюконеогенез;
г) секреция инсулина повышается, что ингибирует гликолиз и синтез гликогена.
8. Укажите конечные продукты анаэробного гликолиза в расчете на 1 моль глюкозы:
а) 1 моль лактата и 38 молей АТФ;
б) 2 моля лактата и 19 молей АТФ;
в) 1 моль лактата и 19 молей АТФ;
г) 2 моля лактата и 2 моля АТФ;
д) 1 моль лактата и 1 моль АТФ.
9. Вставьте пропущенные слова (3 ответа) в предложение: «...путь обмена глюкозы обеспечивает клетку ... для реакций восстановления и рибозо-5-фосфатом для биосинтеза ...»
10. Напишите названия и номера классов ферментов (6 ответов), катализирующих реакции 1, 2 и 3: