БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 16. ОНКОГЕНЕЗ
II. Характеристика опухолевых клеток
Дифференцированные клетки соблюдают границы ткани и не вторгаются в сопредельные территории, подчиняясь правилу контактного торможения. При трансформации это свойство утрачивается.
Клетки опухолей, как правило, имеют округлую или звёздчатую форму и крупнее, чем нормальные. В них изменено ядерно-цитоплазматическое соотношение, имеет место полиплоидия (состояние, при котором ядро содержит 3 и большее число гаплоидных наборов хромосом) или анэуплоидия, когда число хромосом изменяется и становится не кратным гаплоидному набору. Они могут расти, не прикрепляясь к поверхности из-за сниженной способности к адгезии, и образовывать мультислои.
А. Особенности метаболизма
В метаболизме опухолевых клеток обнаруживается ряд характерных особенностей, которые сообщают им существенные преимущества по сравнению с нормальными клетками. Так, в раковых клетках:
✵ возрастает активность рибонуклеотидредуктазы и снижается катаболизм пиримидинов и пуринов, увеличивается синтез ДНК и РНК;
✵ повышается скорость гликолиза (как аэробного, так и анаэробного) и увеличивается продукция лактата. Характерная для многих опухолей повышенная секреция лактата получила название «эффект Варбурга». Преимущественный анаэробный гликолиз является, по-видимому, не внутренне присущим опухолевым клеткам свойством, а скорее следствием быстрого роста при слабой обеспеченности сетью кровеносных сосудов. Поскольку установлено, что чем менее дифференцирована опухоль и чем выше скорость её роста, тем интенсивнее протекает в ней анаэробный гликолиз и слабее окислительное фосфорилирование;
✵ в изоферментном спектре различных белков и ферментов возрастает содержание фетальных форм. Так, в углеводном обмене это фосфофруктокиназа, не ингибирующаяся АТФ и цитратом, изофермент гексокиназы, характеризующийся чрезвычайно высоким сродством к глюкозе, и очень активная лактатдегидрогеназа.
Такие изменения обеспечивают раковую клетку чрезвычайно высоким сродством к глюкозе и способностью ассимилировать её даже при очень низких концентрациях в крови. Аналогичные сдвиги в спектре изоферментов наблюдаются и в других обменах. Это позволяет опухолевым клеткам успешно конкурировать с окружающими тканями за жизненно важные метаболиты.
Б. Появление эмбриональных белков и ферментов
Клетки синтезируют, а иногда и секретируют в кровь эмбриональные белки и антигены, такие как α-фетопротеин, карциноэмбриональный антиген и многие другие. В них появляется характерный для эмбриональных тканей высокоактивный фермент теломераза. Как уже указывалось ранее (см. раздел 4), у животных и человека на концах линейных хромосом расположены тысячи высоко консервативных повторов гексадезоксинуклеотидов -ТТАGGG, называемых теломерами, которые позволяют концам хромосом прикрепляться к ядерной оболочке и предотвращают их разрушение и рекомбинации. При каждой репликации длина теломер укорачивается примерно на 120 пар оснований. Для делящихся соматических клеток укорочение теломер служит репликометром. После достижения теломерными последовательностями критического размера клетки теряют способность к делению, стареют и подвергаются апоптозу (запрограммированной гибели).
В опухолевых и эмбриональных тканях теломераза достраивает теломеры на 3'-концах ДНК хромосом и после репликации восстанавливает их исходную длину. За счёт работы этого фермента прекращается старение клеток, и они становятся бессмертными.
В. Изменения в структуре плазматических мембран и секреции
Трансформация клеток приводит к изменению состава и структуры олигосахаридных цепей гликопротеинов и гликосфинголипидов плазматической мембраны, а как следствие — к её проницаемости и заряда. В частности, снижается интенсивность синтеза и изменяется структура адгезивных молекул и интегриновых рецепторов (см. раздел 5), входящих в состав мембран опухолевых клеток.
Наблюдается секреция некоторых протеаз, коллагеназ и гликозидаз, которые разрушают коллаген, белки, гликозаминогликаны межклеточного матрикса и способствуют инвазии опухоли в соседние ткани и сосуды. Усиливается синтез факторов ангиогенеза, стимулирующих развитие сосудов, которые должны снабжать раковые клетки питательными веществами.
Г. Роль гормонов и факторов роста в развитии опухолей
Рост и развитие клетки в нормальных и опухолевых линиях начинаются с воздействия на клетку факторов роста (ФР). Взаимодействуя с рецепторами, расположенными на поверхности клеток, или с внутриклеточными рецепторами, они стимулируют в клетке каскад событий, приводящих к активации генов, ответственных за синтез белков, обеспечивающих рост и деление клеток (рис. 16-7).
Рис. 16-7. Действие факторов роста на клетку. ФР связываются с рецепторами либо на поверхности мембраны, либо внутри клетки. А — ФР вызывают фосфорилирование белков либо непосредственно при взаимодействии с рецептором, являющимся тир-ПК-азой (ИФР-1, ИФР-2, инсулин), либо за счёт включения аденилатциклазного или фосфатидилинозитольного каскадов и активации протеинкиназ. Фосфорилированные белки активируют транскрипционные факторы, вызывающие синтез новых мРНК и белков. Б — ФР входит в клетку, в комплексе с внутриклеточным рецептором поступает в ядро, активируя транскрипцию генов, стимулирующих рост клетки. Гены, которые кодируют ФР (I), белки-рецепторы (II), трансдукторы сигналов (III) и транскрипционные факторы (IV), называют протоонкогенами. При изменении структуры I, II, III, IV протоонкогены становятся онкогенами и вызывают аномальный рост: 1 — G-белок; 2 — ферменты, синтезирующие вторичные посредники: аденилатциклаза, фосфолипаза С, гуанилатциклаза.
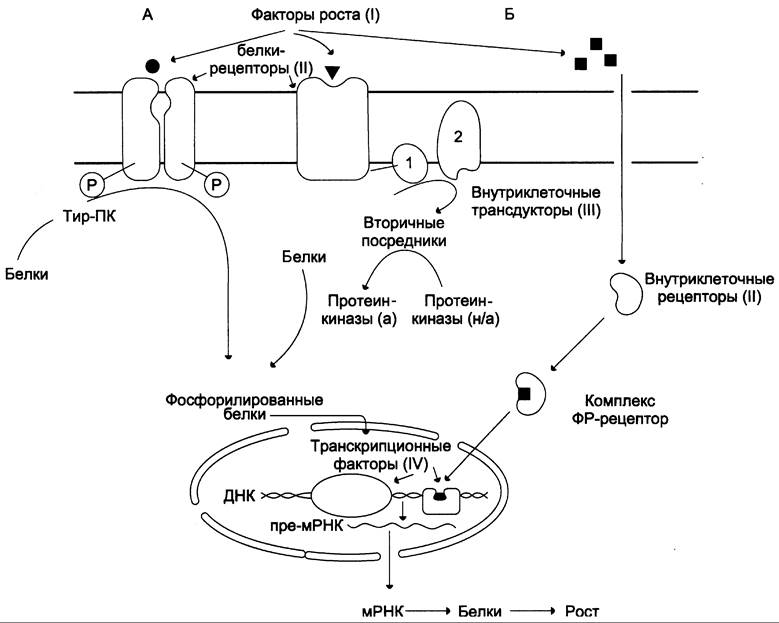
Очевидно, что если гены, кодирующие рецепторы, трансдукторы сигналов и транскрипционные факторы, изменены вследствие мутаций таким образом, что экспрессируются постоянно, то контролируемый рост заменяется неограниченной пролиферацией.
В опухолевых клетках возрастает скорость синтеза и секреции некоторых гормонов и факторов роста. Опухоли приобретают способность к автономному росту за счёт перехода на паракринный или аутокринный механизмы регуляции клеточного роста.
При аутокринном механизме регуляции опухоли синтезируют факторы роста и рецепторы к ним (рФР) или онкобелки, являющиеся аналогами ФР или рФР, которые, взаимодействуя между собой, вызывают аутостимуляцию роста и деления клеток.
Паракринная регуляция предполагает взаимодействие ФР, вырабатываемых одними клетками, с рФР, расположенными на соседних клетках. Так, например, при раке лёгкого клетки стромы вырабатывают инсулиноподобный фактор II, который взаимодействует с рецепторами раковых клеток лёгкого и стимулирует их рост и деление.