БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 16. ОНКОГЕНЕЗ
III. Онкогены, протоонкогены и гены- супрессоры опухолей
В течение многих лет было неясно, почему и откуда у вирусов появились гены, вызывающие рост опухолей. Сначала предполагали, что они изначально принадлежат вирусному геному. Однако в 1989 г. в опытах по гибридизации вирусной ДНК с ДНК из клеток животных установили, что онкогены не присущи вирусам исходно, но получены ими из генома тех клеток, в которых они обитают. За время существования в составе вирусного генома соответствующие гены млекопитающих, включая человека, подверглись многочисленным мутациям и приобрели онкогенные свойства. В некоторых случаях опухолеродные вирусы не содержат онкогенов, но случайное внедрение в геном человека их генетического материала, содержащего промоторы в регуляторных участках, может менять экспрессию соседних хозяйских генов и вызвать трансформацию.
Чтобы отличать нормальные хозяйские гены от вирусных онкогенов, для первых было введено название протоонкогены. В группу протоонкогенов вошли гены, кодирующие белки, которые играют центральную роль в регуляции процессов роста и развития организма, такие как факторы роста (ФР), рецепторы ФР, транс
крипционные факторы и белки, вовлечённые в трансдукцию сигналов.
А. Номенклатура
Онкогены записывают трёхзначным кодом из строчных латинских букв, который обычно указывает объект, из которого данный онкоген был выделен впервые. Так, название онкогена ras указывает на ген, впервые идентифицированный в саркоме крысы (от англ. rat sarcomes). Иногда за трёхбуквенным кодом следует буква или циф-
ра. Это становится необходимым, когда из одного и того же объекта выделяют онкогены, имеющие разные активности. В вирусе эритробластоза идентифицированы гены: erb А, являющийся вирусным гомологом рецептора тиреоидного гормона, и erb В — гомолог рецептора ЭФР.
Проставление числа за обозначением гена часто отражает тот факт, что гены являются членами близко родственных семейств, а номер указывает место гена в данном семействе: bсl 1, bсl 2 и т. д.
Для обозначения вирусных онкогенов перед трёхбуквенным названием онкогена вводят строчную букву v (от англ. virus — вирус) — v-onc, а для обозначения клеточных онкогенов, образующихся в трансформированных клетках при мутациях, букву с (от англ. cell — клетка) — с-оnс.
Гены-супрессоры опухолей, кодирующие белки, которые ингибируют рост и деление клеток, имеют ещё более разнообразную номенклатуру. Наряду с двух- и трёхбуквенным кодом (ген rb) в некоторых случаях указывают размер белкового продукта. Ген р53 так называют потому, что он кодирует синтез белка с молекулярной массой 53 кД.
Белковые продукты генов часто обозначают так же, как гены, но с заглавной буквы. Так, ген ras кодирует белок Ras, ген р53 — белок Р53.
Б. Тип наследования онкогенов и генов-супрессоров опухолей
Большинство опухолей возникает из соматических клеток, а так как соматические клетки диплоидны, то они несут два аллеля каждого гена. Если мутация в одном из аллелей ведёт к нарушению функции клеток, то говорят о доминантном типе наследования. Именно такой тип наследования характерен для онкогенов и гена р53.
Если мутация в одном аллеле не проявляется функционально, то говорят о рецессивном типе наследования. В этом случае биологический эффект достигается только при повреждении обоих аллелей. По рецессивному механизму проявляются мутации в генах-супрессорах опухолей (за исключением р53). Когда вслед за первым аллелем в молекуле ДНК второй аллель также изменяется, то клетка переходит от гетерозиготного к гомозиготному наследованию информации о данном белке, т. е. наблюдается потеря гетерозиготности — LOH (от англ. loss of heterozygosity). Результатом повреждений генома такого типа является синтез изменённого и функционально неактивного белка.
В. Функции онкогенов
Изучение вирусных онкогенов показало, что более 50% из них кодируют тирозиновые про- теинкиназы (тир-ПК), а остальные содержат информацию о различных функционально активных белках: укороченном ФР тромбоцитов, укороченном эпидермальном факторе роста (ЭФР) и рецепторе ЭФР (рЭФР), ДНК-связывающих, ГТФ-связывающих и некоторых других регуляторных белках.
Рассмотрим основные группы белков, которые кодируются онкогенами.
Тирозиновые протеинкиназы (тир-ПК)
К группе тир-ПК относят: онкоген erb-B вируса эритробластоза птиц, кодирующий белок, идентичный β-субъединице ЭФР, гомологи факторов роста тромбоцитов и рецепторов инсулиноподобных факторов I и II. Arc-ген, выделенный из вируса саркомы Рауса, кодирует белок РР60, который обладает активностью тир-ПК. Он фосфорилирует некоторые ферменты гликолиза и ускоряет использование глюкозы в трансформированных клетках, нарушает контактное торможение клеток и стимулирует трансформацию клеток.
В группу тир-ПК помимо онкогенов входят некоторые протоонкогены (рецептор инсулина, рЭФР, рФР тромбоцитов). Следует отметить, что, хотя некоторые белки организма и обладают активностью тир-ПК, но количество фосфотирозина в нормальных клетках очень низко (не более 1% от всех фосфорилированных аминокислот). При опухолевом перерождении ткани активность тир-ПК сильно возрастает, и количество фосфотирозина в фонде аминокислот, входящих в белки, увеличивается.
Ras-онкогены
Другую группу онкобелков кодирует семейство генов ras. Протоонкогены ras содержат информацию о семействе Ras-белков, представляющих собой небольшие G-белки. Подобно G-белкам основных сигнальных систем, эти белки присоединяют ГТФ и обнаруживают ГТФ-азную активность, однако, в отличие от G-белков, имеющих
олигомерную αβy-структуру, Ras-белки мономерны. Они участвуют в трансдукции сигналов, полученных мембранными рецепторами клетки, и, будучи локализованы на внутренней поверхности мембран, тесно контактируют с фосфолипидами и мембранными белками. Установлено участие Ras-белков в изменении структуры цитоскелета, регуляции экзо- и эндоцитоза, реализации митогенных сигналов и активации белков, участвующих в транскрипции генов.
Ras-онкобелки, образующиеся в результате единичных миссенс-мутаций в ГТФ-связывающем домене, обладают очень низкой ГТФ-азной активностью. В результате аденилатциклаза или фосфолипаза С остаются в активированном состоянии дольше, чем обычно, и, таким образом, обеспечивают проведение более длительного сигнала.
Ras-онкобелки обнаружены в 25% всех опухолей человека, причём при некоторых формах опухолей значительно чаще: в 90% карцином поджелудочной железы и более чем в 50% карцином прямой кишки.
Ядерные онкобелки
В семейство ядерных онкогенов входят гены jun, fos, mуc, myb и erb А. Онкобелки, образующиеся при экспрессии этих генов, связываются со специфическими последовательностями на ДНК и функционируют как транскрипционные факторы.
Например, онкобелки Jun и Fos образуют димер, который присоединяется к ДНК, Erb А является изменённой формой рецептора тиреоидного гормона, который тоже связывается со специфическими последовательностями на молекуле ДНК.
Аминокислотная последовательность онкобелка, закодированного геном v-jun, на 80% гомологична ядерному транскрипционному фактору AP1. Когда белки Jun и Fosобъединяются, они образуют структуру лейциновой молнии — хорошо известного активатора транскрипции (см. раздел 1).
Г. Роль супрессоров опухолей в метаболизме клеток
При слиянии нормальных клеток с опухолевыми возникают гибридные клетки, которые, как правило, не обладают злокачественностью. Из этого был сделан вывод о том, что в нормальных клетках присутствуют гены, белковые продукты которых сдерживают репликативный потенциал клеток и предотвращают развитие опухолей. Эти гены получили название генов-супрессоров опухолей, или антионкогенов. Установлено, что в ходе злокачественной трансформации функции этих генов часто утрачиваются, что влечёт за собой нарушение контроля клеточной пролиферации.
В настоящее время описано более 10 генов- супрессоров опухолей (rb1, р53, р21, р16, р15, wt1 и др.), которые кодируют регуляторные белки, ингибирующие аномальный рост и трансформацию клеток.
Ген rb1. Продуктом гена rbl является ядерный белок с молекулярной массой 105 кД, участвующий в регуляции вступления клетки из фазы покоя G0в фазу подготовки к синтезу ДНК G1 и прохождения проверочной точки G1/S. Белок Rb1, подобно циклинзависимым киназам (см. раздел 4), подвергается модификациям путём фосфорилирования и дефосфорилирования. В дефосфорилированной форме он может связываться и инактивировать транскрипционный фактор E2F, который, в свою очередь, усиливает экспрессию рост-стимулирующих белков и ферментов: ДНК-полимеразы α, MYC, CDC2 и некоторых других (рис. 16-8).
Рис. 16-8. Механизм действия белка RB1. Е2f — транскрипционный фактор, усиливающий транскрипцию ряда белков и ферментов, которые регулируют рост и деление клетки. Присоединяясь к Е2F, белок-супрессор Rb1 ингибирует подготовку клеток к митозу. Гиперфосфорилированные и мутантные формы белка Rb1 не имеют сродства к Е2F и перестают тормозить рост клеток.
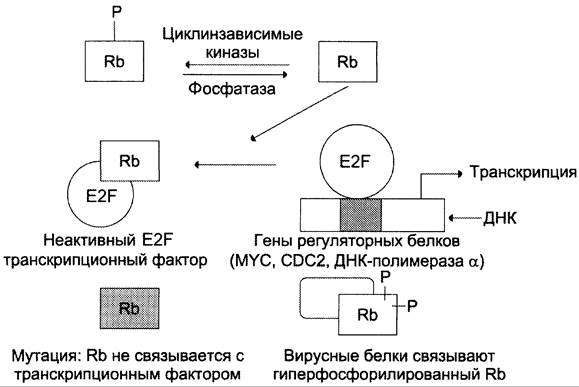
В норме, когда клетка вступает в S-фазу и начинает удваивать ДНК, белок Rbl сильно фосфорилируется и перестает тормозить продвижение клетки по клеточному циклу.
Ген р53 — другой наиболее изученный пример гена-супрессора опухолей. Этот ген кодирует ядерный фосфопротеин с молекулярной массой 53 кД, который препятствует вхождению клеток в S-фазу, амплификации и мутациям ДНК. Полагают, что физиологическая функция белка Р53 состоит в том, чтобы задерживать в G1- и G2-фазах клетки, имеющие повреждения в структуре ДНК до тех пор, пока эти повреждения не будут устранены. В том случае, если репарирующие системы не способны устранить дефекты в структуре ДНК, то этот белок обеспечивает включение механизма апоптоза, уничтожающего повреждённую клетку.
Белок Р53 у человека содержит 393 аминокислоты и состоит из 3 доменов: N-концевого, обогащённого дикарбоновыми аминокислотами, который регулирует транскрипцию; центрального, обеспечивающего связывание с ДНК; С-концевого, ответственного за образование олигомерной структуры этого белка.
Р53 функционирует в форме тетрамера и связывается с регуляторными участками ДНК. Довольно много генов клетки имеют последовательности, способные присоединять Р53 и изменять экспрессию соответствующих генов (рис. 16-9).
Рис. 16-9. Влияние белка Р53 на транскрипцию ряда генов. А — основные гены-мишени, экспрессию которых регулирует белок Р53; Б — инактивация Р53 в результате мутаций в гене или связывания с белками-ингибиторами делает его неспособным ингибировать транскрипцию указанных генов мишеней.
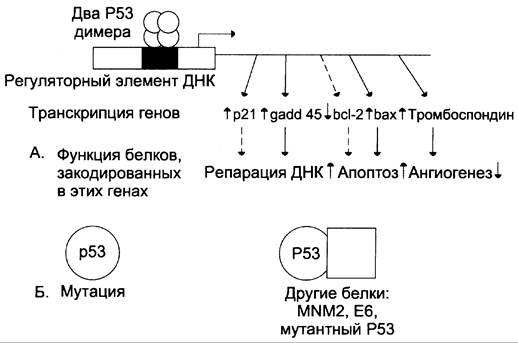
К генам-мишеням относят ген, кодирующий белок Р21 — ингибитор большинства циклин- зависимых киназ. Р53 усиливает транскрипцию гена р21, в результате продвижение по клеточному циклу, рост и деление клетки тормозятся.
Р53 усиливает транскрипцию гена gadd45, белковый продукт которого стимулирует репаративные процессы. Показано, что экспрессия этого гена значительно возрастает в клетках, подвергнутых облучению.
К Р53 чувствительны 2 гена bcl 2 и bах, кодирующие белки, которые участвуют в регуляции апоптоза. Апоптоз активируется в том случае, когда Р53 присоединяется к регуляторным участкам генов bel 2 и bах, при этом экспрессия антиапоптотического гена bcl 2 снижается, а проапоптотического гена bах увеличивается.
Активируя ключевые гены, реализующие программированную гибель клетки, Р53 ускоряет разрушение потенциально опасных клеток, которые повреждены и способны трансформироваться.
Р53 увеличивает экспрессию гена, который кодирует белок тромбоспондин, препятствующий росту сосудов в опухоли (ангиогенез) и, следовательно, препятствующего образованию метастазов (см. раздел 14).
Таким образом, Р53 функционирует в тканях как «хранитель» здоровья клеток, или «молекулярный полицейский».