БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 16. ОНКОГЕНЕЗ
IV. Механизмы неопластической трансформации
В настоящее время установлено, что в регуляции роста и дифференцировки клеток принимает участие более 100 различных генов и около 10 генов-супрессоров опухолей. Злокачественная трансформация не является результатом единичного события. Прежде чем возникает малигнизированная клетка, проходит 5 — 7 стадий, вызывающих изменения в генетическом аппарате клетки (гипотеза многоступенчатого канцерогенеза).
А. Превращение протоонкогенов в онкогены
В настоящее время выявлено пять основных механизмов превращения протоонкогенов в онкогены либо в результате повреждения структуры генов, либо за счёт изменения уровня экспрессии.
Включение в геномную ДНК новых промоторов
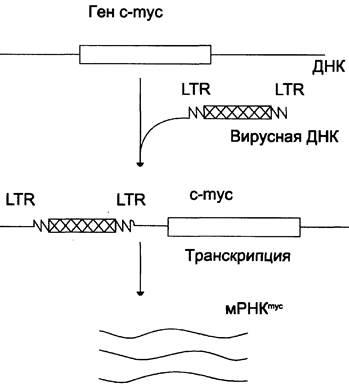
Ранее уже указывалось, что геном ДНК- и РНК-содержащих вирусов интегрирует с ДНК клетки хозяина в форме провирусов. Известно, что ДНК провирусов имеет с обоих концов длинные повторы — LTR, которые играют роль промоторов транскрипции (рис. 16-10). Так, после инфицирования В-лимфоцитов цыплёнка некоторыми вирусами лейкоза птиц провирусы иногда включаются около гена с-mус. В результате ген туе активируется, возрастает его транскрипция с образованием значительных количеств mус- мРНК и последующая трансляция.
Рис. 16-10. Появление новых промоторов в геноме человека при включении генетического материала вируса в молекулу ДНК.
Появление новых энхансерных последовательностей
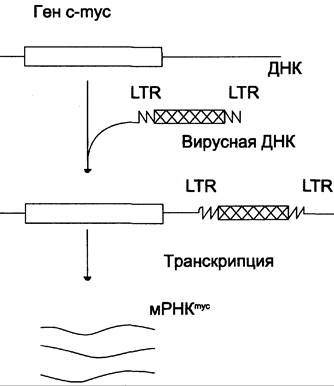
В ряде случаев провирус встраивается в молекулу ДНК перед геном с-mус или после него, либо может быть ориентирован в противоположном направлении, и тем не менее ген с-mус активируется. Этот эффект свидетельствует о том, что в провирусе присутствуют энхансерные последовательности, которые увеличивают экспрессию гена (рис. 16-11).
Рис. 16-11. Включение в геном человека провируса, содержащего энхансерную последовательность.
Амплификация генов
Это явление обнаружено у ряда опухолей. Показано, что амплификация с-ras онкогенов играет существенную роль в прогрессии клеток в направлении большей злокачественности. А введение противоопухолевого препарата метотрексата (ингибитора дигидрофолатредуктазы) вызывает в ходе лечения амплификацию гена дигидрофолатредуктазы более чем в 400 раз, снижая чувствительность опухолевых клеток к лекарству. В ходе цитологического исследования амплифицироваxнные гены можно обнаружить в виде гомологично окрашенных областей на хромосомах, лишённых центромеров.
Точечные мутации
Онкоген с-ras, первоначально обнаруженный в некоторых ретровирусах, кодирует белок с молекулярной массой 21 кД, который назван белком Р21. Анализ ДНК-последовательностей с-ras протоонкогена из нормальных клеток и с-ras онкогена из опухоли жёлчного пузыря человека показал, что эти гены различаются по одному азотистому основанию, соответствующие им белки имеют разные аминокислоты в двенадцатом положении Р21. Аналогичные результаты были получены при исследовании структуры с-ras онкогена из других опухолей человека. Результат во всех случаях был одним и тем же: в структуре онкогена обнаруживалась одна миссенс-мутация, хотя положение мутации в гене могло быть разным. Тем не менее эта мутация изменяла конформацию кодируемого белка и снижала его ГТФ-азную актив
ность. Мутантный белок вызывал длительную стимуляцию аденилатциклазы, повышение в клетке концентрации цАМФ и активацию цАМФ-зависимых протеинкиназ.
Обнаружены мутации, вызывающие постоянную активацию цитозольной тир-ПК онкогена src и Сер-Тре-ПК онкогенов mos и ret. В результате ферменты фосфорилируют одну из изоформ фосфолипазы С, включают инозитолфосфатный путь передачи сигнала, активируют транскрипционные факторы, которые стимулируют клетки к пролиферации и делению.
В карциномах молочной железы и яичников часто обнаруживают онкоген erb В2 или neu, являющийся гомологом рецептора эпидермального фактора роста. Молекула рецептора содержит 3 домена: внеклеточный, или рецепторный домен, домен, пронизывающий мембрану, и внутриклеточный домен, обладающий активностью Тир-ПК.
В ходе трансформации этот ген рецептора амплифицируется и утрачивает фрагмент, ответственный за связывание фактора роста. В результате в клетках образуется белок с нерегулируемой активностью Тир-ПК («эффект нажатой кнопки»), который стимулирует митотические процессы в клетке.
Хромосомные транслокации
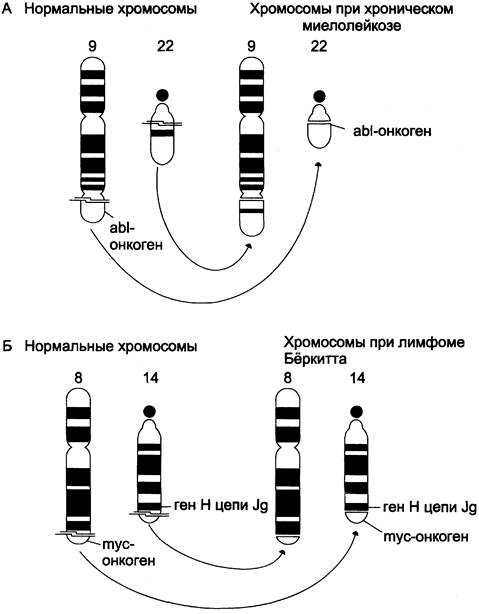
В опухолевых клетках часто обнаруживаются хромосомные транслокации, когда фрагмент одной хромосомы отделяется и включается в другую хромосому. Если участок второй хромосомы отдаёт на первую соответствующий фрагмент, то такую транслокацию называют реципрокной транслокацией. Изменение положения гена в ряде случаев увеличивает его экспрессию и стимулирует малигнизацию. Так, в геноме пациентов с хроническим миелолейкозом имеет место реципрокная транслокация, в ходе которой протоонкоген аb1 перемещается из хромосомы 9 в хромосому 22 (t 9:22) с образованием укороченной филадельфийской хромосомы (рис. 16-12, А), которая легко обнаруживается при рассмотрении хромосом под микроскопом. В результате в филадельфийской хромосоме появляется гибридный ген c-abl-bcr, кодирующий белок с высокой активностью тир-ПК. Этот фермент вызывает последовательность событий, стимулирующих злокачественную трансформацию кроветворных клеток.
При лимфоме Бёркитта протоонкоген с-mус переносится из положения на хромосоме 8 в хромосому 14 (1 8:14). Транслокация такого типа обнаружена у 90% больных, а в 10% случаев имеет место t 8:2 или t 8:22. Установлено, что во всех случаях ген с-тус перемещается в область сильного промотора генов, кодирующих Н- или L-цепи иммуноглобулинов. В результате в клетках происходит гиперпродукция нормального белка С-МУС, который представляет собой транскрипционный фактор, участвующий в ранних стадиях пролиферации (рис. 16-12, Б).
Рис. 16-12. Хромосомные транслокации и активация протоонкогенов. А — хронический миелолейкоз; Б — лимфома Бёркитга.
Б. Мутации в генах-супрессорах опухолей
При ретинобластоме (редком детском онкологическом заболевании сетчатки глаза, 1:20 000 детей) наблюдают делецию в локусе rb 1 хромосомы 13. На основании эпидемиологических исследований и статистического анализа было установлено, что ретинобластома развивается в случае мутации в гене обоих аллелей ретинобласта (рис. 16-13). Анализ ДНК из участков нормальной ткани и опухоли, полученных от больных в ходе операции, показал, что в образцах нормальной ткани ДНК гена rb 1 гетерозиготна, т.е. содержит один неизменённый и другой изменённый аллели, тогда как в опухолевой ткани оба аллеля изменены, т.е. произошла потеря гетерозиготности. Мутация инактивирует белок, и он перестаёт оказывать ингибирующее действие на пролиферативные процессы, инактивация наблюдается и в том
случае, если rb1 связывается с вирусными белками-ингибиторами.
Рис. 16-13. Развитие наследственной (А) и спорадической (Б) форм ретинобластомы.
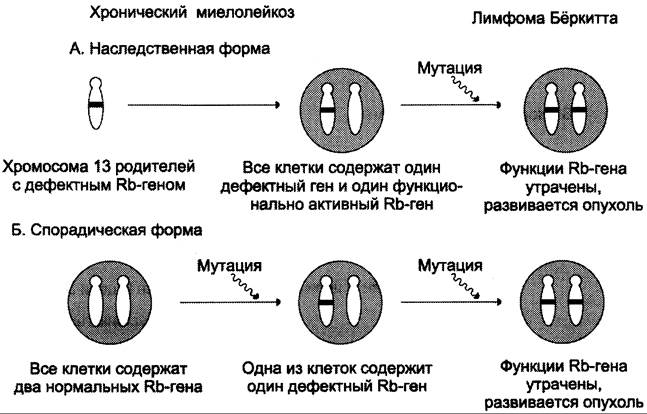
При наследственной ретинобластоме (-40% случаев) часто встречаются множественные опухоли. Они вызваны тем, что мутации в единственном неповреждённом аллеле могут возникать в нескольких ретинобластах. При ненаследственной спорадической форме болезни (-60% случаев) множественные опухоли редки, так как инактивация гена в обоих аллелях одной клетки происходит крайне редко.
Мутации в гене р53 встречаются более чем у половины онкологических больных. Статистика показывает, что функционально неактивный Р53 обнаруживается у 70% больных раком толстой кишки, в 50% случаев рака лёгких и 40% — рака груди.
Около 80% мутаций в гене р53 — миссенс-мутации, затрагивающие наиболее консервативные области гена в участках СG динуклеотидных последовательностей, которые имеют как наследственный, так и ненаследственный характер.
Другой отличительной особенностью гена р53 является то, что мутации в нём проявляются по доминантному типу в результате нарушения структуры в одной из копий генов диплоидной клетки, тогда как для остальных генов-супрессоров опухолей мутации проявляются по рецессивному механизму.
В нормальных тканях концентрация белка Р53 очень низка. Мутации удлиняют полупериод жизни этого белка от нескольких минут до нескольких часов, в результате в ядрах клеток повышается концентрация мутантной формы Р53. Это нашло практическое применение в иммуногистохимическом исследовании опухолей на содержание мутантного белка.
Инактивация белка Р53 происходит не только в результате повреждений в структуре гена, но и при образовании неактивных белок-белковых комплексов с вирусными белками (например, SV40 большим Т-антигеном) или при разрушении белка, которое стимулируют онкобелки, образующиеся при заражении вирусом папилломы человека.