БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 4. БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ (МАТРИЧНЫЕ БИОСИНТЕЗЫ). ОСНОВЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
VI. Ингибиторы матричных биосинтезов
Существует большая группа веществ, ингибирующая синтез ДНК, РНК или белков. Некоторые из них нашли применение в медицине для лечения инфекционных болезней и опухолевых новообразований, а другие для человека оказались токсинами.
Действие ингибиторов матричных биосинтезов как лекарственных препаратов основано на модификации матриц: ДНК, РНК, белоксинтезирующего аппарата (прежде всего, рибосом) или на инактивации ферментов. Центральное место среди них принадлежит антибиотикам — разнообразным по химическому строению органическим соединениям, синтезируемым микроорганизмами, главным образом, микроскопическими грибами, и способным в малых количествах оказывать избирательное токсическое действие на другие микроорганизмы (табл. 4-5).
Таблица 4-5. Антибиотики — ингибиторы матричных биосинтезов как лекарственные препараты
Антибиотики |
Механизм действия |
Ингибиторы репликации Дауномицин Доксорубицин Актиномицин D |
Внедряются («интеркалируют») между парами оснований ДНК и нарушают репликацию и транскрипцию |
Мелфалан |
Алкилирует ДНК и нарушает репликацию |
Номермицин Новобиоцин |
Ингибируют ДНК-топоизомеразу II, ответственную за суперспирализацию ДНК, нарушают репликацию и транскрипцию |
Ингибиторы транскрипции Рифамицины |
Связываются с бактериальной РНК-полимеразой и препятствуют началу транскрипции |
Ингибиторы трансляции Тетрациклины Левомицетин Эритромицин Стрептомицин |
Ингибируют элонгацию: связываются с 30S субъединицей рибосомы и блокируют присоединение аа-тРНК в А-центр Присоединяется к 50S субъединице рибосомы и ингибирует пептидилтрансферазную активность Присоединяется к 50S субъединице рибосомы и ингибирует транслокацию Ингибирует инициацию трансляции. Связывается с 30S субъединицей рибосомы, вызывает ошибки в прочтении информации, закодированной в мРНК |
А. Ингибиторы репликации — противоопухолевые препараты
Антибиотики, взаимодействующие с ДНК, нарушают её матричную функцию й вызывают подавление процессов репликации и транскрипции. Их используют для лечения злокачественных новообразований и называют противоопухолевыми препаратами (см. раздел 15). Дауномицин, доксорубицин и некоторые другие взаимодействуют с молекулой ДНК таким образом, что циклическая структура этих антибиотиков встраивается («интеркалирует») между парами оснований G = С, а углеводный компонент занимает малую бороздку ДНК (рис. 4-43). Это ведёт к локальному изменению структуры ДНК и ингибированию репликации и транскрипции.
Рис. 4-43. Строение «интеркаляторов» — дауномицина и актиномицина D.
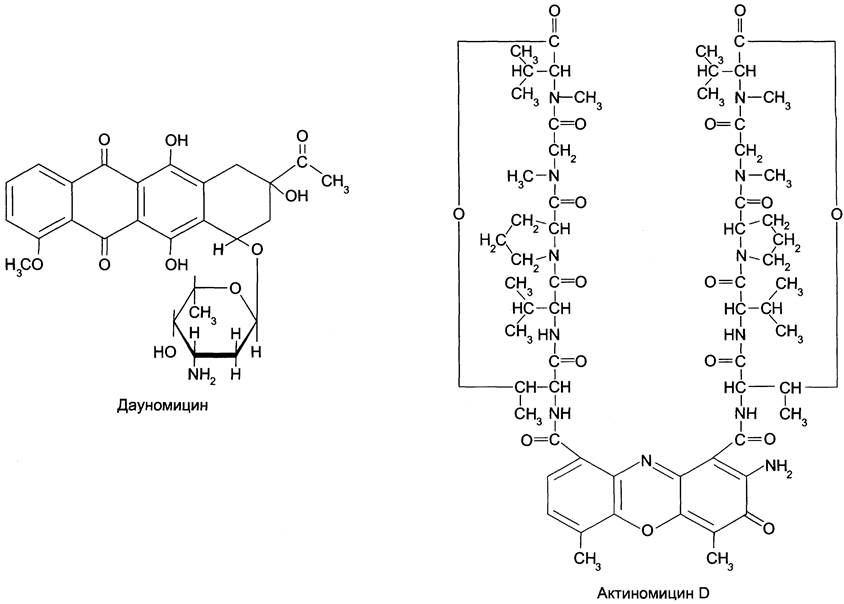
К «интеркаляторам» относят также антибиотик актиномицин D, блокирующий синтез ДНК и РНК у про- и эукариотов. Это соединение слишком токсично, чтобы использовать его в клинических целях, но его широко используют в научно-исследовательской работе для изучения процессинга первичных транскриптов РНК.
Избирательность действия противоопухолевых антибиотиков невелика и обеспечивается более высокой по сравнению с нормальными клетками скоростью синтеза ДНК и РНК, а также повышенной проницаемостью клеточных мембран опухолевых клеток. В то же время эти соединения токсичны для быстроделящихся нормальных клеток организма, таких как стволовые клетки кроветворной системы, клетки слизистой оболочки желудка и кишечника, фолликулов волос. В последние годы проводятся исследования по созданию препаратов, обеспечивающих доставку ингибитора только в опухолевые клетки. Это достигается связыванием цитотоксических антибиотиков с белками, рецепторы к которым имеются главным образом на опухолевых клетках (см. раздел 15).
К препаратам, останавливающим репликацию, относят алкилирующие агенты и ингибиторы ДНК- топоизомеразы II (одной из изоформ топоизомераз). Последние называют ингибиторами гираз, поскольку ДНК-гиразы — ферменты прокариотических клеток, ответственные за суперспирализацию ДНК; у эукариотов аналогичную функцию выполняют ДНК-топоизомеразы. Известно, что транскрипция некоторых генов возможна лишь при определённом уровне суперспирализации матрицы. Соединения, вмешивающиеся в работу ДНК-гираз, могут ингибировать или активировать синтез РНК. К ингибиторам гираз принадлежат налидиксовая кислота, новобиоцин и номермицин.
Б. Ингибиторы транскрипции и трансляции — антибактериальные препараты
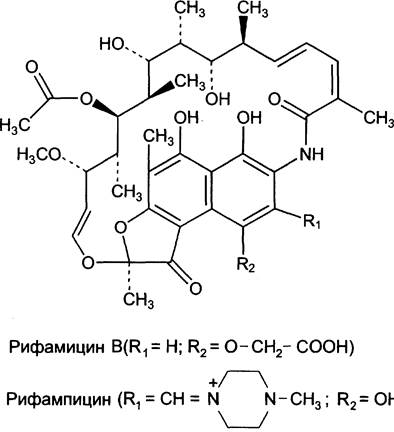
К ингибиторам матричных синтезов, оказывающим противобактериальное действие, относят вещества, блокирующие синтез РНК или белка. В эту группу входит широко применяемый в клинике рифампицин, получаемый на основе природного антибиотика рифамицина. Антибиотики из семейства рифамицинов ингибируют только бактериальную ДНК-зависимую РНК-полимеразу, связываясь с β-субъединицей фермента и препятствуя инициации транскрипции (рис. 4-44). Их применяют для лечения туберкулёза, так как эти препараты не влияют на работу ядерных РНК-полимераз эукариотических клеток. Однако они могут ингибировать синтез митохондриальных РНК, хотя дозы препарата, при которых блокируется образование митохондриальных РНК, выше тех, что используют в лечении инфекционного заболевания.
Рис. 4-44. Антибиотики из семейства рифамицинов.
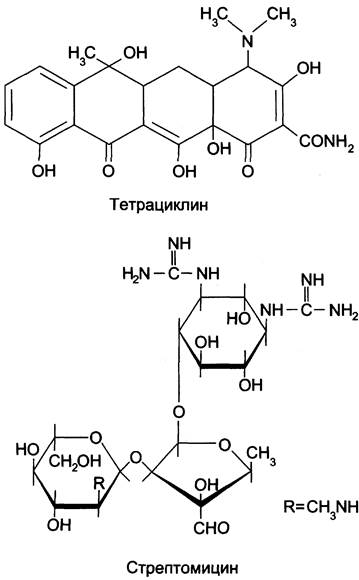
Большая группа антибиотиков является ингибиторами трансляции (рис. 4-45): тетрациклины, эритромицин, пуромицин, хлорамфеникол и аминогликозиды. Так, один из наиболее известных аминогликозидов стрептомицин ингибирует инициацию синтеза белка у прокариотов и вызывает ошибки в прочтении информации, закодированной в мРНК. Его часто назначают при лечении инфекционных заболеваний сердца. К антибиотикам широкого спектра действия относят тетрациклины. Они связываются с 30Sсубъединицей рибосомы и блокируют присоединение аминоацил-тРНК в А-центр рибосомы, тем самым нарушая элонгацию полипептидной цепи. Тетрациклины эффективны в отношении возбудителей многих болезней. Левомицетин (хлорамфеникол) также относят к антибиотикам широкого спектра действия. Он ингибирует синтез белка за счёт присоединения к 50S субъединице рибосомы, подавляя пептидилтрансферазную активность.
Рис. 4-45. Некоторые антибиотики-ингибиторы синтеза белков у прокариотов.
Пенициллины и цефалоспорины относят к группе β-лактамных антибиотиков, продуцируемых плесенью штамма PeniciUum. В структуре этих молекул присутствует реакционноспособное β- лактамное кольцо, вызывающее ингибирование синтеза клеточных стенок у грамотрицательных микроорганизмов. Действие этих антибиотиков направлено на фермент, обеспечивающий образование поперечных связей в структуре белков клеточной стенки бактерий. Необратимое ингибирование активности этого фермента ведёт к образованию изменённых клеточных стенок и гибели бактерий в процессе размножения.
Надо сказать, что препараты антибактериальной группы отличаются высокой избирательностью и сравнительно мало токсичны для человека. Это объясняется различиями в структуре РНК-полимераз, РНК и белков рибосом в эукариотических и прокариотических клетках.
В. Вирусы и токсины — ингибиторы матричных синтезов в эукариотических клетках
Вирусы
Генетический материал вирусов представлен молекулой ДНК или РНК. Он, как правило, невелик и содержит информацию лишь о некоторых специфических белках и ферментах, необходимых для репродукции вируса (например, вирусов оспы, гриппа, полиомиелита, гепатита). Вскоре после заражения с высокой скоростью начинается синтез вирусных ДНК, РНК и белков с использованием ферментов и белков, субстратов и источников энергии клетки хозяина. При этом в инфицированных клетках прекращается синтез нуклеиновых кислот и белков, свойственных организму хозяина. Репродукция вирусных частиц идёт вплоть до гибели заражённой клетки.
Токсины
Причиной гибели людей при отравлении бледной поганкой Amanita phalloides является токсин — α-аманитин, который содержится в теле гриба и вызывает необратимую дисфункцию печени и почек. Высокая токсичность этого соединения для человека связана с тем, что оно ингибирует эукариотические РНК-полимеразы. Наибольшую чувствительность к яду обнаруживает РНК-полимераза II, катализирующая синтез мРНК. Для α-аманитина LD50 (доза per os, при которой погибает 50% лиц, получивших токсин) составляет 0,1 мг/кг массы тела.
Чрезвычайно токсичен белок рицин, выделенный из клещевины обыкновенной. Он представляет собой N-гликозилазу, которая удаляет один остаток аденина из 28S рРНК большой субъединицы рибосомы и ингибирует синтез белка у эукариотов. Рицин — белковый компонент касторового масла, иногда используемого в качестве слабительного средства. Из-за высокой токсичности рицина лечение касторовым маслом проводят короткими курсами, так как длительное употребление может вызвать непрекращающийся понос, нарушение работы кишечника и даже гибель больного.
У человека развитие некоторых бактериальных инфекций сопровождается ингибированием матричных синтезов. Наиболее изученный пример — ингибирование синтеза белков в клетках слизистой оболочки зева и гортани энтеротоксином возбудителя дифтерии Corynebacterium diphteriae. Некоторые штаммы этого патогенного микроорганизма получают ген токсина от бактериального вируса, называемого β-фагом, который инфицирует бактерию и индуцирует синтез токсина — одноцепочечного белка с молекулярной массой 60 кД. В цитоплазме клеток хозяина под влиянием протеолитических ферментов токсин расщепляется на 2 фрагмента, один из которых является ферментом АДФ-рибозилтрансферазой. Этот фермент катализирует АДФ-рибозилирование и инактивацию фактора элонгации EF-2 по реакции:
![]()
В условиях in vitro эта реакция обратима, но при pH и концентрации никотинамида, которые существуют в клетках, она становится необратимой. Модификация фактора EF-2 нарушает транслокацию рибосом, ведёт к прекращению биосинтеза белков в инфицированных клетках и к их гибели. С действием токсина связаны основные симптомы дифтерии.
Описаны и другие токсины бактериального и растительного происхождения, ингибирующие синтез и функциональную активность белков путём АДФ-рибозилирования или модификации рРНК.
Г. Интерфероны
Интерфероны — небольшие белки (гликопротеины), состоящие примерно из 160 аминокислотных остатков. Они секретируются некоторыми клетками позвоночных в ответ на заражение вирусами и препятствуют распространению вирусной инфекции. Этот класс белков синтезируется в исключительно малых количествах: от нанограммов (10-9 г) до пикограммов (10-12 г), но является очень активным неспецифическим противовирусным агентом (106 — 109 единиц антивирусной активности на 1 мг белка). Это соответствует способности одной молекулы интерферона защищать от инфекции одну клетку.
Некоторые компоненты вирусных частиц (например, двухцепочечная РНК) индуцируют синтез по крайней мере 3 типов интерферонов. У человека имеются 14 генов, кодирующих α-интерфероны, которые продуцируются В-лимфоцитами и макрофагами, 5 генов β-интерферонов, обеспечивающих образование соответствующих белков фибробластами, и 1 ген y-интерферона, экспрессия которого идёт в Т-лимфоцитах.
Связываясь с рецепторами на плазматической мембране заражённых клеток, эти белки, подобно белковым гормонам, стимулируют синтез ферментов, способных разрушать мРНК вирусов и прекращать синтез белков на рибосомах, препятствуя тем самым экспрессии вирусных генов в клетках эукариотов.
Исследование механизма действия интерферонов показало, что они:
✵ ингибируют синтез белков, необходимых для репликации вирусов;
✵ стимулируют синтез фермента олигонуклеотидполимеразы, катализирующего образование небольших количеств коротких олигоаденилатов: 2',5'-олиго (А). Эти олигонуклеотиды являются активаторами рибонуклеазы — фермента, расщепляющего матричные и рибосомные РНК;
✵ стимулируют синтез протеинкиназы, которая фосфорилирует и, тем самым, инактивирует фактор инициации eIF2:
eIF2 + АТФ —> eIF2 — ОРО3Н2 + АДФ.
В результате синтез всех белков в инфицированных клетках прекращается. Клетки погибают, но вместе с ними останавливается размножение вирусов, и начинается выздоровление. Таким образом, жертвуя небольшим количеством клеток, организм защищает себя от болезни.
В настоящее время интерфероны, полученные промышленным путём с использованием техники клонирования генов, широко используют при лечении обычной простуды, гриппа, полиомиелита, ветряной оспы, герпеса, вируса гепатита и других инфекций. Хорошие результаты показывает использование интерферонов в терапии некоторых видов злокачественных опухолей, главным образом, гемобластозов (см. раздел 15), хотя их роль в химиотерапии опухолей до настоящего времени остаётся малопонятной.