БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 6. ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
II. Окислительное фосфорилирование АДФ
Так как электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, их транспорт по ЦПЭ к кислороду сопровождается снижением свободной энергии.
При сравнении величин электрохимических потенциалов переносчиков электронов (табл. 6-3) видно, что снижение свободной энергии происходит на каждом этапе ЦПЭ, и энергия электронов выделяется порциями.
Вместе с тем в дыхательной цепи можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии (рис. 6-11). Эти этапы способны обеспечить энергией синтез АТФ, так как количество выделяющейся свободной энергии приблизительно равно энергии, необходимой для синтеза АТФ из АДФ и фосфата. Экспериментально было подтверждено, что процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены.
Первый процесс — перенос электронов от восстановленных коферментов NАDH и FАDН2 через ЦПЭ на кислород — экзергонический. Например,
NADH + Н+ + 1/2 O2 —> NАD+ + Н2O + 52 ккал/моль (~220 кДж/моль). (1)
Второй процесс — фосфорилирование АДФ, или синтез АТФ, — эндергонический:
АДФ + Н3РO4 + 7,3 ккал/моль (30,5 кДж/моль) = АТФ + Н2O. (2)
Синтез АТФ из АДФ и Н3РO4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
А. Механизм сопряжения окисления и фосфорилирования
Каким же образом осуществляется сопряжение этих двух процессов? Наиболее обоснованный ответ на этот вопрос даёт хемиосмотическая теория Митчелла, предложенная им в 1961 г. Основные положения были подтверждены и разработаны детально совместными усилиями многих исследователей в последующие годы.
1. Протонный градиент и электрохимический потенциал
Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ.
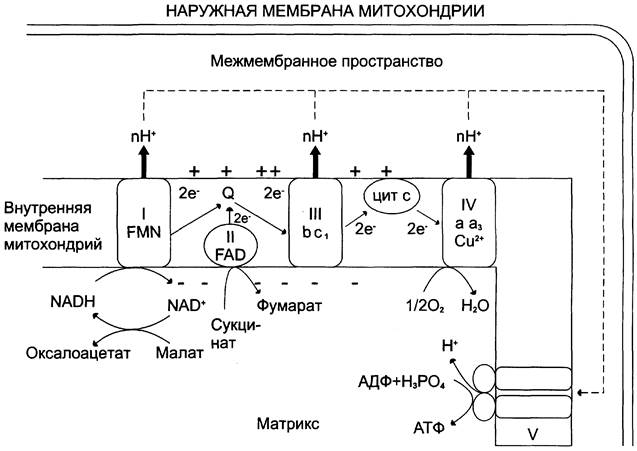
Протоны, перенесённые из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а pH меньше, чем в матриксе. Кроме того, каждый протон несёт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный — на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ∆μН+ — источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ∆μH+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования (рис. 6-11, 6-13).
Рис. 6-13. Сопряжение дыхания и синтеза АТФ в митохондриях. I — NADH-дегидрогеназа; II — сукцинат дегидрогеназа; III — QН2-дегидрогеназа; IV — цитохромоксидаза; V — АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
Механизм транспорта протонов через митохондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса III (рис. 6-14).
Рис. 6-14. Сопряжение переноса электронов через дыхательный комплекс III с транспортом Н+ через мембрану. Восстановленный убихинон (QН2) взаимодействует с Fе3+ гема b1 и, восстанавливая его, освобождает протон в водную фазу, превращаясь в семихинон (НQ*). Электрон от гема b1 переносится на Fе3+ гема b2. НQ* отдаёт второй электрон на FеS-центр, расположенный ближе к наружной поверхности мембраны; при этом второй протон оказывается в межмембранном пространстве; электрон передаётся на цитохром с1, а далее на цитохром с. ОкисленныйQ диффундирует к внутренней стороне мембраны, где получает электрон от гема b2 и протон из матрикса, превращаясь в НQ*. НQ* получает электрон от комплекса I и протон из матрикса; в мембране образуется QН2, и весь процесс повторяется сначала.
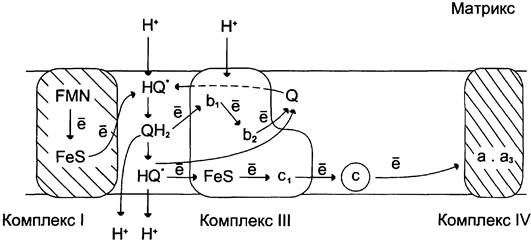
KoQ переносит электроны от комплекса I к комплексу III и протоны из матрикса в межмембранное пространство, совершая своеобразные циклические превращения, называемые Q- циклами. Донором электронов для комплекса III служит восстановленный убихинон (QH2), а акцептором — цитохром с. Цитохром с находится с внешней стороны внутренней мембраны митохондрий; там же располагается активный центр цитохрома с1, с которого электроны переносятся на цитохром с.
В мембране существует стационарный общий фонд Q/QН2, из которого каждая молекула QН2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-потенциала. Энергия электрохимического потенциала (∆μН+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ- синтазы.
2. Строение АТФ-синтазы и синтез АТФ
АТФ-синтаза (Н+-АТФ-аза) — интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1 (рис. 6-15).
Рис. 6-15. Строение и механизм действия АТФ-синтазы. А — F0 и F1 — комплексы АТФ-синтазы. В состав F0 входят полипептидные цепи, которые образуют канал, пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β («головка»), прикрывающие стержневую часть, которая состоит из 3 субъединиц y, δ и ε. у и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание АДФ, неорганического фосфата (Рi) и АТФ. Б — Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерёдно в 3 активных центрах: 1 — связывание АДФ и Н3РO4; 2 — образование фосфоангидридной связи АТФ; 3 — освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ.
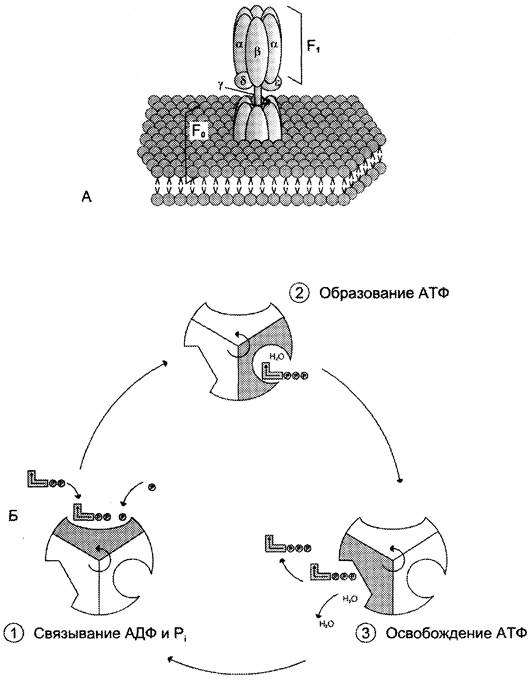
Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.
Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (3α, 3β, y, ε, δ). Субъединицы α и β уложены попарно, образуя «головку»; между α- и β-субъединица- ми располагаются 3 активных центра, в которых происходит синтез АТФ; y-, ε-, δ- субъединицы связывают комплекс F1 с F0.
Повышение концентрации протонов в межмембранном пространстве активирует АТФ- синтазу. Электрохимический потенциал ∆μН+ заставляет протоны двигаться по каналу АТФ- синтазы в матрикс. Параллельно под действием ∆μН+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из АДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используется для синтеза одной молекулы АТФ.
3. Коэффициент окислительного фосфорилирования
Окисление молекулы NАDН в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FАD-зависимых дегидрогеназ поступают в ЦПЭ на КоQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О.Следовательно, для NАDН Р/О = 3, для сукцината Р/О = 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше.
4. Дыхательный контроль
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется, и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ — АДФ, может меняться в десятки раз.
Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40 — 60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Б. Транспорт АТФ и АДФ через мембраны митохондрий
В большинстве эукариотических клеток синтез основного количества АТФ происходит внутри митохондрии, а основные потребители АТФ расположены вне её. С другой стороны, в матриксе митохондрий должна поддерживаться достаточная концентрация АДФ. Эти заряженные молекулы не могут самостоятельно пройти через липидный слой мембран. Внутренняя мембрана непроницаема для заряженных и гидрофильных веществ, но в ней содержится определённое количество транспортёров, избирательно переносящих подобные молекулы из цитозоля в матрикс и из матрикса в цитозоль.
В мембране есть белок АТФ/АДФ-антипор- тер, осуществляющий перенос этих метаболитов через мембрану (рис. 6-16). Молекула АДФ поступает в митохондриальный матрикс только при условии выхода молекулы АТФ из матрикса.
Рис. 6-16. Схема трансмембранного переноса веществ за счёт энергии ∆μН. Потоки различных веществ (АТФ, АДФ, Н3РO4, Са2+) проходят через специфические транспортёры, при этом затрачивается энергия электрохимического потенциала мембраны.
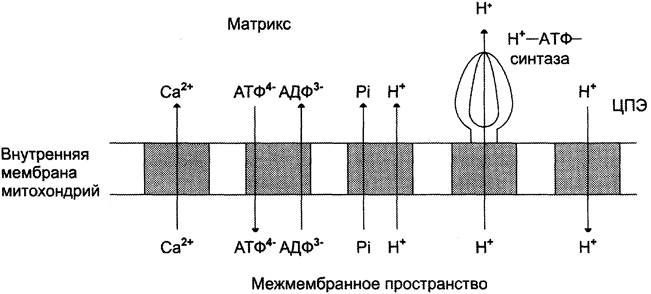
Движущая сила такого обмена — мембранный потенциал переноса электронов по ЦПЭ. Расчёты показывают, что на транспорт АТФ и АДФ расходуется около четверти свободной энергии протонного потенциала. Другие транспортёры тоже могут использовать энергию электрохимического градиента. Так переносится внутрь митохондрии неорганический фосфат, необходимый для синтеза АТФ. Непосредственным источником свободной энергии для транспорта Са2+ в матрикс также служит протонный потенциал, а не энергия АТФ.
В. Разобщение дыхания и фосфорилирования
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NАDН и NАDН2 возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители — липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ — 2,4-динитрофенол (рис. 6-17), легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс.
Рис. 6-17. Механизм разобщения дыхания и фосфорилирования. Протонированная форма 2,4-динитрофенола переносит протоны через внутреннюю мембрану митохондрий и препятствует образованию протонного градиента.
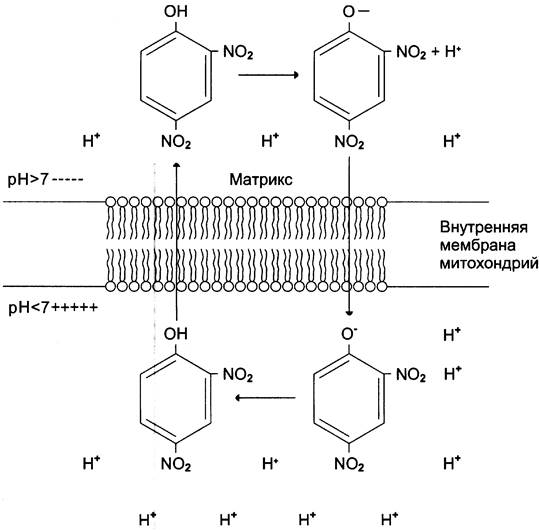
Примерами разобщителей могут быть также некоторые лекарства, например, дикумарол — антикоагулянт (см. раздел 14) или метаболиты, которые образуются в организме, билирубин — продукт катаболизма гема (см. раздел 13), тироксин — гормон щитовидной железы (см. раздел 11). Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Г. Терморегуляторная функция ЦПЭ
На синтез молекул АТФ расходуется примерно 40 — 45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнеспящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования — бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) — термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями (рис. 6-18).
Рис. 6-18. Механизм разобщающего действия жирных кислот. 1 — выкачивание протонов дыхательной цепью; 2 — протонирование аниона жирной кислоты; 3 — диффузия протонированной жирной кислоты к внутренней поверхности мембраны; 4 — диссоциация RСООН с образованием RСОO- и иона Н+; 5 — перенос RСОO- посредством АТФ/АДФ-антипортера или разобщающего белка к наружной поверхности митохондриальной мембраны.
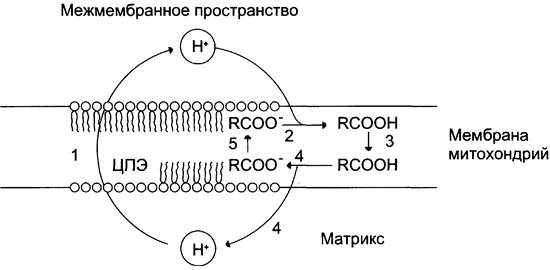
На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера.
При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо (см. раздел 8). Образующиеся свободные жирные кислоты служат не только «топливом», но и важнейшим регулятором разобщения дыхания и фосфорилирования.