БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 6. ЭНЕРГЕТИЧЕСКИЙ ОБМЕН
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ включает 3 этапа: поступление веществ в организм, метаболизм и выделение конечных продуктов из организма.
Поступление веществ в организм происходит в результате дыхания (кислород) и питания. В ЖКТ продукты питания перевариваются (расщепляются до простых веществ). При переваривании происходит гидролиз полимеров (белков, полисахаридов и других сложных органических веществ) до мономеров, всасывающихся в кровь и включающихся в промежуточный обмен.
Промежуточный обмен (внутриклеточный метаболизм) включает 2 типа реакций: катаболизм и анаболизм (рис. 6-1).
Рис. 6-1. Общая схема обмена веществ и энергии. 1 — пищеварение; 2 — катаболизм; 3 — анаболизм; 4 — распад структурно-функциональных компонентов клеток; 5 — экзергонические реакции; 6,7 — эндергонические реакции; 8 — выведение из организма.
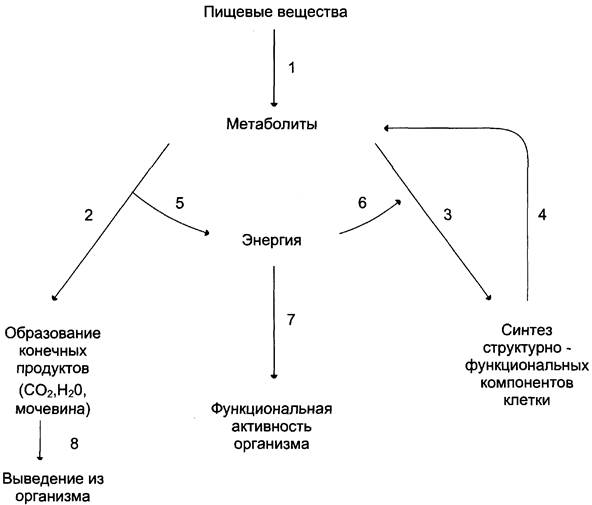
Катаболизм — процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека — СО2, Н2О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток.
Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции).
Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
I. Биологическое окисление
Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате этих реакций происходит освобождение энергии, которая необходима организмам в процессах жизнедеятельности для осуществления различных видов работы. Небиологические системы могут совершать работу за счёт тепловой энергии, биологические системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию. Изучением превращений энергии, сопровождающих химические реакции, занимается биоэнергетика, или биохимическая термодинамика.
А. Свободная энергия и законы термодинамики
Живые организмы с точки зрения термодинамики — открытые системы. Между системой и окружающей средой возможен обмен энергии, который происходит в соответствии с законами термодинамики.
1. Законы термодинамики
Первый закон — закон сохранения энергии; его можно сформулировать так: общая энергия системы и окружающей среды — величина постоянная.
Внутри рассматриваемой системы энергия может переходить от одной её части к другой или превращаться из одной формы в другую.
Второй закон гласит, что все физические и химические процессы в системе стремятся к необратимому переходу полезной энергии в хаотическую, неуправляемую форму. Мерой перехода или неупорядоченности системы служит величина, называемая энтропией (S), она достигает максимума, когда система приходит в истинное равновесие с окружающей средой.
2. Свободная энергия
Каждое органическое соединение, поступающее в организм извне или входящее в состав живой материи, обладает определённым запасом внутренней энергии (Е). Часть этой внутренней энергии может быть использована для совершения полезной работы. Такую энергию системы называют свободной энергией (G).
При постоянных температуре и давлении соотношение между изменением свободной энергии системы (∆G) и изменением энтропии (∆S) можно представить следующим уравнением:
∆G = ∆Н — Т х S, где ∆Н — изменение энтальпии (внутренней энергии или теплоты, содержащейся в системе); Т — абсолютная температура. В условиях, при которых протекают биохимические реакции, АН приблизительно равно АЕ (изменению внутренней энергии системы в результате реакции). Для биологических систем измерение свободной энергии производят обычно при стандартных условиях, когда pH 7,0, температура 25 °С, все растворы находятся в концентрации 1 моль/л, а все газы при давлении в 1 атм.
При стандартных условиях все функции обозначают как ∆G°′, ∆S°′ и ∆H°′. Изменение стандартной свободной энергии (∆G°′) можно вычислить, зная константу равновесия (К'еq) химической реакции.
3. Эндергонические и экзергонические реакции
Направление химической реакции определяется значением ∆G. Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими. Если при этом абсолютное значение ∆G велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если ∆G положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими.
Если абсолютное значение ∆G велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ∆G, равном нулю, система находится в равновесии (табл. 6-1).
Таблица 6-1. Соотношение между величинами К'eq и ∆G°′ и направлением химических реакций
К'еq |
∆G°′ |
Направление реакции при исходных концентрациях компонентов 1 М |
>1,0 |
Отрицательно |
Слева направо |
1,0 |
Равно нулю |
Состояние равновесия |
<1,0 |
Положительно |
Справа налево |
4. Сопряжение экзергонических и эндергонических процессов в организме
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Рассмотрим подробнее энергетику сопряжённых реакций на примере фосфорилирования глюкозы.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической:
(1) Глюкоза+ Н3РO4 —> Глюкозо-6-фосфат + Н2O (∆G = +13,8 кДж/моль).
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ —> АДФ + Н3РO4 (∆G = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой (см. раздел 7), фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ —> Глюкозо-6-фосфат + АДФ (∆G = -16,7 кДж/моль).
Б. Характеристика высокоэнергетических фосфатов. Цикл АТФ-АДФ
В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами (табл. 6-2).
Таблица 6-2. Свободная энергия гидролиза некоторых органичесих фосфатов
Соединение |
Продукты реакции |
- ∆G°′, ккал/моль |
- ∆G°′, кДж/моль |
Фосфоенолпируват |
Пируват + Н3РО4 |
14,8 |
61,86 |
1,3-Бисфосфоглицерат |
3-фосфоглицерат + Н3РО4 |
13,0 |
54,34 |
Карбамоилфосфат |
Карбамат + Н3РО4 |
12,0 |
51,83 |
Креатинфосфат |
Креатин + Н3РО4 |
10,3 |
43,05 |
Ацетилфосфат |
Уксусная кислота + Н3РО4 |
10,3 |
43,05 |
АТФ |
АДФ + Н3РО4 |
7,3 |
30,51 |
АДФ |
АМФ + Н3РО4 |
6,6 |
27,59 |
Дифосфат(Н4Р2О7) |
2 Н3РО4 |
6,6 |
27,59 |
Глюкозо-1 -фосфат |
Глюкоза + Н3РО4 |
5,0 |
20,90 |
Фруктозо-6-фосфат |
Фруктоза + Н3РО4 |
3,8 |
15,88 |
Глюкозо-6-фосфат |
Глюкоза + Н3РО4 |
3,3 |
13,79 |
Глицеролфосфат |
Глицерин + Н3РО4 |
2,2 |
8,36 |
Как видно из табл. 6-2, разные фосфорилированные соединения обладают разным запасом свободной энергии. К группе высокоэнергетических фосфатов, помимо АТФ, относят енолфосфаты, ангидриды и фосфогуанидины. Соединения, расположенные в нижней части таблицы, составляют группу низкоэнергетических фосфатов. Центральное место среди этих соединений занимает АТФ (рис. 6-2).
Рис. 6-2. Аденозинтрифосфорная кислота (АТФ). В молекуле АТФ две высокоэнергетические (макроэргические) связи β и y; они обозначены на рисунке знаком ~ (тильда).
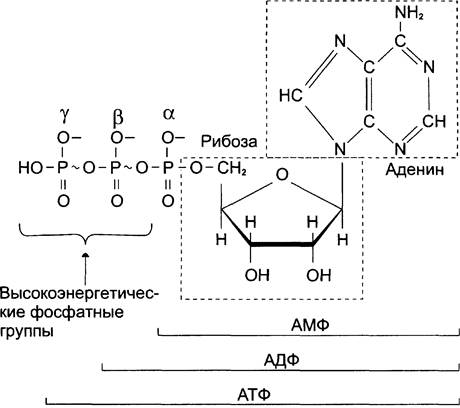
АТФ — молекула, богатая энергией, поскольку она содержит две фосфоангидридные связи (β, у).
При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi. При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (pH 7,0, температура 37 °С), фактическое значение ∆G°′ для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенол-пируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ.
Таким образом, АТФ — главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
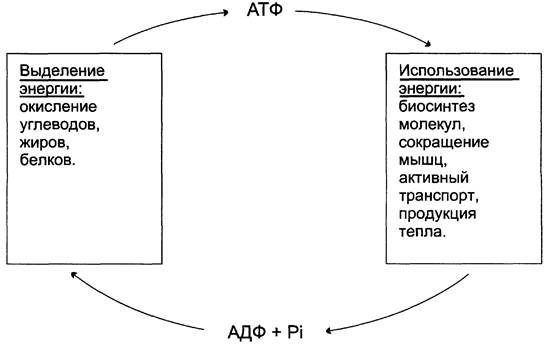
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений (рис. 6-3). Цикл АТФ-АДФ — основной механизм обмена энергии в биологических системах, а АТФ — универсальная «энергетическая валюта».
Рис. 6-3. Цикл АТФ-АДФ.
В. Окислительно-восстановительные реакции. Окилительно-восстановительный потенциал
Под окислением понимают отщепление электронов, а под восстановлением — присоединение электронов. Окисление донора электронов всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительновосстановительных процессов применим и к биохимическим системам. В любой окислительно-восстановительной реакции участвует акцептор электронов (окислитель) и донор электронов (восстановитель). Например,
(1) Сu + О —> Сu2 + O2-.
Суммарную реакцию (1) можно условно разделить на 2 полуреакции (2), (3):
(2) Сu — 2е —> Сu2+.
(3) О + 2е —> О2-.
В каждой из них участвует окисленная и восстановленная форма одного соединения; их называют сопряжённой парой, или редокс-парой.
Таблица 6-3. Стандартные окислительно-восстановительные потенциалы некоторых сопряжённых пар
Окислительно-восстановительная пара |
Е0′, V |
2Н+/Н2 |
-0,42 |
NAD+/NADH |
-0,32 |
NADP+/NADPH |
-0,32 |
NADH-дегидрогеназа (FMN-форма) NADH-дегидрогеназа (FMNH2-фopмa) |
-0,30 |
FAD-белок/FADH2-белок |
-0,05 |
Сукцинат/фумарат |
+0,03 |
Убихинон/убихинол |
+0,04 |
цит. b Fе3+/цит. b Fe2+ |
+0,07 |
цит. c1 Fе3+/цит. c1 Fe2+ |
+0,23 |
цит. с Fе3+/цит. с Fe2+ |
+0,25 |
цит. а Fе3+/цит. a Fe2+ |
+0,29 |
цит. а3 Fe3+/цит. a3 Fe2+ |
+0,55 |
1/2 O2 + 2 Н+ + 2е/Н2O |
+0,82 |
Разные редокс-пары обладают различным сродством к электрону. Те, у которых это сродство меньше, отдают электрон тем, у кого оно больше. Мерой сродства редокс-пары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Е0'), величина которого непосредственно связана с изменением свободной энергии. Величину Е0' выражают в вольтах; чем она меньше (отрицательнее), тем меньше сродство вещества к электронам. Чем больше сродство, тем больше восстановительный потенциал.
Редокс-потенциалы Е0' связаны с изменением свободной энергии уравнением Нернста:
∆G0' = - nF∆E0'
где n — число перенесённых в реакции электронов; F — постоянная Фарадея (23 061 ккал В-1моль-1); ∆Е0' — разность редокс-потенциалов электрон-донорной и электрон-акцепторной пар.
Величина ∆Е0' — стандартная величина окислительно-восстановительного потенциала; её определяют в стандартных условиях, когда концентрации всех веществ равны 1 М, давление газов составляет 1 атм, а pH 7,0 (табл. 6-3).
Г. Основные этапы трансформации энергии катаболических процессов
Энергия освобождается в процессе ферментативного окисления метаболитов специфическими дегидрогеназами. В реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты NAD- и FAD-зависи- мых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О2происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О.
Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) — дыхательной цепью.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в форме АТФ, а часть энергии рассеивается в виде тепла. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении различных субстратов, могут быть использованы в реакциях биосинтеза, для которых помимо АТФ требуются восстановительные эквиваленты, например, NADPH.
Д. Ферменты и коферменты, участвующие в окислительно-восстановительных реакциях
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нём участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего компонента и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О. В дыхательную цепь митохондрий входит большое число переносчиков (рис. 6-4).
Рис. 6-4. Митохондриальная цепь переноса электронов. Комплекс I содержит FMN и не менее пяти железосерных белков (FeS). Комплекс III включает две разные формы цитохрома b (с максимумами поглощения 562 и 566), один FeS-белок и цитохром с1. Комплекс IV содержит цитохромы а1 и а3 и два иона меди. Комплекс II (сукцинатдегидрогеназа) на рисунке не показан (см. рис. 6-13). Комплекс V - АТФ-синтаза.
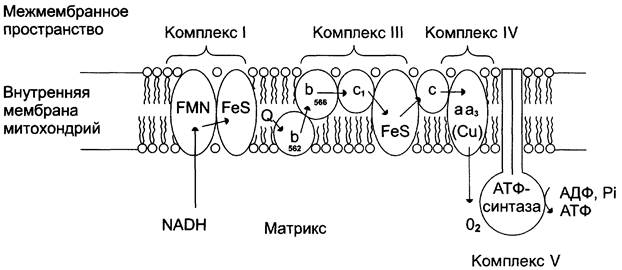
За исключением убихинона (KoQ), все компоненты ЦПЭ — белки. В составе этих белков содержатся различные небелковые компоненты: FMN, Fe в составе железосерных белков и в составе порфириновых колец, ионы Сu.
1. Первичные акцепторы водорода
Первичные акцепторы водорода окислительновосстановительных реакций относят к 2 типам дегидрогеназ: никотинамидзависимым, содержащим в качестве коферментов производные никотиновой кислоты, и флавинзависимым, содержащим производные рибофлавина (см. раздел 2).
Никотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+ (см. раздел 2). NAD+ и NADP+ — производные витамина РР. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид (рис. 6-5).
Рис. 6-5. Структурные формулы рабочей части коферментов NAD+ и NАDР+. В окисленной форме никотинамидные коферменты обозначают как NAD+ и NАDР+, так как они несут положительный заряд на атоме азота пиридинового кольца. В реакциях дегидрирования из двух атомов водорода, отщепляемых от окисляемого субстрата, никотинамидное кольцо присоединяет ион водорода и два электрона в форме гидрид-иона (: Н-). Второй ион переходит в среду. В обратной реакции NАDН (NАDРН) выступают в качестве доноров электронов и протонов.
Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа:
R-CHOH-R1+ NAD+<-> R-CO-R1+ NADH + Н+.
Таким образом, NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ.
NADPH не является непосредственным донором электронов в ЦПЭ, а используется почти исключительно в восстановительных биосинтезах (см. раздел 8). Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей реакцию:
NADPH + NAD+<-> NADP++ NADH.
Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2 (см. раздел 2). Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система (рис. 6-6).
FAD служит акцептором электронов от многих субстратов в реакциях типа:
![]()
где Е — белковая часть фермента.
Рис. 6-6. Структурные формулы рабочей части коферментов FAD и FMN. В ходе реакции FAD и FMN присоединяют 2 электрона и, в отличие от NAD+, оба теряемых субстратом протона.
Большинство FAD-зависимых дегидрогеназ — растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинат- дегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим ферментам принадлежит NADН-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе.
2. Цепь переноса электронов от NADH и FADH2 на кислород
Перенос электронов от NADH к O2 включает ряд переносчиков, которые локализованы во внутренней мембране митохондрий. За исключением убихинона и цитохрома С, это сложные белковые комплексы.
NADH-дегидрогеназа (NADH-Q-редуктаза, комплекс I) состоит из нескольких полипептид- ных цепей. Роль простетической группы играет FMN. Единственный субстрат фермента — NADH, с которого 2 электрона и протон переносятся на FMN с образованием FMNH2. Второй протон поглощается из матрикса. Реакция протекает по уравнению:
NADH + Н+ + Е (FMN) —> NAD+ + Е (FMNH2).
С FMNH2 электроны переносятся затем на ряд железосерных белков (FeS), играющих роль второй простетической группы в молекуле NADH-дегидрогеназы. Атомы железа в этих белках (негемовое железо) собраны в несколько групп, так называемых железосерных центров. FeS-центры входят в состав многих белков (флавопротеинов, цитохромов), участвующих в окислительно-восстановительных реакциях. Известны 3 типа FeS-центров (FeS, Fe2S2, Fe4S4), в которых атом железа связан с атомом серы остатков цистеина или неорганической серы. Строение железосерных центров показано на рис. 6-7.
Рис. 6-7. Строение железосерных центров. I — FeS-центр; атом железа связан координационными связями с четырьмя атомами серы, принадлежащими четырём остаткам цистеина в белке. II — Fе2S2-центр; каждый из двух атомов железа связан координационными связями с двумя атомами неорганической серы и двумя остатками цистеина в белке; III — Fе4S4-центр; четыре атома железа связаны с четырьмя атомами серы и четырьмя остатками цистеина в белке. Атомы железа в FeS-центрах могут находиться в окисленном (Fe3+) или восстановленном (Fe2+) состоянии.
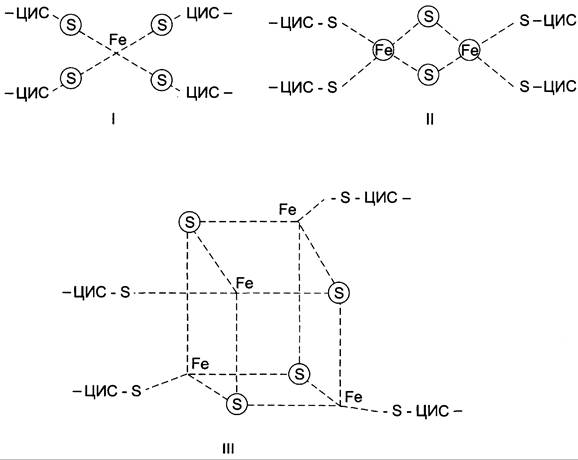
NADH-дегидрогеназа содержит несколько центров типа Fe2S2 и Fe4S4 Атомы железа в таких центрах могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри- (Fe3+) состояния. От железосерных центров электроны переносятся на кофермент Q (убихинон) (рис. 6-8).
Рис. 6-8. Структура убихинона (кофермента Q), n — число изопреноидных звеньев. Убихинон может принимать один электрон и превращаться в семихинон или 2 электрона и полностью восстанавливаться в гидрохинон (убихинол).
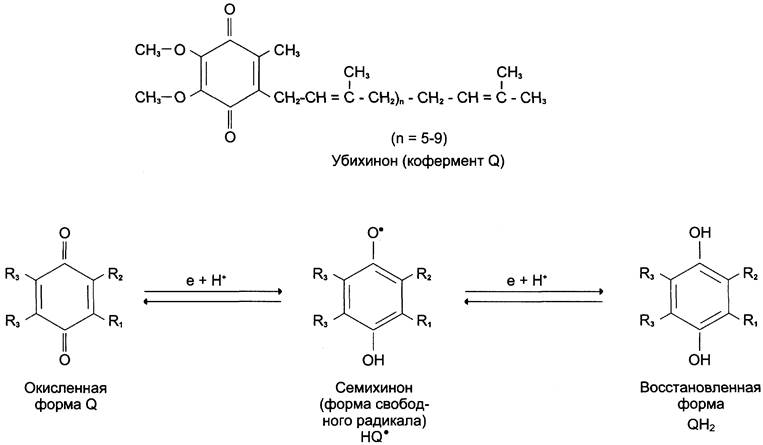
Обозначение этого жирорастворимого хинона происходит от первой буквы английского названия хинона (quinone), а название убихинон отражает его широкую распространённость в природе (ubiquitous — вездесущий). Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи, которая у млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q10. В процессе переноса электронов с NADH-дегидрогеназы через FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от NADH-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинат- дегидрогеназы. Убихинон участвует в реакциях типа:
Е (FMNH2) + Q —> Е (FMN) + QH2.
Цитохромы или гемопротеины присутствуют во всех типах организмов. В клетках эукариотов они локализованы в митохондриальных мембранах и в ЭР. Известно около 30 различных цитохромов. Все цитохромы в качестве просте- тической группы содержат гем (см. раздел 1). Их многообразие обусловлено:
✵ различием боковых цепей в структуре гема;
✵ различием в структуре полипептидных цепей;
✵ различием в способе связи полипептидных цепей с гемом.
В зависимости от способности поглощать свет в определённой части спектра все цитохромы делят на группы а, b, с. Внутри каждой группы отдельные виды с уникальными спектральными свойствами обозначают цифровыми индексами (b, b1, b2 и т. д.).
Структурные особенности разных видов цитохромов определяют различие в их окислительно-восстановительных потенциалах. В ЦПЭ участвуют 5 типов цитохромов (а, а3, b, с, с1). За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов (табл. 6-4).
QH2-дегидрогеназа (коэнзим Q-цитохром с-редуктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QН2-дегидрогеназа переносит электроны от убихинола на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на FeS-центры, на цитохром с1, а затем на цитохром с. Группы гема, подобно FеS-центрам, переносят только по одному электрону. Таким образом, от молекулы QН2 2 электрона переносятся на 2 молекулы цитохрома b. В качестве промежуточного продукта в этих реакциях переноса электронов возможно образование свободного радикала семихинона. В цитохромах типа b гем не связан ковалентно с белком, а в цитохромах с1 и с он присоединяется к белку при помощи тиоэфирных связей (рис. 6-9). Эти связи образуются путём присоединения 2 цистеиновых остатков к винильным группам гема.
Рис. 6-9. Структура гема цитохромов b, с, с1.
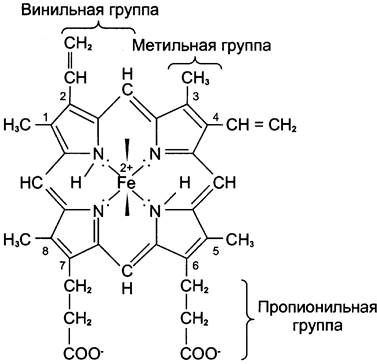
Цитохром с — периферический водорастворимый мембранный белок с молекулярной массой 12 500 Д, имеющий одну полипептидную цепь из 100 аминокислотных остатков, и молекулу гема, ковалентно связанную с полипептидом.
Цитохромоксидаза (комплекс IV) состоит из 2 цитохромов типа аа3 каждый из которых имеет центр связывания с кислородом. Цитохромы а и а3 имеют характерную железопорфириновую простетическую группу, называемую гемом А и отличающуюся от гема цитохромов с и с1 (рис. 6-10). Он содержит формильную группу вместо одной из метальных групп и углеводородную цепь вместо одной из винильных групп.
Рис. 6-10. Строение гема А.
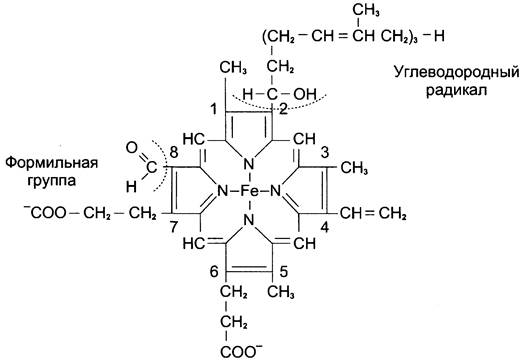
Другая особенность комплекса а-а3 — наличие в нём ионов меди, связанных с белковой частью в так называемых СuА-центрах. Перенос электронов комплексом а-а3 включает реакции:
Сu+ <-> Сu2+ + е,
Fе2+ <->Fе3+ + е.
Комплекс цитохромов а-а3 непосредственно реагирует с молекулярным кислородом. Некоторые характеристики компонентов ЦПЭ приведены в табл. 6-4.
Таблица 6-4. Компоненты митохондриальной цепи переноса электронов
Название компонента |
Простетическая группа |
Донор е |
Акцептор е |
NАDН-дегидрогеназа, комплекс I |
FMN, FeS |
NADH |
KoQ |
Коэнзим Q, убихинон |
Комплекс I |
Комплекс III (bc1) |
|
QН2-дегидрогеназа, комплекс III |
FeS, гем b1 (562), гем b2 (566),гем c1 |
QH2 |
Цитохром с |
Цитохром с |
Гем с |
Комплекс III |
Комплекс IV |
Цитохромоксидаза, комплекс IV |
Гем А Сu2+ |
Цитохром с |
O2 |
Сукцинатдегидрогеназа, комплекс II |
FAD, FeS |
Сукцинат |
KoQ |
Е. Организация дыхательной цепи в митохондриях
Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности (векторно). В этой последовательности их стандартные окислительно-восстановительные потенциалы становятся более положительными по мере приближения к кислороду (табл. 6-3, рис. 6-11).
Каждое звено этой цепи специфично в отношении донора и акцептора электронов.
На первом этапе дегидрогеназы катализируют отщепление водорода от различных субстратов. Если субстратами служат α-гидрокси- кислоты малат, изоцитрат, 3-гидроксибутират, водород переносится на NAD+. Образовавшийся NADH в дыхательной цепи, в свою очередь, окисляется NADН-дегидрогеназой (комплекс I).