БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 5. БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
V. Трансмембранная передача сигнала
Важное свойство мембран — способность воспринимать и передавать внутрь клетки сигналы из внешней среды. «Узнавание» сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора.
Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
✵ взаимодействие рецептора с сигнальной молекулой (первичным посредником);
✵ активация мембранного фермента, ответственного за образование вторичного посредника;
✵ образование вторичного посредника цАМФ, цЕМФ, ИФ3, ДАЕ или Са2+;
✵ активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказывают влияние на активность внутриклеточных процессов.
Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
А. Сигнальные молекулы —гормоны, медиаторы, эйкозаноиды, факторы роста, оксид азота (NO)
Сигнальными молекулами могут быть неполярные и полярные вещества. Неполярные вещества, например, стероидные гормоны, проникают в клетку, проходя через липидный бислой. Полярные сигнальные молекулы в клетку не проникают, но связываются специфическими рецепторами клеточных мембран. Такое взаимодействие вызывает цепь последовательных событий в самой мембране и внутри клетки. К полярным сигнальным молекулам относят белковые гормоны (например, глюкагон, инсулин, паратгормон), нейромедиаторы (например, ацетилхолин, глицин, y-аминомасляная кислота), факторы роста, цитокины, эйкозаноиды.
Б. Рецепторы
По локализации различают мембранные, цитоплазматические и ядерные рецепторы. По другой классификации все рецепторы можно разделить на быстроотвечающие (в пределах миллисекунд) и медленноотвечающие, в пределах нескольких минут или даже часов, что характерно для гормонов, передающих сигнал на внутриклеточные рецепторы. Рецепторы первого типа — интегральные олигомерные белки, содержащие субъединицу, имеющую центр для связывания сигнальной молекулы и центральный ионный канал (рис. 5-29).
Рис. 5-29. Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 — связанные с ионными каналами, например, рецептор ГАМК; 2 — с каталитической активностью (рецептор инсулина); 3 — передающие сигнал на фосфолипазу С, например, α1-адренорецептор; 4 — с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5 — передающие сигнал на аденилатциклазу, например, β-адренорецепторы; 6 — связывающие гормон в цитозоле или ядре, например рецептор кортизола.
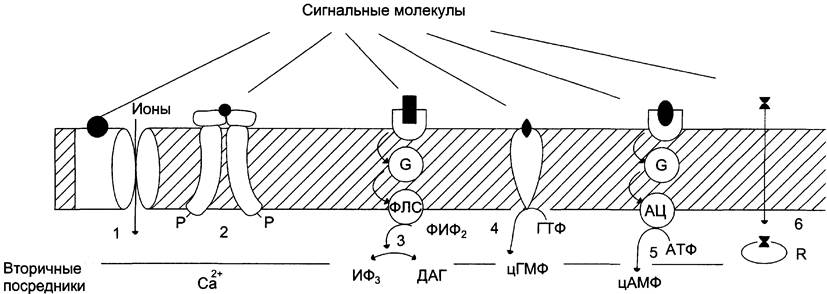
Рецепторы второго типа, локализованные в мембранах и не связанные с каналами, подразделяют на 2 большие группы: каталитические рецепторы, обладающие собственной тирозинкиназной или гуанилатциклазной активностью, и рецепторы, взаимодействующие через G-белок с мембранным ферментом. Связывание лиганда (например, гормона) с рецептором на наружной стороне клеточной мембраны приводит к изменению активности цитоплазматического фермента, который, в свою очередь, инициирует клеточный ответ, т. е. через мембрану переносится информация, а не заряды или какие- либо растворённые молекулы.
В случае цитоплазматических рецепторов через мембрану проходит гормон, а информация о присутствии гормона в клетке с помощью рецептора передаётся в ядро.
Различные клетки организма в зависимости от выполняемых ими функций имеют определённый набор рецепторов. В мембране одной клетки может быть более десятка разных типов рецепторов. Взаимодействуя с рецептором, внеклеточные химические посредники оказывают влияние на метаболизм и функциональное состояние (пролиферация, секреция и т. д.) клеток-мишеней.
1. Рецепторы адреналина — адренорецепторы
Адренорецепторы различают по распределению в организме — центральные и периферические. Центральные адренорецепторы, локализованные в различных областях мозга, участвуют в регуляции функций ЦНС, периферические — контролируют работу внутренних органов.
Все адренорецепторы классифицируют на два типа — α- и β-, но каждый тип имеет несколько подтипов, наиболее распространённые из них — α1-, α2-, β1,- и β2-рецепторы. В зависимости от своего анатомического расположения клетки одного типа, например, гладкомышечные клетки сосудов или адипоциты, содержат разные типы рецепторов.
Несмотря на значительное подобие между α- и β-рецепторами и их подтипами, они кодируются разными генами. Адренорецепторы принадлежат к семейству белков, имеющих 7 трансмембранных α-спиралей (которые принято называть доменами). Длина N- и С- концов, а также длина 1 — 4 доменов различается у разных типов и подтипов рецепторов (рис. 5-30).
Рис. 5-30. Мембранная организация β2-адренорецептора. 1 — фрагмент рецептора, участвующий в связывании G5-белка; 2, 3 — участки возможного фосфорилирования протеинкиназой А (2) и киназой β-адренорецептора (3); 4 — участок гликозилиро- вания; 5 — участок связывания адреналина.
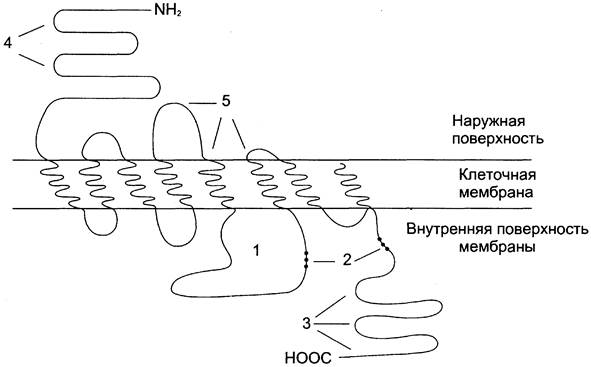
Адренорецепторы — гликопротеины, включающие в свой состав различные углеводные фрагменты. Гликозилированию подвергаются расположенные в области N-конца остатки аспарагиновой кислоты.
β-Адренорецепторы встречаются практически во всех тканях организма. Количество β-адренорецепторов, приходящееся на клетку, варьирует от 300 до 4000.
Центр связывания адреналина образован аминокислотными остатками третьего, пятого и шестого доменов. Другой функционально важный центр — область взаимодействия с G-белками, участвующими в формировании клеточного ответа. Остатки серина и треонина в области третьего внутреннего домена и С-конца адренорецептора могут фосфорилироваться под действием протеинкиназы А или специфической киназой β-адренорецептора. Фосфорилирование приводит к изменению конформации рецептора и снижению сродства к G-белку или препятствует связыванию с G-белком.
α-Адренорецепторы различают по локализации (например, гепатоциты имеют α1-рецепторы, адипоциты — α2-адренорецепторы) и механизму трансформации биологического сигнала. Эффекторные системы, связанные с α1- и α2- адренорецепторами, включают G-белки разного типа — Gрlс-белки (G-белок стимулирующий) и Gi-белки (G-белок ингибирующий) и соответственно ферменты — фосфолипазу С или аденилатциклазу.
2. Рецепторы с тирозинкиназной активностью
Тирозиновые протеинкиназы — ферменты, фосфорилирующие специфические белки по тирозину, подразделяют на 2 типа — мембранные (рецепторные) и цитоплазматические. Внутриклеточные тирозиновые протеинкиназы принимают участие в процессах передачи сигнала в ядро. Рецепторные тирозиновые протеинкиназы участвуют в трансмембранной передаче сигналов.
Примером рецепторной тирозиновой протеинкиназы может служить рецептор инсулина (рис. 5-31). Рецептор инсулина — тирозиновая протеинкиназа, фосфорилирующая белки по ОН-группам тирозина.
Рис. 5-31. Активация рецептора инсулина — тирозиновой протеинкиназы.
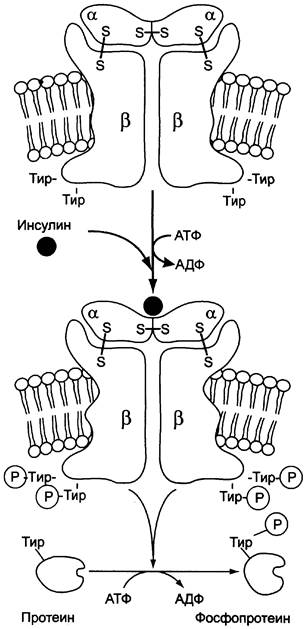
Рецептор состоит из двух α- и двух β-субъединиц, связанных дисульфидными связями и нековалентными взаимодействиями, α- и β-Субъединицы — гликопротеины с углеводной частью на наружной стороне мембраны. Вне мембраны на её поверхности находятся α-субъединицы. Центр связывания инсулина образован N-концевыми доменами α-субъединиц. β-Субъединицы пронизывают мембранный бислой и не участвуют в связывании инсулина.
Каталитический центр тирозиновой протеинкиназы находится на внутриклеточных доменах β-субъединиц. В отсутствие гормона инсулиновые рецепторы не проявляют тирозинкиназной активности. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причём субстратом служит сама тирозиновая протеинкиназа (β-субъединицы), т. е. происходит фосфорилирование β-субъединицы по нескольким тирозиновым остаткам. Фосфорилирование β-субъединиц происходит по механизму межмолекулярного трансфосфорилирования, т. е. одна β-цепь фосфорилирует другую p-цепь той же молекулы рецептора. Это, в свою очередь, приводит к изменению субстратной специфичности тирозиновой протеинкиназы; теперь она способна фосфорилировать другие внутриклеточные белки. Активация и изменение специфичности обусловлены конформационными изменениями рецептора инсулина после связывания гормона и аутофосфорилирования.
Ключевой белок, фосфорилируемый тирозиновой протеинкиназой, — субстрат инсулинового рецептора-1 (от англ. insulin receptor substrate, IRS-I). Фосфорилированный IRS-Iактивирует ферменты, например, тирозиновую фосфопротеинфосфатазу, и белки, участвующие в регуляции клеточных процессов.
Дефосфорилирование рецептора под действием тирозиновой фосфопротеинфосфатазы возвращает его в неактивное состояние. Сродство рецептора к инсулину снижается при его фосфорилировании протеинкиназой А по аминокислотным остаткам серина и треонина.
3. Рецепторы с гуанилатциклазной активностью
Гуанилатциклаза катализирует образование цГМФ из ГТФ, одного из важных посредников внутриклеточной передачи сигнала (рис. 5-32, 5-33). Гуанилатциклаза находится в клетке, как в мембранносвязанном состоянии, так и в цитозольном.
Рис. 5-32. Образование 3',5'-циклического ГМФ (цГМФ).
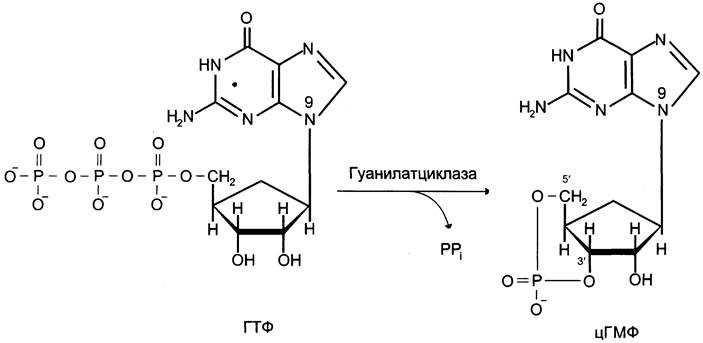
Рис. 5-33. Регуляция активности мембранной (1) и цитозольной (2) гуанилатциклазы.
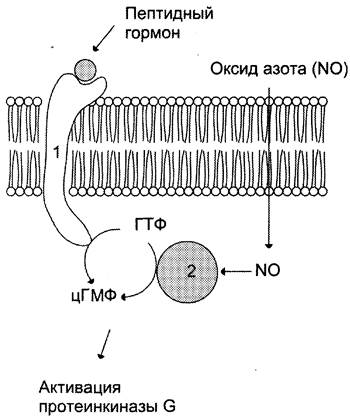
Соотношения этих двух форм фермента в различных тканях разное. Например, в клетках тонкого кишечника 90% гуанилатциклазы находится в мембранах, а в лёгких и печени — лишь 20%. Цитозольная и мембранносвязанная гуанилатциклазы различаются не только по локализации, но и по молекулярной массе, активности, способу регуляции.
Цитозольная форма гуанилатциклазы состоит из двух субъединиц (а и р) и содержит в своём составе простетическую группу — гем. В области гема связывается активатор этой формы гуанилатциклазы — оксид азота (NO), образующийся из аргинина под действием фермента синтазы оксида азота (см. раздел 9).
Мембранносвязанная гуанилатциклаза — трансмембранный гликопротеин. Внутриклеточный домен гуанилатциклазы проявляет каталитическую активность, внеклеточный домен служит рецептором. Присоединение активатора к рецептору вызывает изменение конформации в мембранном и цитозольном доменах и, как следствие, активацию гуанилатциклазы. В тканях человека присутствуют 3 типа мембранносвязанных гуанилатциклаз, в активации которых принимают участие специфические регуляторы — предсердный натрийуретический фактор (ПНФ), натрийуретический пептид из мозга и кишечный пептид гуанидин.
В клетках тканей выявлены 3 основных типа внутриклеточных рецепторных белков, с которыми взаимодействует цГМФ: цГМФ-зависимая протеинкиназа (протеинкиназа в), цГМФ-регу- лируемые ионные каналы и цГМФ-регулируемая фосфодиэстераза, специфичная к цАМФ (катализирует превращение цАМФ в АМФ).
цГМФ играет важную роль в регуляции Са2+- гомеостаза в различных типах клеток. Повышение концентрации цГМФ приводит к понижению концентрации Са2+ как в результате активации Са2+-АТФ-аз, так и за счёт подавления рецепторзависимого поступления этого иона в цитоплазму клетки. Эти эффекты опосредованы действием протеинкиназы G на мембранные белки, участвующие в обмене Са2+.
В. Структурно-функциональная организация G-белков
G-белки (ГТФ-связывающие белки) — универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мембраны, катализирующим образование вторичных посредников гормонального сигнала, G-белки — олигомеры, состоящие из α, β и y-субъединиц. Состав димеров βy незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βy-субъединиц. Поэтому G- белки принято различать по их α-субъединицам. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка, вследствие альтернативного сплайсинга РНК.
Каждая α-субъединица в составе G-белка имеет специфические центры:
✵ связывания ГТФ или ГДФ;
✵ взаимодействия с рецептором;
✵ связывания с βy-субъединицами;
✵ фосфорилирования под действием протеинкиназы С;
✵ взаимодействия с ферментом аденилатциклазой или фосфолипазой С.
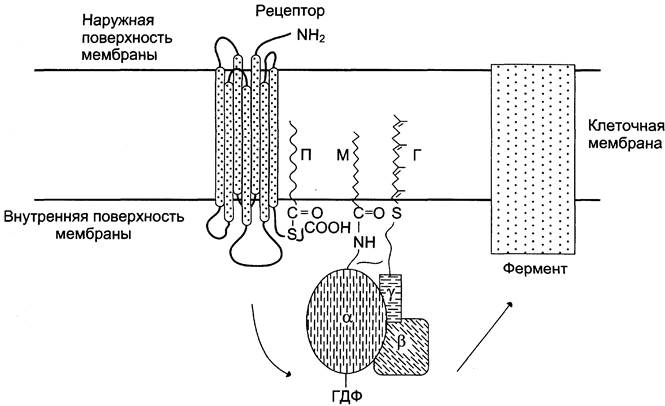
В структуре G-белков отсутствуют α-спиральные, пронизывающие мембрану домены, G-белки относят к группе «заякоренных» белков (рис. 5-34).
Рис. 5-34. Положение G-белков в мембране. Для ассоциации G-белков важно ацилирование α-протомеров алифатическими радикалами жирных кислот, миристиновой кислоты (М) или изопреновой. y-Субъединица G-белка имеет геранил-геранильную группу (Г), связанную тиоэфирной связью с остатком цистеина С-конца.
Регуляция активности G-белков
Различают неактивную форму G-белка — комплекс αβy-ГДФ и активированную форму αβy-ГТФ. Активация G-белка происходит при взаимодействии с комплексом активатор-рецептор, изменение конформации G-белка снижает сродство α-субъединицы к молекуле ГДФ и увеличивает к ГТФ. Замена ГДФ на ГТФ в активном центре G-белка нарушает комплементарность между α-ГТФ и βy-субъединицами. Рецептор, связанный с сигнальной молекулой, может активировать большое количество молекул G-белка, таким образом обеспечивая усиление внеклеточного сигнала на этом этапе (рис. 5-35).
Рис. 5-35. Цикл функционирования G-белка. — рецептор; Г — гормон; АЦ — аденилатциклаза.
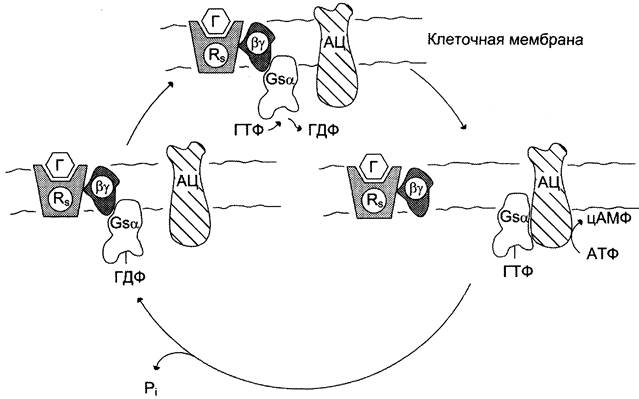
Активированная α-субъединица βy-белка (α-ГТФ) взаимодействует со специфическим белком клеточной мембраны и изменяет его активность. Такими белками могут быть ферменты аденилатциклаза, фосфолипаза С, фосфодиэстераза цГМФ, Nа+-каналы, К+-каналы.
Следующий этап цикла функционирования G-белка — дефосфорилирование ГТФ, связанного с α-субъединицей, причём фермент, катализирующий эту реакцию, — сама α-субъединица.
Дефосфорилирование приводит к образованию комплекса α-ГДФ, который не комплементарен специфическому белку мембраны (например, аденилатциклазе), но имеет высокое сродство к βy-протомерам. G-белок возвращается к неактивной форме — αβy-ГДФ. При последующей активации рецептора и замене молекулы ГДФ на ГТФ цикл повторяется снова. Таким образом, α-субъединицы G-белков совершают челночное движение, перенося стимулирующий или ингибирующий сигнал от рецептора, который активирован первичным посредником (например, гормоном), на фермент, катализирующий образование вторичного посредника.
Некоторые формы протеинкиназ могут фосфорилировать α-субъединицы G-белков. Фосфорилированная α-субъединица не комплементарна специфическому белку мембраны, например, аденилатциклазе или фосфолипазе С, поэтому не может участвовать в передаче сигнала.
Г. Аденилатциклаза
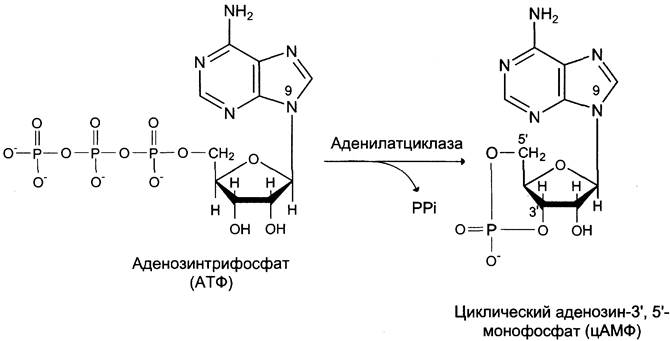
Фермент аденилатциклаза, катализирующий превращение АТФ в цАМФ (рис. 5-36), — ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток.
Рис. 5-36. Образование циклического аденозинмонофосфата (цАМФ).
Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 трансмембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Цитоплазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ — вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А.
На активность аденилатциклазы оказывают влияние как внеклеточные, так и внутриклеточные регуляторы. Внеклеточные регуляторы (гормоны, эйкозаноиды, биогенные амины) осуществляют регуляцию через специфические рецепторы, которые с помощью α-субъединиц G-белков передают сигналы на аденилатциклазу. αs-Субъединица (стимулирующая) при взаимодействии с аденилатциклазой активирует фермент, α-субъединица (ингибирующая) ингибирует фермент. В свою очередь, аденилатциклаза стимулирует проявление ГТФ-фосфатазной активности α-субъединиц. В результате дефосфорилирования ГТФ образуются субъединицы α-ГДФ и α-ГДФ, не комплементарные аденилатциклазе.
Из 8 изученных изоформ аденилатциклазы 4 — Са2+-зависимые (активируются Са2+). Регуляция аденилатциклазы внутриклеточным кальцием позволяет клетке интегрировать активность двух основных вторичных посредников цАМФ и Са2+.
Д. Фосфолипазы
Фосфолипазы — ферменты класса гидролаз, катализирующие катаболизм глицерофосфолипидов. Различают фосфолипазы секреторные, входящие в состав панкреатического сока, и клеточные фосфолипазы. Клеточные фосфолипазы А1, А2, D, С различаются по специфичности к отщепляемой группе. Все фосфолипазы — кальцийзависимые ферменты (рис. 5-37).
Рис. 5-37. Действие фосфолипаз.
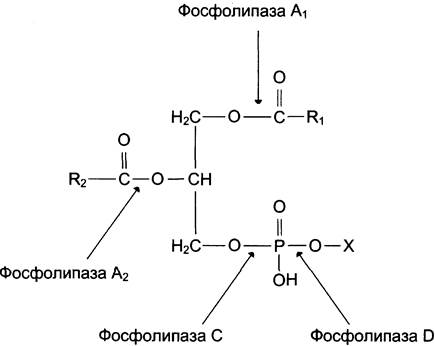
Фосфолипаза С — фермент, гидролизующий фосфоэфирную связь в глицерофосфолипидах. В клетках человека идентифицировано 10 изоформ фосфолипазы С, различающихся по молекулярной массе, локализации, способу регуляции, субстратной специфичности. В структуре всех изоформ фосфолипазы С отсутствуют гидрофобные домены, которые могли бы обеспечить их взаимодействие с мембраной. Однако некоторые формы фосфолипазы С связаны с мембраной с помощью гидрофобного «якоря» — ацильного остатка миристиновой кислоты или за счёт взаимодействия с поверхностью бислоя. Каталитическая активность всех изоформ фосфолипазы С зависит от ионов кальция.
Большинство фосфолипаз С специфично в отношении фосфатидилинозитолов и практически не гидролизует другие типы фосфолипидов. Активный фермент может гидролизовать до 50% от общего количества фосфатидилинозитолов клеточной мембраны. При гидролизе фосфатидилинозитол-4,5 -бисфосфата (ФИФ2) образуются продукты диацилглицерол (ДАГ) и инозитол-1,4,5-трифосфат (ИФ3), служащие вторичными посредниками в трансмембранной передаче сигнала по инозитолфосфатному пути.
Е. Протеинкиназы
Все полярные сигнальные молекулы, действующие на клетку-мишень через мембранные рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) протеинкиназы по аминокислотным остаткам серина, треонина, тирозина. Протеинкиназы могут быть субъединицей мембранного рецептора, например, тирозиновая протеинкиназа рецептора инсулина, активность которой регулируется гормоном. Другая группа — протеинкиназы, регулируемые вторичными вестниками гормонального сигнала (цАМФ, цГМФ, Са2+, ДАГ), например, протеинкиназа А, протеинкиназа С, протеинкиназа G, кальмодулинзависимые протеинкиназы и др.
1. Протеинкиназы А
Протеинкиназы А (цАМФ-стимулируемые) участвуют в аденилатциклазной системе передачи сигнала. Протеинкиназа А состоит из 4 субъединиц R2C2 — двух регуляторных субъединиц (R2) и двух каталитических (С2) (см. рис. 5-41). Комплекс R2С2 не обладает ферментативной активностью.
Комплекс R2C2 разными способами прикрепляется к мембране. Некоторые формы протеинкиназы А «заякориваются» с помощью алифатического остатка миристиновой кислоты каталитических субъединиц. Во многих тканях протеинкиназа А связана с «заякоренным» белком AKAPs (от англ. cAMP-dependent protein kinase anchoring proteins). AKAPs имеет центр связывания для регуляторных субъединиц протеинкиназы А. С помощью белка АКАРs протеинкиназа А связывается с мембраной в области локализации ферментов, катализирующих образование цАМФ (аденилатциклаза) или его гидролиз (фосфодиэстераза), а также белков, в регуляции активности которых фермент принимает участие, например потенциалзависимые Са2+-каналы.
Регуляторные субъединицы протеинкиназы А имеют специфические центры для связывания цАМФ. Присоединение цАМФ к регуляторным субъединицам приводит к изменению конформации последних и снижению сродства к каталитическим субъединицам С, происходит диссоциация по схеме:
цАМФ4 + R2C2 —> цАМФ4 + С + С
Субъединицы С представляют собой активную форму протеинкиназы А, которая катализирует реакции фосфорилирования белков по серину и треонину. Каталитические субъединицы С у разных типов протеинкиназ А не идентичны, они различаются прежде всего специфичностью в отношении белков-субстратов.
2. Протеинкиназы С
Протеинкиназы С участвуют в инозитолфосфатной системе передачи сигнала. Фермент состоит из двух функционально различных доменов — регуляторного и каталитического. Регуляторный домен содержит 2 структуры («цинковые пальцы»), образованные фрагментами пептидной цепи, богатыми цистеином, и содержащими 2 иона цинка (см. раздел 1). «Цинковые пальцы» участвуют в связывании диацилглицерола. Другой фрагмент регуляторного домена имеет высокое сродство к Са2+. Повышение концентрации кальция в цитозоле увеличивает сродство протеинкиназы С к фосфатидилсерину мембраны. Транслокация протеинкиназы С к мембране позволяет ферменту связаться с ДАГ, который ещё больше повышает сродство протеинкиназы С к ионам кальция (рис. 5-38). Наиболее распространённые изоформы протеинкиназы С активируются Са2+, диацилглицеролом и фосфатидилсерином.
Рис. 5-38. Регуляция активности протеинкиназы С (ПКС). ФС — фосфатидилсерин; ДАГ — диацилглицерол.
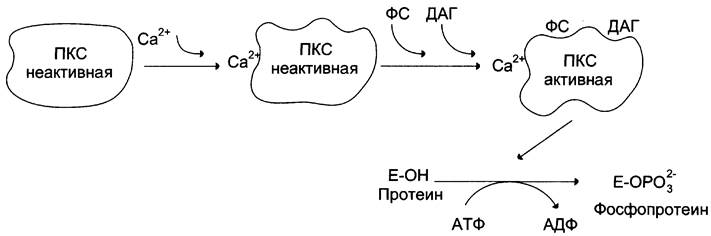
Каталитический домен имеет центр, связывающий АТФ и белок-субстрат. Активная форма фермента протеинкиназы С фосфорилирует белки по остаткам серина и треонина. Снижение концентрации ионов кальция в клетке нарушает связь протеинкиназы С с фосфатидилсерином и диацилглицеролом, фермент переходит в неактивную форму и отделяется от мембраны.
3. Протеинкиназы G
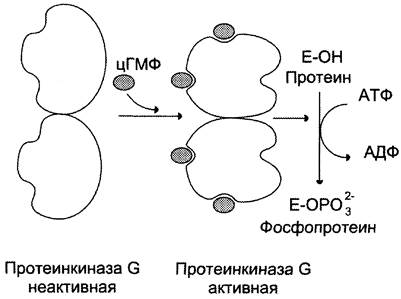
В отличие от протеинкиназы А, протеинкиназа G присутствует не во всех тканях, её обнаруживают в лёгких, мозжечке, гладких мышцах и тромбоцитах. Изоформы протеинкиназы G могут быть связаны с мембраной или находиться в цитоплазме. Растворимая протеинкиназа G состоит из двух идентичных субъединиц, каждая из которых имеет два центра для связывания цГМФ. Присоединение цГМФ к регуляторным центрам вызывает конформационные изменения субъединиц и повышает каталитическую активность фермента (рис. 5-39). Протеинкиназа G, подобно протеинкиназе А и С, специфична в отношении определённых белковых субстратов, которые она фосфорилирует по остаткам серина и треонина.
Рис. 5-39. Регуляция активности протеинкиназы G (ПКG).
Ж. Фосфодиэстеразы
Фосфодиэстеразы — ферменты, катализирующие превращение цАМФ (рис. 5-40) или цГМФ в неактивные метаболиты АМФ или ГМФ. Фосфодиэстеразы, снижая концентрации вторичных посредников, разрывают цепь превращений, вызванных активатором рецептора.
Рис. 5-40. Превращение цАМФ в АМФ.
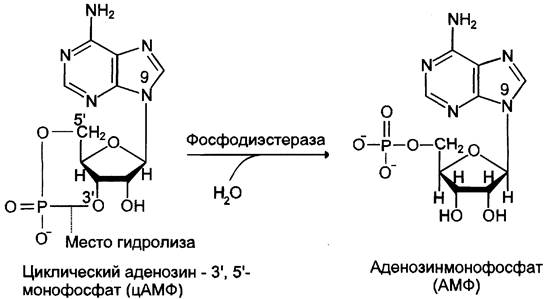
Фосфодиэстеразы присутствуют в клетках тканей в 2 формах: в форме растворимого белка и мембранносвязанного. Формы фермента, связанные с мембраной, в разных тканях составляют 5-40%. В одной и той же ткани могут присутствовать разные формы фосфодиэстеразы, различающиеся по сродству к субстратам, молекулярному весу, заряду, регуляторным свойствам и локализации в клетке.
Фосфодиэстеразы циклических нуклеотидов не обладают абсолютной специфичностью, поэтому, как правило, одна и та же форма фермента способна гидролизовать как цАМФ, так и цГМФ. Однако скорости гидролиза этих двух нуклеотидов под действием одной и той же фосфодиэстеразы могут значительно различаться. Это зависит от того, какая фосфодиэстераза присутствует в клетке — более специфичная в отношении цАМФ или более специфичная к цГМФ, от соотношения концентраций цАМФ и цГМФ в клетке и от действия регуляторов фосфодиэстеразы.
В большинстве тканей присутствует фосфодиэстераза-1, более специфичная к цАМФ, активируемая Са2+, комплексом 4 Са2+-кальмодулин и цГМФ.
З. Аденилатциклазная система
При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул — гормонов, нейромедиаторов, эйкозаноидов.
Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs- рецептор сигнальной молекулы, которая активирует аденилатциклазу, и Ri-рецептор сигнальной молекулы, которая ингибирует аденилатциклазу; Gs-стимулирующий и Gi-ингибирующий аденилатциклазу белки; ферменты аденилатциклаза (АЦ) и протеинкиназа А (ПКА) (рис. 5-41).
Рис. 5-41. Аденилатциклазная система.
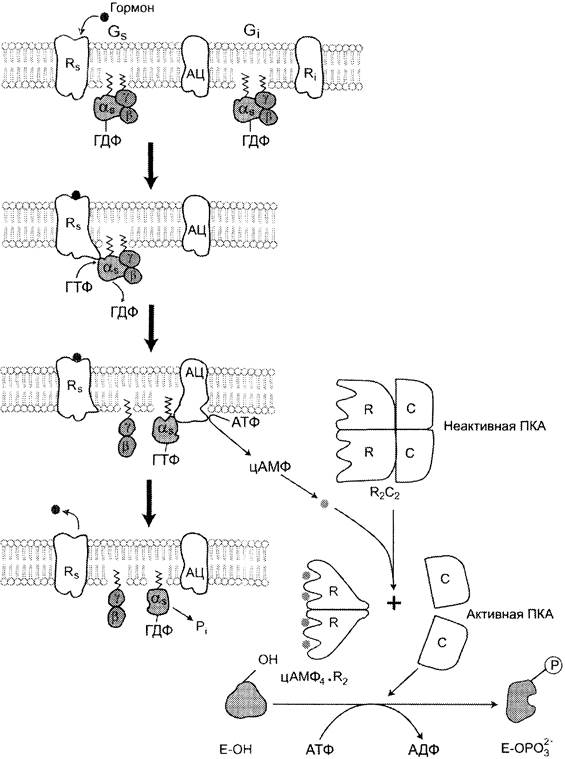
Последовательность событий, приводящих к активации аденилатциклазы:
✵ связывание активатора аденилатциклазной системы, например, гормона (Г) с рецептором (Rs), приводит к изменению конформации рецептора и увеличению его сродства к Gs-белку. В результате образуется комплекс [Г][R][G-ГДФ];
✵ присоединение [Г] [R] к G-ГДФ снижает сродство α-субъединицы Gs-белка к ГДФ и увеличивает сродство к ГТФ. ГДФ замещается на ГТФ;
✵ это вызывает диссоциацию комплекса. Отделившаяся субъединица а, связанная с молекулой ГТФ, обладает сродством к аденилатциклазе:
[Г][R][G-ГТФ] —> [Г][R] + α-ГТФ + βy;
✵ взаимодействие α-субъединицы с аденилатциклазой приводит к изменению конформации фермента и его активации, увеличивается скорость образования цАМФ из АТФ;
✵ конформационные изменения в комплексе [α-ГТФ] [АЦ] стимулируют повышение ГТФ- фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов реакции — неорганический фосфат (Рi) отделяется от α- субъединицы, а комплекс [α-ГДФ] сохраняется; скорость гидролиза определяет время проведения сигнала;
✵ образование в активном центре α-субъединицы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к βy-субъединицам. Gs-белок возвращается к неактивной форме;
✵ если рецептор связан с активатором, например, гормоном, цикл функционирования белка повторяется.
Активация протеинкиназы А (ПКА)
✵ Молекулы цАМФ могут обратимо соединяться с регуляторными субъединицами ПКА.
✵ Присоединение цАМФ к регуляторным субъединицам (R) вызывает диссоциацию комплекса С2R2 на комплекс цАМФ4R2 и С + С.
✵ Активная протеинкиназа А фосфорилирует специфические белки по серину и треонину, в результате изменяются конформация и активность фосфорилированных белков, а это приводит к изменению скорости и направления регулируемых ими процессов в клетке.
✵ Концентрация цАМФ в клетке может регулироваться, она зависит от соотношения активностей ферментов аденилатциклазы и фосфодиэстеразы.
Большую роль в регуляции внутриклеточной сигнальной системы играет белок АКАРs. «Заякоренный» белок АКАРs участвует в сборке ферментных комплексов, включающих не только протеинкиназу А, но и фосфодиэстеразу и фосфопротеинфосфатазу.
Каскадный механизм усиления и подавления сигнала. Передача сигнала от мембранного рецептора через G-белок на фермент аденилатцикла- зу служит примером каскадной системы усиления этого сигнала. Одна молекула, активирующая рецептор, может «включать» несколько G-белков, и затем каждый активирует несколько мо
лекул аденилатциклазы с образованием тысяч молекул цАМФ. На этом этапе сигнал усиливается в 102 — 103 раз. Образующийся цАМФ «включают» другой фермент — протеинкиназу А, усиливая сигнал ещё в 1000 раз. Фосфорилирование ферментов протеинкиназой А ещё больше усиливает сигнал, в результате суммарное усиление равно 106— 107 раз. Таким образом, по механизму каскадного усиления одна молекула регулятора способна изменить активность миллионов других молекул.
Но для любой из систем трансмембранной передачи сигнала клетка имеет другую систему, подавляющую этот сигнал. Каждый из этапов в ферментном каскаде находится под контролем специальных подавляющих этот сигнал механизмов. Например, длительное действие гормона приводит к десенсибилизации мембранных рецепторов: они либо инактивируются, либо вместе с гормоном погружаются в клетку посредством эндоцитоза. В результате десенсибилизации рецепторов степень активации аденилатциклазной системы снижается. Если в клетке длительное время повышена концентрация цАМФ (повышена активность протеинкиназы А), может происходить фосфорилирование кальциевых каналов, что приводит к повышению концентрации Са2+ в клетке. Кальций активирует Са2+-зависимую фосфодиэстеразу, катализирующую превращение цАМФ в АМФ. В результате инактивации протеинкиназы А (R2C2) снижается скорость фосфорилирования специфических ферментов. Завершает «выключение» системы фосфопротеинфосфатаза, дефосфорилирующая фосфопротеины.
Влияние бактериальных токсинов на активность аденилатциклазы (АДФ-рибозилирование G-белков)
Для изучения функционирования G-белков аденилатциклазной системы были использованы экзогенные бактериальные яды — холерный и коклюшный токсины. Токсины в экспериментальных условиях повышают активность аденилатциклазы практически во всех клетках организма; так, холерный токсин может стимулировать секрецию тиреоидных гормонов клетками щитовидной железы, стероидных гормонов клетками надпочечников, распад жиров в жировых клетках. Реакция разных клеток на холерный токсин вызвана повышением уровня цАМФ в этих клетках.
Холерный токсин — олигомерный белок. Одна из субъединиц — фермент АДФ-рибозилтрансфераза; проникая в клетку, она катализирует присоединение АДФ-рибозы к α-субъединице комплекса [αs-ГТФ] [АЦ] (этап активации аденилатциклазы).
НАD+ + [αs-ГТФ] [АЦ] —> [АДФ-рибозил-αs- ГТФ] [АЦ] + никотинамид + Н+.
АДФ-рибозилирование ингибирует проявление ГТФ-фосфатазной активности α-субъединицы, не происходит дефосфорилирование ГТФ. Цикл функционирования Gs-белка останавливается на этапе активации фермента аденилатциклазы, отвечающего за образование цАМФ из АТФ. Фермент аденилатциклаза сохраняет повышенную активность в течение длительного времени.
Субъединица коклюшного токсина, проникая в клетку, катализирует АДФ-рибозилирование αi-субъединицы активированного Gi -белка (αiβy-ГТФ).
NАD+ + [αiβy-ГТФ] —> [АДФ-рибозил- αiβy- ГТФ] + никотинамид + Н+.
Модифицированная α-субъединица сохраняет высокое сродство к βy-субъединицам, т. е. Gi-белок теряет способность диссоциировать на α-ГТФ и βy-субъединицы. Таким образом, ингибирующий сигнал (α-ГТФ) не достигает аденилатциклазы, значит в этом случае возможна только её активация при связывании с αs-ГТФ. Действие коклюшного токсина на клетки тканей всегда приводит к повышению уровня цАМФ.
Симптомы холеры и коклюша развиваются в результате действия токсинов, вырабатываемых соответствующими микроорганизмами.
И. Инозитолфосфатная система
Функционирование инозитолфосфатной системы трансмембранной передачи сигнала (рис. 5-42) обеспечивают: R (рецептор), фосфолипаза С, Gрlс — белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля.
Рис. 5-42. Инозитолфосфатная система.
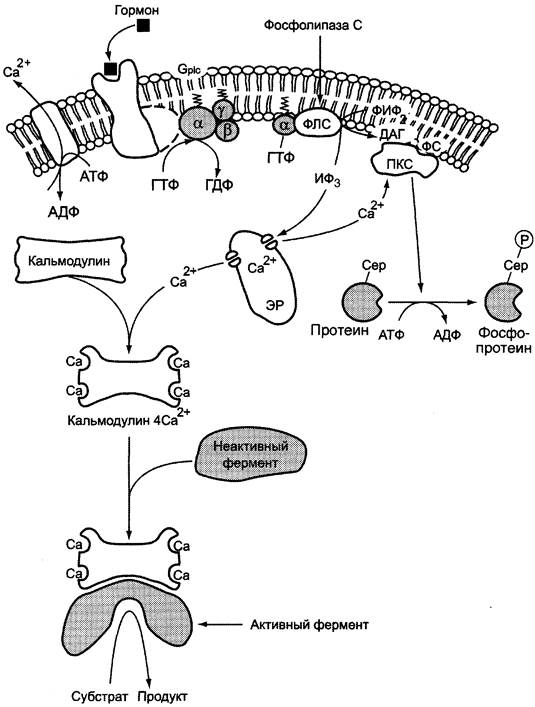
Последовательность событий, приводящих к активации фосфолипазы С:
✵ связывание сигнальной молекулы, например, гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Срlс-белку.
✵ образование комплекса [Г] [R] [Gрlс-ГДФ] приводит к снижению сродства α-протомера Gрlс-белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ.
✵ это вызывает диссоциацию комплекса; отделившаяся α-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С.
✵ α-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфолипазы-С происходит гидролиз липида мембраны фосфатидилинозигол-4,5-бисфосфата(ФИФ2).
✵ в ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол- 1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС).
✵ инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са2+-канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала — Са2+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
Активация протеинкиназы С
✵ Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС) и белком кальмодулином, таким образом сигнал, принятый рецептором клетки, раздваивается.
✵ Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций- опосредованное взаимодействие с молекулами «кислого» фосфолипида мембраны, фосфатидилсерина (ФС). Диацилглицерол, занимая специфические центры в протеин- киназе С, ещё более увеличивает её сродство к ионам кальция.
✵ На внутренней стороне мембраны образуется ферментативный комплекс — [ПКС] [Са2+] [ДАГ] [ФС] — активная протеинкиназа С, фосфорилирующая специфические ферменты по серину и треонину.
Участие белка кальмодулина в инозитолфосфатной передаче сигнала
В клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са2+, он имеет 4 центра для связывания Са2+. Комплекс [кальмодулин] - [4 Са2+] не обладает ферментативной активностью, но взаимодействие комплекса с различными белками и ферментами приводит к их активации.
Саморегуляция системы
Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАГ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилированием протеинкиназой С.
Концентрация Са2+ в клетке снижается до исходного уровня при действии Са2+ -АТФ-аз цитоплазматической мембраны и ЭР, а также Na+/Са2+- и Н+/Са2+-транслоказ (активный антипорт) клеточной и митохондриальной мембран.
Функционирование транслоказ Са2+ и Са2+- АТФ-аз может активироваться:
✵ комплексом [кальмодулин] [4 Са2+];
✵ протеинкиназой А (фосфорилированием);
✵ протеинкиназой С (фосфорилированием).
Понижение концентрации Са2+ в клетке и диацилглицерола в мембране приводит к изменению конформации протеинкиназы С, снижению её сродства к фосфатидилсерину, фермент диссоциирует в цитозоль (неактивная форма).
Фосфорилированные протеинкиназой С ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму.
К. Передача сигнала с помощью внутриклеточных рецепторов
Передача сигнала липидорастворимых стероидных гормонов и тироксина возможна только при прохождении этих гормонов через плазматическую мембрану клеток-мишеней (рис. 5-43).
Рис. 5-43. Передача сигнала на внутриклеточные рецепторы.
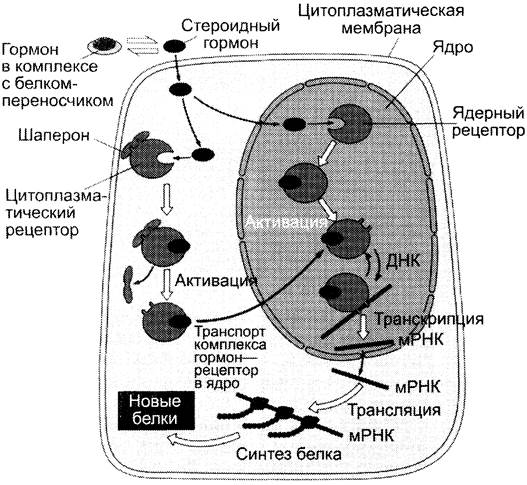
Рецепторы гормонов могут находиться в цитозоле или в ядре. Цитозольные рецепторы связаны с белком-шапероном (часто это группа белков- шаперонов). Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНК-связывающий домен, характеризующийся наличием двух структур «цинковых пальцев».
Последовательность событий, приводящих к активации транскрипции:
✵ гормон проходит через двойной липидный слой клеточной мембраны.
✵ взаимодействие гормона с рецептором (R) приводит к изменению конформации рецептора и снижению сродства к белкам-шаперонам, отделяющимся от комплекса гормон- рецептор.
✵ комплекс гормон—рецептор проходит в ядро, взаимодействует с регуляторной нуклеотидной последовательностью в ДНК — энхансером или сайленсером.
✵ увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы.
✵ соответственно увеличивается или уменьшается скорость транскрипции структурных генов.
✵ увеличивается или уменьшается скорость трансляции.
✵ изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки.
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуются часы.
Л. Специфичность сигнализации
Для исследователей, имеющих представление о количестве сигнальных молекул, о соответствующем количестве рецепторов, о трансмембранных системах передачи сигналов, вторичных посредниках, остаётся загадкой, как протеинкиназы выбирают соответствующий фермент метаболического пути для фосфорилирования. Исследователи для объяснения этого явления предлагают «гипотезу мишени» (от англ. targeting hypothesis). По этой гипотезе специфичность протеинкиназ и фосфопротеинфосфагаз достигается путём образования компартментов на мембране, в состав которых входят не только сами протеинкиназы и фосфопротеинфосфатазы, но и специфические белки-субстраты. Наличие остатка миристиновой или пальмитиновой кислоты в структуре белков- субстратов — условие их «заякори ван ия» в соответствующем мембранном компартменте.
Однако в большинстве случаев процесс активации какого-либо метаболического процесса находится под контролем не одной, а нескольких систем внутриклеточной сигнализации, поэтому важным фактором ответа клеток служит взаимосвязь этих систем.