БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 8. ОБМЕН ЛИПИДОВ
IX. Холестерол: функции, обмен
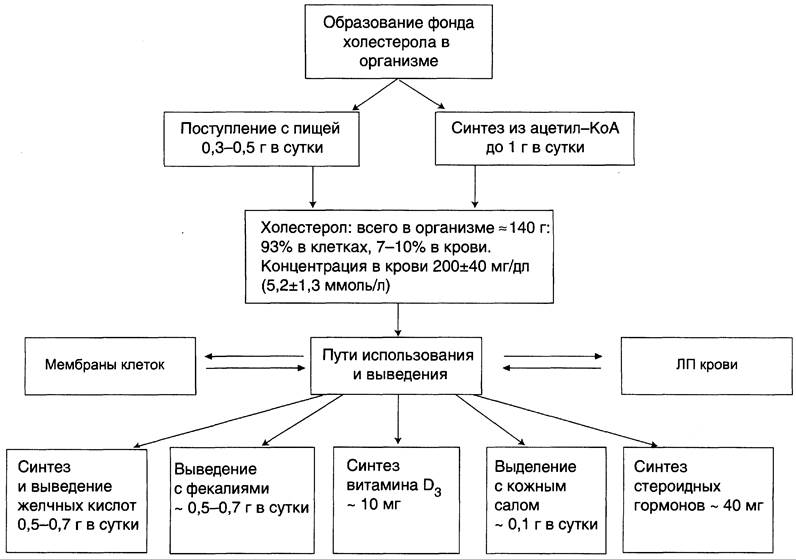
Холестерол — стероид, характерный только для животных организмов. Он синтезируется во многих тканях человека, но основное место синтеза — печень. В печени синтезируется более 50% холестерола, в тонком кишечнике — 15 — 20%, остальной холестерол синтезируется в коже, коре надпочечников, половых железах. В сутки в организме синтезируется около 1 г холестерола; с пищей поступает 300 — 500 мг (рис. 8-65). Холестерол выполняет много функций: входит в состав всех мембран клеток и влияет на их свойства, служит исходным субстратом в синтезе жёлчных кислот и стероидных гормонов. Предшественники в метаболическом пути синтеза холестерола превращаются также в убихинон — компонент дыхательной цепи и долихол, участвующий в синтезе гликопротеинов. Холестерол за счёт своей гидроксильной группы может образовывать эфиры с жирными кислотами. Этерифицированный холестерол преобладает в крови и запасается в небольших количествах в некоторых типах клеток, использующих его как субстрат для синтеза других веществ. Холестерол и его эфиры — гидрофобные молекулы, поэтому они транспортируются кровью только в составе разных типов ЛП. Обмен холестерола чрезвычайно сложен — только для его синтеза необходимо осуществление около 100 последовательных реакций. Всего в обмене холестерола участвует около 300 разных белков. Нарушения обмена холестерола приводят к одному из наиболее распространённых заболеваний — атеросклерозу. Смертность от последствий атеросклероза (инфаркт миокарда, инсульт) лидирует в общей структуре смертности населения. Атеросклероз — «полиген-
ное заболевание», т. е. в его развитии участвуют многие факторы, важнейшие из которых наследственные. Накопление холестерола в организме приводит к развитию и другого распространённого заболевания — желчнокаменной болезни.
Рис. 8-65. Фонд холестерола в организме, пути его использования и выведения.
А. Синтез холестерола и его регуляция
Реакции синтеза холестерола происходят в цитозоле клеток. Это один из самых длинных метаболических путей в организме человека.
Образование мевалоната
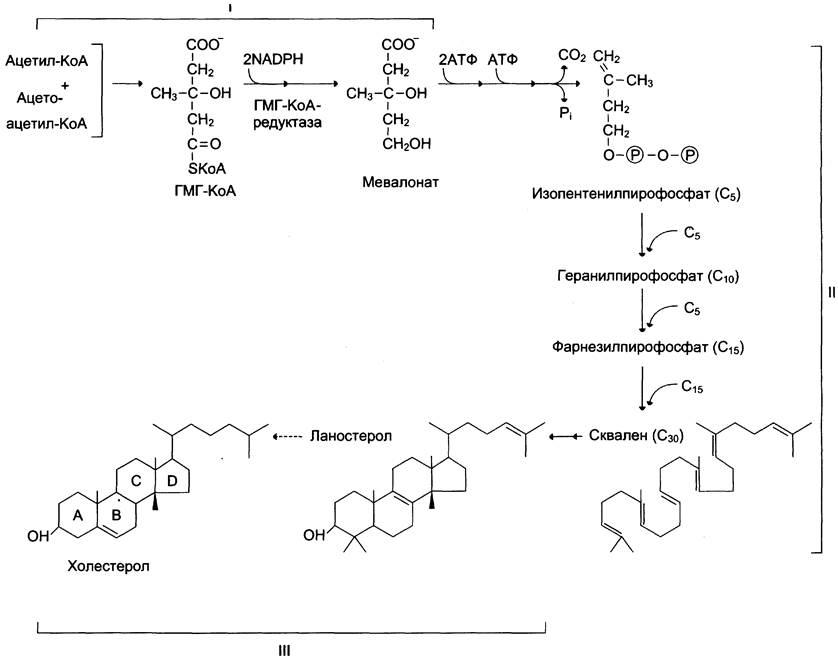
Сложный путь синтеза холестерола можно разделить на 3 этапа (рис. 8-66). Первый этап заканчивается образованием мевалоната (мевалоновой кислоты). Две молекулы ацетил-КоА конденсируются ферментом тиолазой с образованием ацетоацетил-КоА. Фермент гидроксиметилглутарил- КоА-синтаза присоединяет третий ацетильный остаток с образованием ГМГ-КоА (3-гидрокси- 3-метилглутарил-КоА). Эта последовательность реакций сходна с начальными стадиями синтеза кетоновых тел (см. рис. 8-33). Однако реакции синтеза кетоновых тел происходят в митохондриях печени, а реакции синтеза холестерола — в цитозоле клеток.
Рис. 8-66. Синтез холестерола. С5 — изопентенилпирофосфат; С15 — фарнезилпирофосфат. Все атомы углерода холестерола происходят из ацетил-КоА. Сквален — углеводород линейной структуры — превращается ферментом циклазой в ланостерол, содержащий 4 конденсированных кольца и гидроксильную группу. Ланостерол через ряд последовательных реакций превращается в холестерол (I, II, III — этапы синтеза).
Следующая реакция, катализируемая ГМГ- КоА-редуктазой, является регуляторной в метаболическом пути синтеза холестерола. В этой реакции происходит восстановление ГМГ-КоА до мевалоната с использованием 2 молекул NАDРН. Фермент ГМГ-КоА-редуктаза — гликопротеин, пронизывающий мембрану ЭР, активный центр которого выступает в цитозоль.
Образование сквалена
На втором этапе синтеза мевалонат превращается в пятиуглеродную йзопреноидную структуру, содержащую пирофосфат — изопентенил- пирофосфат. Продукт конденсации 2 изопреновых единиц — геранилпирофосфат. Присоединение ещё 1 изопреновой единицы приводит к образованию фарнезилпирофосфата — соединения, состоящего из 15 углеродных атомов. Две молекулы фарнезилпирофосфата конденсируются с образованием сквалена — углеводорода линейной структуры, состоящего из 30 углеродных атомов.
Образование холестерола
На третьем этапе синтеза холестерола сквален через стадию образования эпоксида ферментом циклазой превращается в молекулу ланостерола, содержащую 4 конденсированных цикла и 30 атомов углерода. Далее происходит 20 последовательных реакций, превращающих ланостерол в холестерол. На последних этапах синтеза от ланостерола отделяется 3 атома углерода, поэтому холестерол содержит 27 углеродных атомов. У холестерола имеется насыщенная разветвлённая боковая цепь из 8 углеродных атомов в положении 17, двойная связь в кольце В между атомами углерода в положениях 5 и 6, а также гидроксильная группа в положении 3.
В организме человека изопентенилпирофосфат также служит предшественником убихинона (КоQ) и долихола, участвующего в синтезе гликопротеинов.
Этерификация холестерола
В некоторых тканях гидроксильная группа холестерола этерифицируется с образованием более гидрофобных молекул — эфиров холестерола. Реакция катализируется внутриклеточным ферментом АХАТ (ацилКоА: холестеролацилтрансферазой).
Реакция этерификации происходит также в крови в ЛПВП, где находится фермент ЛХАТ (лецитин: холестеролацилтрансфераза). Эфиры холестерола — форма, в которой они депонируются в клетках или транспортируются кровью. В крови около 75% холестерола находится в виде эфиров.
Регуляция синтеза холестерола
Регуляция ключевого фермента синтеза холестерола (ГМГ-КоА-редуктазы) происходит разными способами.
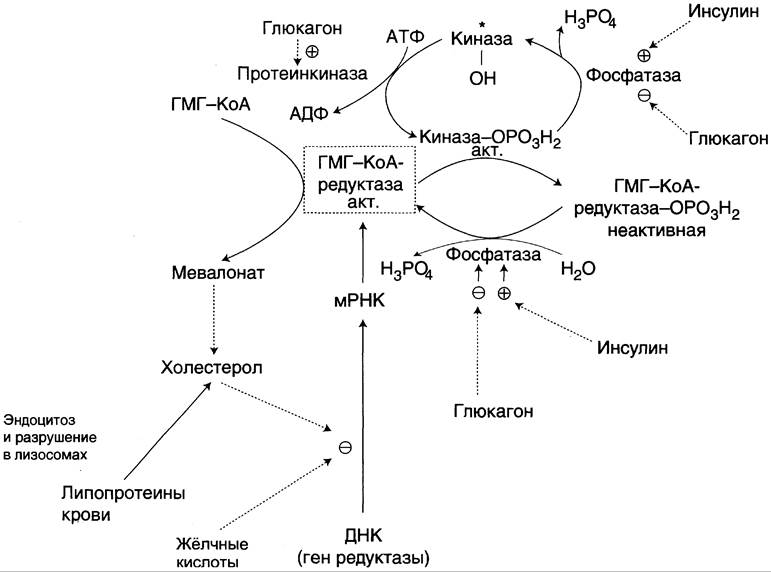
Фосфорилирование/дефосфорилирование ГМГ- КоА-редуктазы (рис. 8-67). При увеличении соотношения инсулин/глюкагон этот фермент дефосфорилируется и переходит в активное состояние. Действие инсулина осуществляется через 2 фермента: фосфатазу киназы ГМГ-КоА-редуктазы, которая превращает киназу в неактивное дефосфорилированное состояние; фосфатазу ГМГ-КоА-редуктазы путём превращения её в дефосфорилированное активное состояние. Результатом этих реакций служит образование дефосфорилированной активной формы ГМГ-КоА-редуктазы.
Рис. 8-67. Регуляция активности ГМГ-КоА-редуктазы в печени. Холестерол и жёлчные кислоты снижают скорость транскрипции и, таким образом, синтез фермента. Инсулин стимулирует дефосфорилирование, а глюкагон — фосфорилирование ГМГ- КоА-редуктазы. Инсулин активирует 2 фосфатазы: киназы ГМГ-КоА-редуктазы* и фосфатазу, дефосфорилирующую непосредственно ГМГ-КоА-редуктазу. Глюкагон стимулирует фосфорилирование и инактивацию 2 фосфатаз и фосфорилирование и активацию киназы ГМГ-КоА-редуктазы.
Следовательно, в абсорбтивный период синтез холестерола увеличивается. В этот период увеличивается и доступность исходного субстрата для синтеза холестерола — ацетил-КоА (в результате приёма пищи, содержащей углеводы и жиры, так как ацетил-КоА образуется при распаде глюкозы и жирных кислот).
В постабсорбтивном состоянии глюкагон через протеинкиназу А стимулирует фосфорилирование ГМГ-КоА-редуктазы, переводя её в неактивное состояние. Это действие усиливается тем, что одновременно глюкагон стимулирует фосфорилирование и инактивацию фосфатазы ГМГ-КоА-редуктазы и фосфорилирование киназы ГМГ-КоА-редуктазы, удерживая, таким образом, ГМГ-КоА- редуктазу в фосфорилированном неактивном состоянии. В результате синтез холестерола в постабсорбтивном периоде и при голодании ингибируется.
Ингибирование синтеза ГМГ-КоА-редуктазы.
Конечный продукт метаболического пути (холестерол) снижает скорость транскрипции гена ГМГ-КоА-редуктазы, подавляя таким образом собственный синтез. В печени активно идёт синтез жёлчных кислот из холестерола, поэтому и жёлчные кислоты (как конечные продукты синтеза) подавляют активность гена ГМГ-КоА-редуктазы (рис. 8-67). Так как молекула ГМГ-КоА-редуктазы существует около 3 ч после синтеза, то ингибирование синтеза этого фермента конечным продуктом метаболического пути (холестеролом) является эффективной регуляцией.
Б. Транспорт холестерола липопротеинами крови
Холестерол транспортируется кровью только в составе ЛП. ЛП обеспечивают поступление в ткани экзогенного холестерола, определяют потоки холестерола между органами и выведение избытка холестерола из организма.
Транспорт экзогенного холестерола
Холестерол поступает с пищей в количестве 300 — 500 мг/сут, в основном в виде эфиров. После гидролиза, всасывания в составе мицелл, этерификации в клетках слизистой оболочки кишечника эфиры холестерола и небольшое количество свободного холестерола включаются в состав ХМ и поступают в кровь. После удаления жиров из ХМ под действием ЛП-липазы холестерол в составе остаточных ХМ доставляется в печень. Остаточные ХМ взаимодействуют с рецепторами клеток печени и захватываются по механизму эндоцитоза. Затем ферменты лизосом гидролизуют компоненты остаточных ХМ, и в результате образуется свободный холестерол. Экзогенный холестерол, поступающий таким образом в клетки печени, может ингибировать синтез эндогенного холестерола, замедляя скорость синтеза ГМГ-КоА- редуктазы.
Транспорт эндогенного холестерола в составе ЛПОНП (пре-β-липопротеинов)
Печень — основное место синтеза холестерола. Эндогенный холестерол, синтезированный из исходного субстрата ацетил-КоА, и экзогенный, поступивший в составе остаточных ХМ, образуют в печени общий фонд холестерола. В гепатоцитах триацилглицеролы и холестерол упаковываются в ЛПОНП. В их состав входят, кроме того, апопротеин В-100 и фосфолипиды. ЛПОНП секретируются в кровь, где получают от ЛПВП апопротеины Е и С-II. В крови на ЛПОНП действует ЛП-липаза, которая, как и в ХМ, активируется апоС-Н и гидролизует жиры до глицерола и жирных кислот. По мере уменьшения количества ТАГ в составе ЛПОНП они превращаются в ЛППП. Когда количество жиров в ЛППП уменьшается, апопротеины С-II переносятся обратно на ЛПВП. Содержание холестерола и его эфиров в ЛППП достигает 45%; часть этих липопротеинов захватывается клетками печени через рецепторы ЛПНП, которые взаимодействуют и с апоЕ и с апоВ-100.
Транспорт холестерола в составе ЛПНП.
Рецепторы ЛПНП
На ЛППП, оставшиеся в крови, продолжает действовать ЛП-липаза, и они превращаются в ЛПНП, содержащие до 55% холестерола и его эфиров. Апопротеины Е и С-IIпереносятся обратно в ЛПВП. Поэтому основным апопротеи- ном в ЛПНП служит апоВ-100. Апопротеин В-100 взаимодействует с рецепторами ЛПНП и таким образом определяет дальнейший путь холестерола. ЛПНП — основная транспортная форма холестерола, в которой он доставляется в ткани. Около 70% холестерола и его эфиров в крови находится в составе ЛПНП. Из крови ЛПНП поступают в печень (до 75%) и другие ткани, которые имеют на своей поверхности рецепторы ЛПНП.
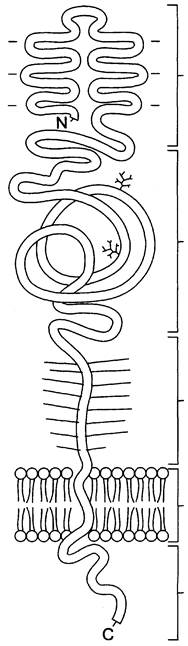
Рецептор ЛПНП — сложный белок, состоящий из 5 доменов и содержащий углеводную часть (рис. 8-68).
Рис. 8-68. Структура рецептора ЛПНП. Белок-рецептор состоит из 5 доменов. N — концевой домен, непосредственно связывает ЛПНП. Два других домена (связаны с олигосахаридами), выступающих на поверхности клетки, обеспечивают необходимую конформацию N-концевого домена ЛПНП.
Рецепторы ЛПНП синтезируются в ЭР и аппарате Гольджи, а затем экспонируются на поверхности клетки, в специальных углублениях, выстланных белком клатрином. Эти углубления называют окаймлёнными ямками (рис. 8-69). Выступающий на поверхность N-концевой домен рецептора взаимодействует с белками апоВ-100 и апоЕ; поэтому он может связывать не только ЛПНП, но и ЛППП, ЛПОНП, остаточные ХМ, содержащие эти апопротеины. Клетки тканей содержат большое количество рецепторов ЛПНП на своей поверхности: например, на одной клетке фибробласта имеется от 20 000 до 50 000 рецепторов. Из этого следует, что холестерол поступает в клетки из крови в основном в составе ЛПНП.
Рис. 8-69. Синтез рецепторов ЛПНП и их последующие превращения. После взаимодействия ЛПНП с рецептором (1) окаймлённые ямки вместе с рецептором и ЛПНП поглощаются по механизму эндоцитоза (2). В образовавшейся эндосоме снижается значение pH за счёт работы протонного насоса, использующего энергию АТФ. При снижении pH рецепторы ЛПНП отделяются от ЛПНП (3), и большая часть рецепторов возвращается в плазматическую мембрану (5). Таким образом, рецепторы ЛПНП могут многократно использоваться клеткой. После удаления рецептора ЛПНП эндосомы сливаются с лизосомами, и гидролитические ферменты лизосом расщепляют компоненты эндосом (4). В результате освобождается холестерол, который может быть использован для формирования структуры мембран, в клетках печени для синтеза жёлчных кислот, в клетках эндокринной системы для синтеза стероидных гормонов.
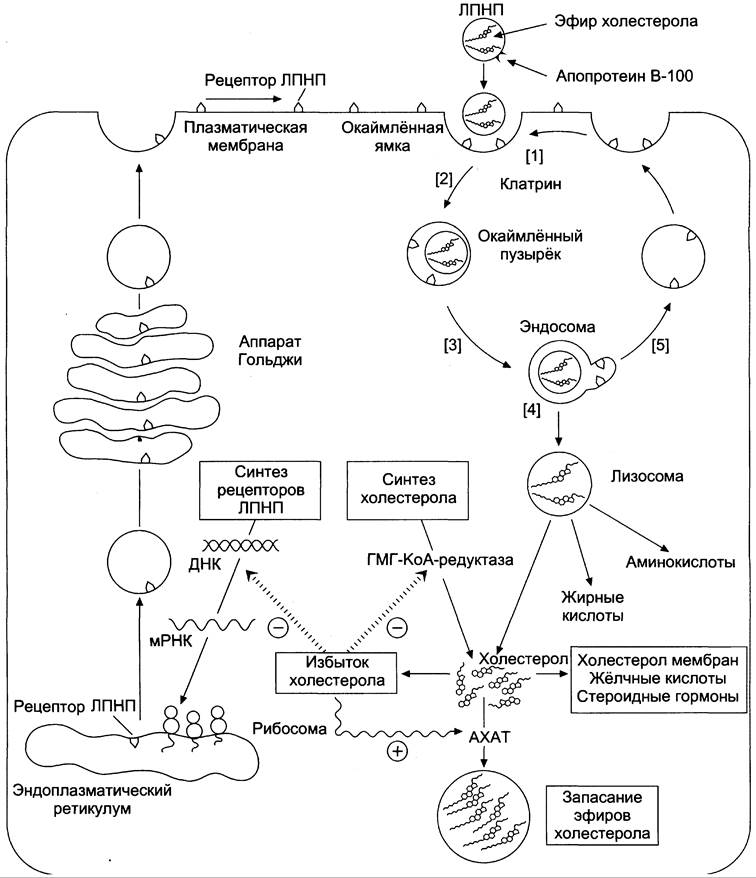
Если количество холестерола, поступающего в клетку, превышает её потребность, то синтез рецепторов ЛПНП подавляется, что уменьшает поток холестерола из крови в клетки. При снижении концентрации свободного холестерола в клетке, наоборот, активируется синтез ГМГ- КоА-редуктазы и рецепторов ЛПНП.
В регуляции синтеза рецепторов ЛПНП участвуют гормоны: инсулин и трийодтиронин (Т3), половые гормоны. Они увеличивают образование рецепторов ЛПНП, а глюкокортикоиды (в основном кортизол) уменьшают. Эффекты инсулина и Т3, вероятно, могут объяснить механизм гиперхолестеролемии и увеличение риска атеросклероза при сахарном диабете или гипотиреозе.
Другие пути поступления холестерола в клетки
Кроме рецепторов ЛПНП, на поверхности клеток многих органов (печени, мозга, плаценты) имеется другой тип рецептора, называемый «белком, сходным с рецептором ЛПНП». Этот рецептор взаимодействует с апоЕ и захватывает ремнантные (остаточные) ХМ и ЛППП. Основной функцией этих рецепторов, вероятно, является «очистка» плазмы крови от ремнантных частиц. Так как ремнантные частицы содержат холестерол, этот тип рецепторов также обеспечивает поступление его в ткани.
Кроме поступления холестерола в ткани путём эндоцитоза ЛП, некоторое количество холестерола поступает в клетки путём диффузии из ЛПНП и других ЛП при их контакте с мембранами клеток.
Роль ЛПВП в обмене холестерола
ЛПВП выполняют 2 основные функции: они поставляют апопротеины другим ЛП в крови и участвуют в так называемом «обратном транспорте холестерола». ЛПВП синтезируются в печени и в небольшом количестве в тонком кишечнике в виде «незрелых липопротеинов» — предшественников ЛПВП. Они имеют дисковидную форму, небольшой размер и содержат высокий процент белков и фосфолипидов. В печени в ЛПВП включаются апопротеины А, Е, С-II, фермент ЛХАТ. В крови апоС-II и апоЕ переносятся с ЛПВП на ХМ и ЛПОНП. Предшественники ЛПВП практически не содержат холестерола и ТАГ и в крови обогащаются холестеролом, получая его из других ЛП и мембран клеток.
Для переноса холестерола в ЛПВП существует сложный механизм. На поверхности ЛПВП находится фермент ЛХАТ — лецитин: холестеролацилтрансфераза. Этот фермент превращает холестерол, имеющий гидроксильную группу, выступающую на поверхность липопротеинов или мембран клеток, в эфиры холестерола. Радикал жирной кислоты переносится от фосфатидилхолина (лецитина) на гидроксильную группу холестерола. Реакция активируется апопротеином А-I, входящим в состав ЛПВП.
Гидрофобная молекула эфира холестерола перемещается внутрь ЛПВП. Таким образом, частицы ЛПВП обогащаются эфирами холестерола. ЛПВП увеличиваются в размерах, из дисковидных небольших частиц превращаются в частицы сферической формы, которые называют ЛПВП3, или «зрелые ЛПВП». ЛПВП3 частично обменивают эфиры холестерола на триацилглицеролы, содержащиеся в ЛПОНП, ЛППП и ХМ (рис. 8-70). В этом переносе участвует «белок, переносящий эфиры холестерина» (он также называется апоD). Таким образом, часть эфиров холестерола переносится на ЛПОНП, ЛППП, а ЛПВП3 за счёт накопления триацилглицеролов увеличиваются в размерах и превращаются в ЛПВП2, ЛПОНП под действием ЛП -липазы превращаются сначала в ЛППП, а затем в ЛПНП. ЛПНП и ЛППП захватываются клетками через рецепторы ЛПНП.
Рис. 8-70. Роль ЛПВП и ЛПНП в обратном транспорте холестерола в печень. Незрелые ЛПВП-предшественники обогащаются хопестеролом, который поступает в ЛПВП при участии фермента ЛХАТ с поверхности клеток и других липопротеинов, содержащих холестерол. Незрелые ЛПВП, обогащаясь холестеролом, превращаются в ЛПВП3 — частицы сферической формы и большего размера. ЛПВП3 обменивают эфиры холестерола на триацилглицеролы, содержащиеся в ЛПОНП, ЛППП при участии «белка, переносящего эфиры холестерола»*. ЛПВП3 превращается в ЛПВП2, размер которых увеличивается за счёт накопления триацилглицеролов. ЛПОНП и ЛППП под действием ЛП-липазы превращаются в ЛПНП, которые доставляют холестерол в печень. Часть ЛПВП захватывается клетками печени, взаимодействуя со специфическими для ЛПВП рецепторами к апоА-1. На поверхности клеток печени фосфолипиды и триацилглицеролы ЛППП, ЛПВП2 гидролизуются печёночной ЛП-липазой**, что дестабилизирует структуру поверхности ЛП и способствует диффузии холестерола в гепатоциты. ЛПВП2 в результате этого опять превращаются в ЛПВП3 и возвращаются в кровоток. X — холестерол, ЭХ — эфиры холестерола, ФЛ — фосфолипиды, ЛХАТ — лецитин-холестеролацилтрансфераза, А-I — апопротеин, активатор ЛХАТ.
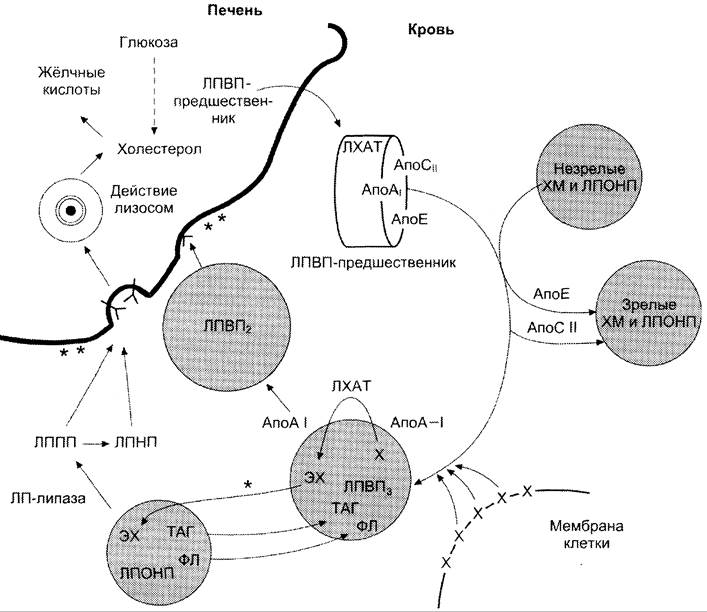
Таким образом, холестерол из всех тканей возвращается в печень в основном в составе ЛПНП, но в этом участвуют также ЛППП и ЛПВП2. Практически весь холестерол, который должен быть выведен из организма, поступает в печень и уже из этого органа выделяется в виде производных с фекалиями. Путь возвращения холестерола в печень называют «обратным транспортом» холестерола.
Выведение холестерола из организма
Структурная основа холестерола — кольца циклопентанпергидрофенантрена — не может быть расщеплена до СО2 и воды, как другие органические компоненты, поступающие с пищей или синтезированные в организме. Поэтому основное количество холестерола выводится в виде жёлчных кислот.
Некоторое количество жёлчных кислот выделяется в неизменённом виде, а часть подвергается действию ферментов бактерий в кишечнике. Продукты их разрушения (в основном, вторичные жёлчные кислоты) выводятся из организма.
Часть молекул холестерола в кишечнике под действием ферментов бактерий восстанавливается по двойной связи в кольце В, в результате чего образуются 2 типа молекул — холестанол и копростанол, выводимые с фекалиями. В сутки из организма выводится от 1,0 г до 1,3 г холестерола, основная часть удаляется с фекалиями.
В. Синтез желчных кислот из холестерола и его регуляция
Жёлчные кислоты синтезируются в печени из холестерола. Часть жёлчных кислот в печени подвергается реакции конъюгации — соединения с гидрофильными молекулами (глицином и таурином). Жёлчные кислоты обеспечивают эмульгирование жиров, всасывание продуктов их переваривания и некоторых гидрофобных веществ, поступающих с пищей, например, жирорастворимых витаминов и холестерола. Жёлчные кислоты также всасываются, через воротную вену попадают опять в печень и многократно используются для эмульгирования жиров. Этот путь называют энтерогепатической циркуляцией жёлчных кислот.
Синтез жёлчных кислот
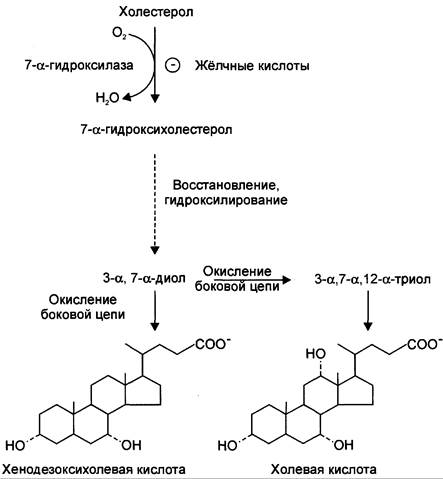
В организме за сутки синтезируется 200 — 600 мг жёлчных кислот. Первая реакция синтеза — образование 7-α-гидроксихолестерола — является регуляторной. Фермент 7-α-гидроксилаза, катализирующий эту реакцию, ингибируется конечным продуктом — жёлчными кислотами. 7-α-Гидроксилаза представляет собой одну из форм цитохрома Р450 и использует кислород как один из субстратов. Один атом кислорода из О2 включается в гидроксильную группу в положении 7, а другой восстанавливается до воды. Последующие реакции синтеза приводят к формированию 2 видов жёлчных кислот: холевой и хенодезоксихолевой (рис. 8-71), которые называют «первичными жёлчными кислотами».
Рис. 8-71. Синтез первичных жёлчных кислот и его регуляция. В процессе синтеза жёлчных кислот холестерол подвергается гидроксилированию, восстановлению двойной связи в положениях 5 и 6 и окислению боковой цепи. Образуется 2 типа жёлчных кислот: одна с гидроксильными группами в положениях 3 и 7, другая — с гидроксильными группами в положениях 3, 7, 12.
Конъюгирование жёлчных кислот
Конъюгирование — присоединение ионизированных молекул глицина или таурина к карбоксильной группе жёлчных кислот; усиливает их детергентные свойства, так как увеличивает амфифильность молекул.
Конъюгация происходит в клетках печени и начинается с образования активной формы жёлчных кислот — производных КоА (рис. 8-72).
Рис. 8-72. Конъюгация жёлчных кислот в печени и разрушение в кишечнике. А — продукты конъюгации обладают лучшими детергентными свойствами, так как снижается константа диссоциации, и молекулы полностью диссоциированы при pH 6 в кишечнике. Конъюгации подвергаются холевая и хенодезоксихолевая кислоты; Б — в кишечнике небольшое количество жёлчных кислот под действием ферментов бактерий превращаются в литохолевую и дезоксихолевую кислоты.
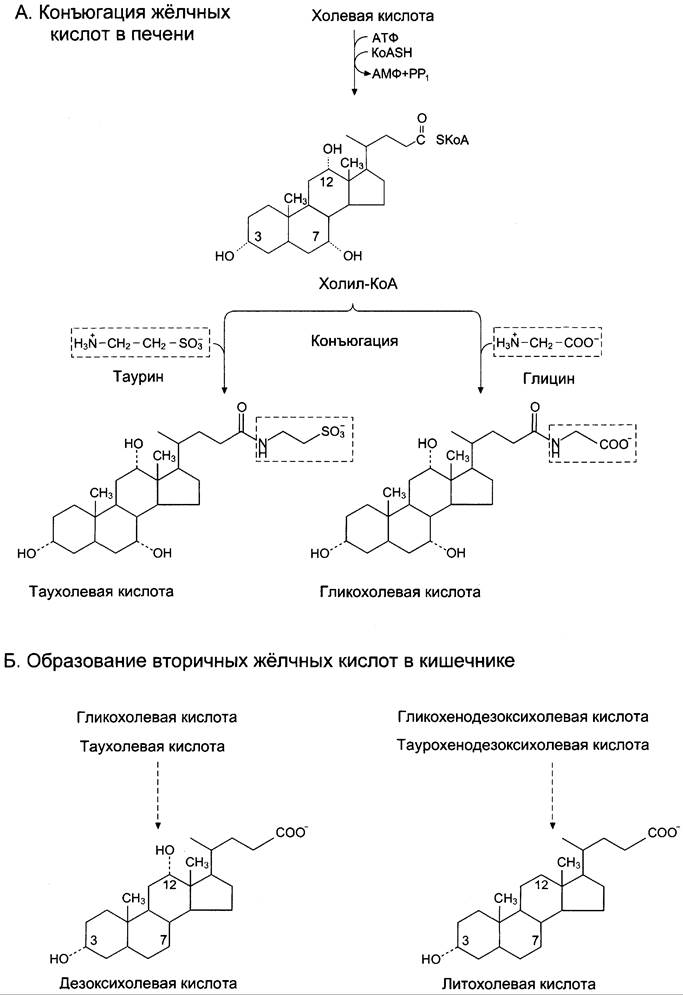
Затем присоединяется таурин или глицин, и в результате образуется 4 варианта конъюгатов: таурохолевая и таурохенодезоксихолевая, гликохолевая или гликохенодезоксихолевая кислоты (они значительно более сильные эмульгаторы, чем исходные жёлчные кислоты).
Конъюгатов с глицином образуется в 3 раза больше, чем с таурином, так как количество таурина ограничено.
Энтерогепатическая циркуляция жёлчных кислот. Превращения жёлчных кислот в кишечнике
Продукты гидролиза жиров всасываются в основном в верхнем отделе тонкого кишечника, а соли жёлчных кислот — в подвздошной кишке. Около 95% жёлчных кислот, попавших в кишечник, возвращается в печень через воротную вену, затем опять секретируются в жёлчь и повторно используются в эмульгировании жиров (рис. 8 — 73). Этот путь жёлчных кислот называют энтерогепатической циркуляцией. В сутки всего реабсорбируется 12 — 32 г солей жёлчных кислот, так как в организме имеется 2 — 4 г жёлчных кислот, и каждая молекула жёлчной кислоты проходит этот круг 6 — 8 раз.
Рис. 8-73. Энтерогепатическая циркуляция жёлчных кислот. Светлые кружки — мицеллы жёлчи; тёмные кружки — смешанные мицеллы жёлчи и продуктов гидролиза триацил- глицеролов.
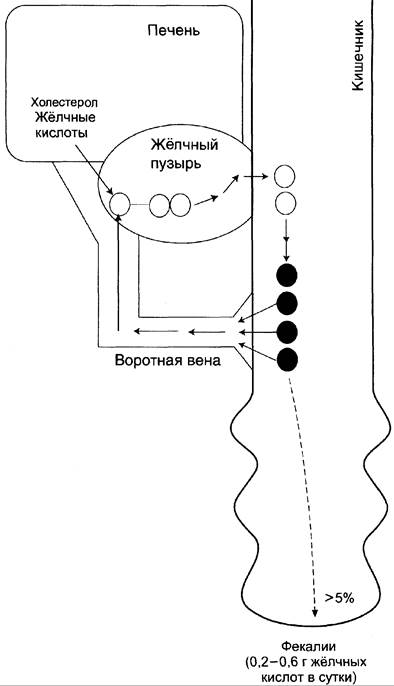
Часть жёлчных кислот в кишечнике подвергается действию ферментов бактерий, которые отщепляют глицин и таурин, а также гидроксильную группу в положении 7 жёлчных кислот. Жёлчные кислоты, лишённые этой гидроксильной группы, называют вторичными. Вторичные жёлчные кислоты: дезоксихолевая, образующаяся из холевой, и литохолевая, образующаяся из дезоксихолевой, хуже растворимы, медленнее всасываются в кишечнике, чем первичные жёлчные кислоты. Поэтому с фекалиями в основном удаляются вторичные жёлчные кислоты. Однако реабсорбированные вторичные жёлчные кислоты в печени опять превращаются в первичные и участвуют в эмульгировании жиров. За сутки из организма выводится 500 — 600 мг жёлчных кислот. Путь выведения жёлчных кислот одновременно служит и основным путём выведения холестерола из организма. Для восполнения потери жёлчных кислот с фекалиями в печени постоянно происходит синтез жёлчных кислот из холестерола в количестве, эквивалентном выведенным жёлчным кислотам. В результате пул жёлчных кислот (2 — 4 г) остаётся постоянным.
Регуляция синтеза жёлчных кислот
Регуляторные ферменты синтеза жёлчных кислот (7-α-гидроксилаза) и холестерола (ГМГ-КоА- редуктаза) ингибируются жёлчными кислотами. В течение суток активность обоих ферментов меняется сходным образом, т. е. увеличение количества жёлчных кислот в печени приводит к снижению синтеза как жёлчных кислот, так и холестерола. Возвращение жёлчных кислот в печень в процессе энтерогепатической циркуляции оказывает важное регуляторное действие; прерывание циркуляции приводит к активации 7-а-гид- роксилазы и увеличению захвата холестерола из крови. Этот механизм лежит в основе одного из способов снижения концентрации холестерола в крови при лечении гиперхолестеролемии. В этом случае используют препараты, адсорбирующие в кишечнике холестерол и жёлчные кислоты и препятствующие их всасыванию.
Регуляция 7-α-гидроксилазы осуществляется и другими механизмами: фосфорилированием/дефосфорилированием, причём активна фосфорилированная форма, в отличие от ГМГ-КоА-редуктазы; изменением количества фермента; холестерол индуцирует транскрипцию гена, а жёлчные кислоты репрессируют.
На синтез 7-α-гидроксилазы влияют гормоны: тиреоидные гормоны индуцируют синтез, а эстрогены — репрессируют. Такое влияние эстрогенов на синтез жёлчных кислот объясняет, почему желчнокаменная болезнь встречается у женщин в 3 — 4 раза чаще, чем у мужчин.
Г. Желчнокаменная болезнь
Желчнокаменная болезнь — патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет холестерол.
Выделение холестерола в жёлчь должно сопровождаться пропорциональным выделением жёлчных кислот и фосфолипидов, удерживающих гидрофобные молекулы холестерола в жёлчи в мицеллярном состоянии (табл. 8-9).
Таблица 8-9. Компоненты жёлчи
Компоненты жёлчи |
Концентрация, ммоль/л |
Жёлчные кислоты |
310 |
Фосфатидилхолин |
8 |
Холестерол |
25 |
Жёлчные пигменты |
3,2 |
У большинства больных желчнокаменной болезнью активность ГМГ-КоА-редуктазы повышена, следовательно, увеличен синтез холестерола, а активность 7-α-гидроксилазы, участвующей в синтезе жёлчных кислот, снижена. В результате синтез холестерола увеличен, а синтез жёлчных кислот из него замедлен, что приводит к диспропорции количества холестерола и жёлчных кислот, секретируемых в жёлчь.
Если эти пропорции нарушены, то холестерол начинает осаждаться в жёлчном пузыре, образуя вначале вязкий осадок, который постепенно становится более твёрдым. Иногда он пропитывается билирубином — продуктом распада гема, белками и солями кальция. Камни, образующиеся в жёлчном пузыре, могут состоять только из холестерола (холестериновые камни) или из смеси холестерола, билирубина, белков и кальция. Холестериновые камни обычно белого цвета, а смешанные камни — коричневого цвета разных оттенков. Причин, приводящих к изменению соотношения жёлчных кислот и холестерола, в жёлчи много: пища, богатая холестеролом, гиперкалорийное питание, застой жёлчи в жёлчном пузыре, нарушение энтерогепатической циркуляции, нарушения синтеза жёлчных кислот, инфекции жёлчного пузыря.
Если камни начинают перемещаться из жёлчного пузыря в жёлчные протоки, то они вызывают спазм жёлчного пузыря и протоков, что больной ощущает, как приступ сильной боли. Если камень перекрывает проток некоторое время, то нарушается поступление жёлчи в кишечник, жёлчные пигменты проходят через мембраны гепатоцитов в сторону синусоидов и попадают в кровь, что приводит к развитию обтурационной (подпечёночной желтухи).
Лечение желчнокаменной болезни. В начальной стадии образования камней можно применять в качестве лекарства хенодезоксихолевую кислоту. Попадая в жёлчный пузырь, эта жёлчная кислота постепенно растворяет осадок холестерола (холестериновые камни), однако это медленный процесс, требующий нескольких месяцев.
Д. Дислипопротеинемии. Гиперхолестеролемия и развитие атеросклероза
Дислипопротеинемии — нарушения обмена ЛП крови и, соответственно, нарушения обмена липидов, транспортируемых ЛП. Дислипопротеинемии проявляются чаще всего повышением концентрации либо одного типа ЛП, либо сочетанным увеличением содержания нескольких типов ЛП.
В настоящее время имеется несколько классификаций дислипопротеинемий. Основная классификация представлена в табл. 8-10.
Таблица 8-10. Дислипопротеинемии
Тип и название дислипопротеинемии |
Генетический дефект |
Изменения липидного обмена |
Тип I (наследственная недостаточность ЛП- липазы) |
Дефект структуры ЛП- липазы Дефект структуры апоС-II |
↑ в крови ХМ и ЛПОНП, нет риска атеросклероза, гипертриглицеролемия |
Тип II (семейная гиперхолестеролемия) |
Дефект рецепторов ЛПНП или мутация гена апоВ-100 |
↑ концентрации ЛПНП, гиперхолестеролемия, ранний атеросклероз, ксантоматоз |
Тип III (семейная комбинированная гиперлипидемия, нарушение удаления остаточных липопротеинов из крови) |
Дефект в структуре апоЕ, синтез изоформы апоЕ2, которая не взаимодействует с рецепторами |
↑ концентрации остаточных ХМ, ЛПОНП, ЛППП, ЛПНП Г иперхолестеролемия, гипертриглицеролемия, ранний атеросклероз, ксантоматоз |
Типы IV и V (семейная гипертриглицеролемия) |
Генетически гетерогенная группа заболеваний. Избыточная продукция ЛПОНП как результат гиперинсулинемии |
↑ концентрации ЛПОНП, ЛПНП, гипертриглицеролемия, умеренная гиперхолестеролемия Атеросклероз, снижение толерантности к глюкозе, ксантоматоз |
Наиболее распространены нарушения обмена холестерола и триацилглицеролов.
Нарушения обмена холестерола чаще всего приводят к гиперхолестеролемии и последующему развитию атеросклероза. При атеросклерозе происходит образование на стенках артерий так называемых атеросклеротических бляшек, представляющих собой в основном отложения холестерола. Атеросклеротические бляшки разрушают клетки эндотелия сосудов, и в таких местах часто образуются тромбы. Атеросклероз — полигенное заболевание. Одна из основных причин развития атеросклероза — нарушение баланса между поступлением холестерола с пищей, его синтезом и выведением из организма. Выведение холестерола ограничено, не превышает 1,2 — 1,5 г/сут, а поступление с пищей при неправильном питании может превысить этот барьер, поэтому с возрастом постепенно происходит накопление холестерола в организме. Важным фактором развития атеросклероза являются генетические дефекты белков и ферментов, участвующих в обмене холестерола.
Гиперхолестеролемия. Роль алиментарных факторов в развитии гиперхолестеролемии
Концентрация холестерола в крови взрослых людей составляет 200 ± 50 мг/дл (5,2 ± 1,2 ммоль/л) и, как правило, увеличивается с возрастом. Превышение нормальной концентрации холестерола в крови называют гиперхолестеролемией.
Гиперхолестеролемия часто развивается вследствие избыточного поступления холестерола с пищей, а также углеводов и жиров. Гиперкалорийное питание — один из распространённых факторов развития гиперхолестеролемии, так как для синтеза холестерола необходимы только ацетил-КоА, АТФ и NАDРН. Все эти субстраты образуются при окислении глюкозы и жирных кислот, поэтому избыточное поступление этих компонентов пищи способствует развитию гиперхолестеролемии. В норме поступление холестерола с пищей снижает синтез собственного холестерола в печени, однако с возрастом эффективность регуляции у многих людей снижается.
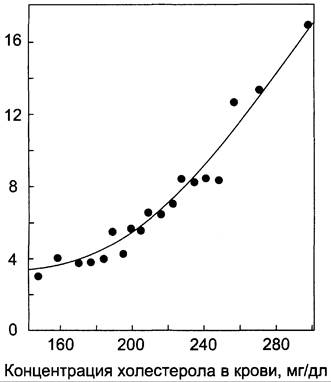
Правильное питание в течение всей жизни — важнейший фактор профилактики гиперхолестеролемии. Доказана корреляция между увеличением концентрации холестерола в плазме крови и смертностью от заболеваний ССС — инфаркта миокарда и инсульта, развивающихся в результате атеросклероза (рис. 8-74).
Рис. 8-74. Корреляция между концентрацией холестерола в крови и смертностью от заболеваний ССС на 1000 мужчин. Смертность на 1000 мужчин
Ген рецептора ЛПНП: структура и типы мутаций
Наследственные факторы играют важную роль в предрасположенности к развитию атеросклероза. Наиболее часто встречаются мутации в структуре гена рецептора ЛПНП.
Ген рецептора ЛПНП находится в хромосоме 19 и состоит из 18 экзонов (рис. 8-75). Различные группы экзонов кодируют различные домены в составе этого белка. Мутации в этом гене подробно изучены и разделены на 4 класса.
Рис. 8-75. Типы мутаций в гене белка-рецептора ЛПНП. Экзоны представлены тёмными прямоугольниками, интроны — линиями, соединяющими экзоны. На рисунке показаны типы мутаций: <-> — делеция, • — нонсенс-мутация, ■ — миссенс-мутация; кb — тысячи оснований.
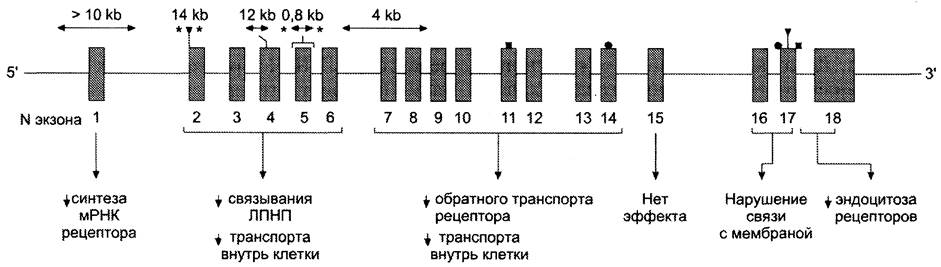
Первый класс мутаций, наиболее распространённый, приводит к полному отсутствию рецептора; второй класс мутаций характеризуется тем, что рецептор синтезируется, но не может транспортироваться на поверхность клетки; третий класс мутаций соответствует ситуации, когда рецептор транспортируется на поверхность клеток, но не связывает ЛПНП; четвёртый класс мутаций — рецептор связывает ЛПНП, но не происходит эндоцитоз. Изменения структуры рецепторов ЛПНП в результате всех типов мутаций приводит к гиперхолестеролемии, так как ЛПНП не захватываются клетками, и холесте- рол в составе ЛПНП накапливается в крови.
Семейная гиперхолестеролемия
Любой дефект рецептора ЛПНП или белка апоВ-100, взаимодействующего с ним, приводит к развитию наиболее распространённого наследственного заболевания — семейной гиперхолестеролемии. Причиной этого аутосомно-доминантного заболевания выступают указанные выше мутации в гене рецептора ЛПНП. Гетерозиготы, имеющие один нормальный ген, а другой дефектный, встречаются с частотой 1:500 человек, у некоторых народностей Африки — даже 1:100 человек. Количество рецепторов ЛПНП на поверхности клеток у гетерозигот снижено вдвое, а концентрация холестерола в плазме, соответственно, вдвое повышается. У гетерозигот концентрация холестерола в крови в 35 — 40 лет достигает 400 — 500 мг/дл, что приводит к выраженному атеросклерозу и ранней смерти в результате инфаркта миокарда или инсульта. Гомозиготы встречаются редко — 1:1 000 000 человек. Концентрации холестерола и ЛПНП в крови таких больных уже в раннем детском возрасте увеличены в 5 — 6 раз. ЛПНП захватываются макрофагами путём фагоцитоза. Макрофаги, нагруженные избытком холестерола и других липидов, содержащихся в ЛПНП, откладываются в коже и даже сухожилиях, образуя так называемые ксантомы. Холестерол откладывается также и в стенках артерий, образуя атеросклеротические бляшки. Такие дети без экстренных мер лечения погибают в возрасте 5 — 6 лет. Лечение данной формы заболевания проводят путём удаления ЛПНП из крови с помощью плазмафереза, но наиболее радикальный метод лечения — трансплантация печени. Печень донора с нормальным количеством рецепторов ЛПНП существенно понижает концентрацию холестерола в крови и предотвращает раннюю смерть от атеросклероза.
Кроме генетических дефектов рецептора ЛПНП, причинами гиперхолестеролемии и, следовательно, атеросклероза являются наследственные дефекты в структуре апоВ-100, а также повышенные синтез или секреция апоВ-100 в случае семейной комбинированной гиперлипидемии, при которой в крови повышены концентрации и холестерола, и триацилглицеролов.
Химическая модификация липидов и белков ЛПНП и рецепторов ЛПНП
Изменение нормальной структуры липидов и белков в составе ЛПНП делает их чужеродными для организма и поэтому более доступными для захвата фагоцитами. Например, активация свободнорадикального окисления липидов приводит к изменению не только структуры липидов в липопротеинах, но и структуры апоВ-100. Другим фактором, изменяющим структуру как ЛПНП, так и рецептора ЛПНП, является неферментативное гликозилирование белков, происходящее при увеличении концентрации глюкозы в крови при сахарном диабете. Модифицированные ЛПНП поглощаются макрофагами с участием «скевенджер-рецепторов» (рецепторов-мусорщиков).
Молекулярные механизмы патогенеза атеросклероза
Развитие атеросклероза проходит несколько стадий (рис. 8-76).
Рис. 8-76. Развитие атеросклеротической бляшки в клетках эндотелия кровеносных сосудов.
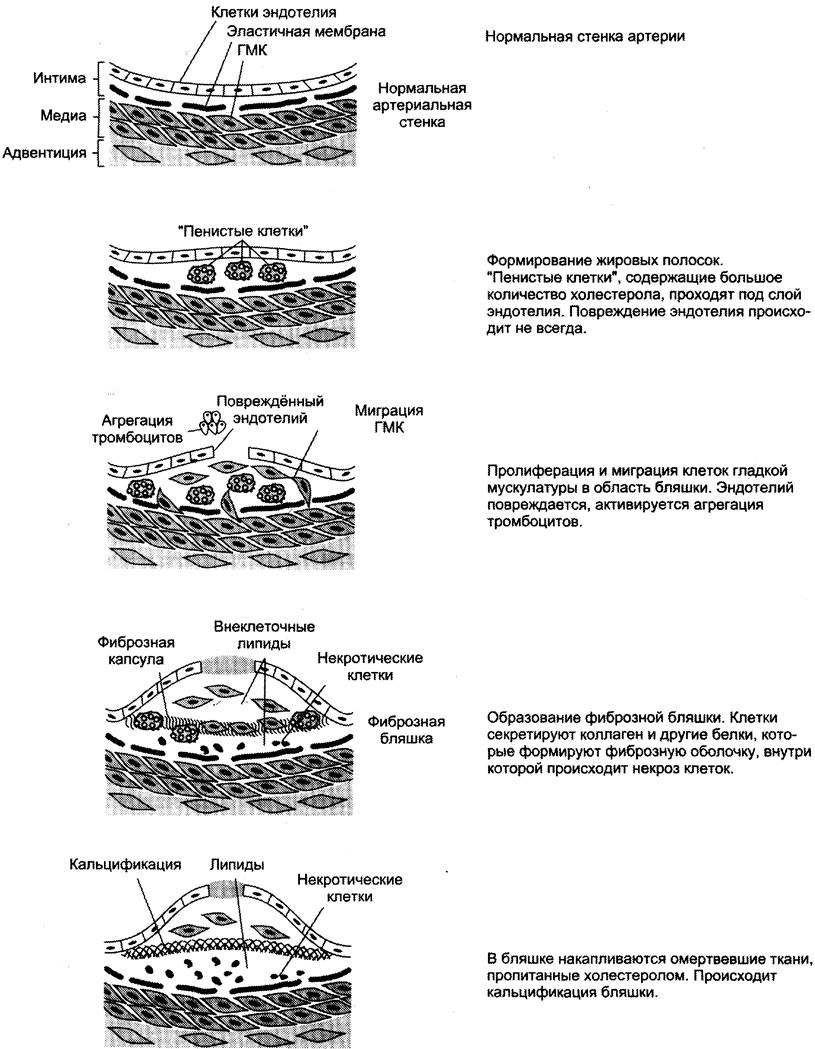
Процесс начинается с повреждения эндотелия сосудов, причём повреждение может иметь различные механизмы. Важнейший механизм — повреждение эндотелия за счёт изменённой структуры ЛПНП, например, в результате активации свободнорадикального ПОЛ в составе ЛПНП; повреждение провоцируется свободными радикалами, образующимися в процессе метаболизма или поступающими извне. В ходе ПОЛ в ЛПНП изменяется не только структура самих липидов, но и нарушается структура апопротеинов. Окисленные ЛПНП захватываются макрофагами через скевенджер-рецепторы. Этот процесс не регулируется количеством поглощённого холестерола, как в случае его поступления в клетки через специфические рецепторы, поэтому макрофаги перегружаются холестеролом и превращаются в «пенистые клетки», которые проникают в субэндотелиальное пространство. Это приводит к образованию жировых полосок в стенке кровеносных сосудов. На этой стадии эндотелий сосудов может сохранять свою структуру. При увеличении количества «пенистых клеток» происходит повреждение эндотелия сосудов. В норме клетки эндотелия секретируют простагландин 12 (простациклин 12), который ингибирует агрегацию тромбоцитов. При повреждении клеток эндотелия тромбоциты активируются. Во- первых, они секретируют тромбоксан А2 (ТХ А2), который стимулирует агрегацию тромбоцитов, что может привести к образованию тромба в области атеросклеротической бляшки; во-вторых, тромбоциты начинают продуцировать пептид — тромбоцитарный фактор роста, стимулирующий пролиферацию ГМК. ГМК мигрируют из медиального слоя во внутренний слой артериальной стенки и способствуют таким образом росту бляшки. Далее происходит прорастание бляшки фиброзной тканью (коллагеном,
эластином); клетки под фиброзной оболочкой некротизируются, а холестерол откладывается в межклеточном пространстве. На этой стадии в центре бляшки образуются даже холестериновые кристаллы. На последних стадиях развития бляшка пропитывается солями кальция и становится очень плотной. В области бляшки часто образуются тромбы, перекрывающие просвет сосуда, что приводит к острому нарушению кровообращения в соответствующем участке ткани и развитию инфаркта. Чаще всего атеросклеротические бляшки развиваются в артериях миокарда, поэтому наиболее распространённое заболевание, развивающееся в результате атеросклероза, — инфаркт миокарда.
Биохимические основы лечения атеросклероза и предупреждения развития инфаркта миокарда
Важным лечебным фактором, снижающим риск развития гиперхолестеролемии и атеросклероза, является гипокалорийная и гипохолестериновая диета. Поступление холестерола с пищей не должно превышать 300 мг/сут (табл. 8-11).
Таблица 8-11. Основы диеты, снижающей количество холестерола и жиров в организме человека
Проводимое вмешательство |
Количество холестерола и жиров |
Источники питания |
Снижение потребления общего количества жиров Снижение насыщенных жиров |
<30% суточной энергии <7-10% |
Уменьшить потребление масла, маргарина, цельного молока, мороженого, жирных сыров, жирного мяса, шоколада |
Использование пищи с высоким содержанием белка |
Рыба, цыплята и индейка (без шкурки), телятина |
|
Использование сложных углеводов, клетчатки, содержащейся во фруктах и овощах |
~ 35-40 г/сут клетчатки и пектинов растений |
Фрукты, овощи, бобы и соя, неочищенные зерновые продукты |
Снижение холестерина в пище |
<300 мг/день |
Не более 2 яиц в неделю, печень 2 раза в месяц |
Умеренное увеличение использования масел, содержащих полиеновые жирные кислоты |
Мононенасыщенные (10-15% энергии) Полиненасыщенные (7-10% энергии) |
Подсолнечное, кукурузное, оливковое масло |
Холестерол — стероид животного происхождения, поэтому он поступает в организм при употреблении животных жиров и жирного мяса. Растительная пища не содержит холестерола, поэтому у людей среднего и старшего возраста она должна составлять основу рациона.
К лечебным и профилактическим факторам относят обогащение пищи полиеновыми жирными кислотами семейства ω-3, уменьшающими риск тромбообразования. Ненасыщенные жирные кислоты способствуют более быстрому выведению холестерола из организма, хотя механизм этого явления до конца не выяснен. В то же время доказано, что полиеновые кислоты подавляют синтез тромбоцитарного фактора роста и таким образом замедляют развитие атеросклеротической бляшки.
Витамины С, Е, А, обладающие антиоксидантными свойствами, ингибируют перекисное (свободнорадикальное) окисление липидов в ЛПНП и поддерживают нормальную структуру липидов ЛПНП и их метаболизм.
Однако меры по исправлению диеты недостаточны при лечении выраженной гиперхолестеролемии и атеросклерозе. Лечение гиперхолестеролемии, как правило, комплексное.
Один из принципов лечения — «размыкание» цикла энтерогепатической циркуляции жёлчных кислот. Для этого используют лекарства типа холестирамина — полимера, который в кишечнике адсорбирует жёлчные кислоты, выделяется с фекалиями и таким образом уменьшает возврат жёлчных кислот в печень. В печени увеличивается захват холестерола из крови для синтеза новых жёлчных кислот. Препараты типа холестирамина называют секвестрантами жёлчных кислот.
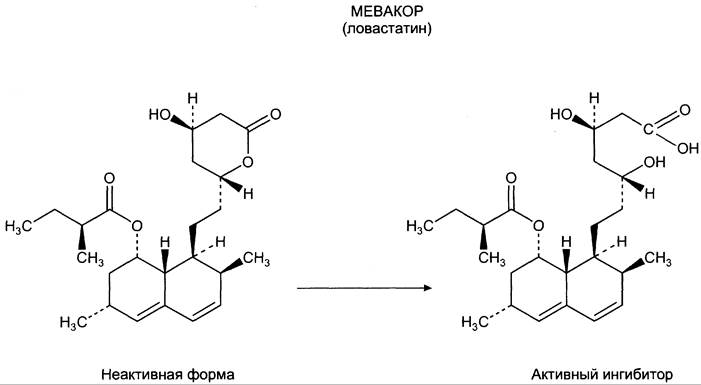
Наиболее эффективные препараты, применяемые при лечении атеросклероза, — ингибиторы ГМГ-КоА-редуктазы. Эти препараты — антибиотики, например, мевакор, в печени трансформируются в активную форму (рис. 8-77) и эффективно ингибируют регуляторный фермент биосинтеза холестерола. Такие препараты могут практически полностью подавить синтез собственного холестерола в организме. В этих условиях печень увеличивает захват холестерола из крови. Для этого в клетках печени почти вдвое увеличивается синтез белков-рецепторов ЛПНП и, соответственно, увеличивается захват ЛПНП из крови. Таким образом концентрация холестеро
ла в крови даже у больных с гетерозиготной формой семейной гиперхолестеролемии может быть доведена практически до нормы.
Рис. 8-77. Образование активной формы мевакора.
Лекарственные препараты — фибраты (клофибрат, фенофибрат) — ускоряют катаболизм ЛПОНП, активируя ЛП-липазу. Эти препараты также активируют окисление жирных кислот в печени, уменьшая тем самым синтез триацилглицеролов и эфиров холестерола и, как следствие, секрецию ЛПОНП печенью. Клофибрат индуцирует синтез ферментов пероксисом, способных окислять жирные кислоты. Фибраты обычно применяют при сочетании гипертриглицеролемии и гиперхолестеролемии. Для эффективного лечения атеросклероза применяют, как правило, комбинированное воздействие нескольких лекарственных препаратов.