БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 15. БИОХИМИЯ МЕЖКЛЕТОЧНОГО МАТРИКСА
II. Эластин
Эластин — основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе таких тканей, как кожа, стенки кровеносных сосудов, связки, лёгкие. Эти ткани обладают очень важными свойствами: они могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв, и возвращаться в первоначальное состояние после снятия нагрузки. Резиноподобные свойства названных тканей обеспечиваются особенностями состава и строения эластина — гликопротеина с молекулярной массой 70 кД.
А. Структура эластина
1. Аминокислотный состав и особенности конформации эластина описаны в 1-м разделе учебника.
Значение десмозина и лизиннорлейцина
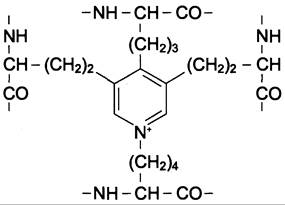
В межклеточном пространстве молекулы эластина образуют волокна и слои, в которых отдельные пептидные цепи связаны множеством жёстких поперечных сшивок в разветвлённую сеть. В образовании этих сшивок участвуют остатки лизина двух, трёх или четырёх пептидных цепей. Структуры, образующиеся при этом, называются десмозинами (десмозин или изодесмозин). Предполагают, что эти гетероциклические соединения формируются следующим образом: вначале 3 остатка лизина окисляются до соответствующих ε-альдегидов, а затем происходит их соединение с четвёртым остатком лизина с образованием замещённого пиридинового кольца. Окисление остатков лизина в ε-альдегиды осуществляется медьзависимой лизилоксидазой, активность которой зависит также от наличия пиридоксина (см. подразд. I, Б).
Десмозин (образован четырьмя остатками лизина)
Кроме десмозинов, в образовании поперечных сшивок может участвовать лизиннорлейцин, который образуется двумя остатками лизина.
Лизиннорлейцин (образован двумя остатками лизина)
![]()
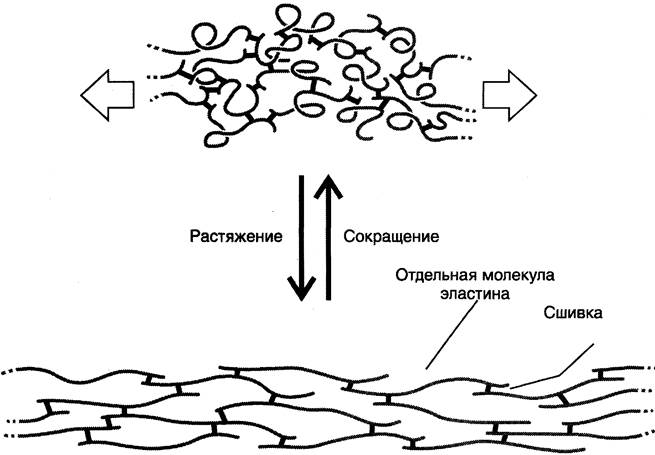
Наличие ковалентных сшивок между пептидными цепочками с неупорядоченной, случайной конформацией позволяет всей сети волокон эластина растягиваться и сжиматься в разных направлениях, придавая соответствующим тканям свойство эластичности (рис. 15-12).
Рис. 15-12. Молекулы эластина связаны ковалентными сшивками в обширную сеть.
Следует отметить, что эластин синтезируется как растворимый мономер, который называется «тропоэластин». После образования поперечных сшивок эластин приобретает свою конечную внеклеточную форму, которая характеризуется нерастворимостью, высокой стабильностью и очень низкой скоростью обмена.
Нарушения структуры эластина и их последствия
При снижении образования десмозинов (или их отсутствии) поперечные сшивки образуются в недостаточном количестве или не образуются вообще. Вследствие этого у эластических тканей снижается предел прочности на разрыв и появляются такие нарушения, как истончённость, вялость, растяжимость, т. е. утрачиваются их резиноподобные свойства. Клинически такие нарушения могут проявляться кардиоваскулярными изменениями (аневризмы и разрывы аорты, дефекты клапанов сердца), частыми пневмониями и эмфиземой лёгких.
Причины нарушений структуры эластина
✵ снижение активности лизилоксидазы, вызванное дефицитом меди или пиридоксина;
✵ дефицит лизилоксидазы при наследственных заболеваниях;
✵ синдром Менкеса — нарушение всасывания меди.
Б. Катаболизм эластина
Переваривание эластина
Нативный эластин, содержащийся в пище, не гидролизуется трипсином и химотрипсином, но медленно расщепляется пепсином при pH 2,0. Эластаза поджелудочной железы гидролизует эластин после выраженного лаг-периода. Это эндопептидаза, которая преимущественно расщепляет связи, образованные карбоксильными группами алифатических аминокислот.
Разрушение эластина
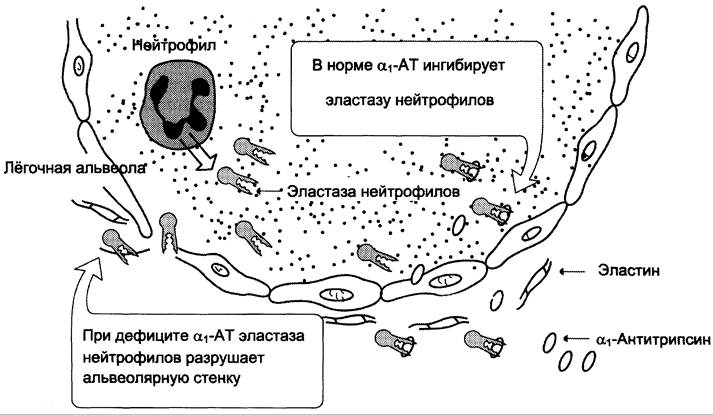
Катаболизм эластина происходит при участии эластазы нейтрофилов. Это очень активная протеаза, которая выделяется во внеклеточное пространство нейтрофилами и разрушает эластин и другие структурные белки. Особое значение это имеет в лёгких. Поскольку лёгочная ткань не регенерирует, разрушение эластина в альвеолярных стенках ведёт к потере эластичных свойств, разрушению альвеол и развитию эмфиземы лёгких (растяжение лёгких воздухом или образовавшимся в тканях газом).
В норме этого не происходит, так как эластазу нейтрофилов и другие протеазы ингибирует белок, называемый α1-антитрипсином (α1-АТ). Основное количество α1-АТ синтезируется печенью и находится в крови. В лёгких α1-АТ синтезируется альвеолярными макрофагами, что и обеспечивает защиту альвеол от действия эластазы (рис. 15-13). При дефиците α1-АТ, который может быть следствием различных мутаций в гене этого белка, повышается риск развития эмфиземы лёгких. В настоящее время это состояние поддаётся профилактике и лечению еженедельным внутривенным введением а1-АТ.
Рис. 15-13. Разрушение лёгочных альвеол эластазой нейтрофилов.