Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 31. БІОХІМІЧНІ ФУНКЦІЇ ПЕЧІНКИ. ПРОЦЕСИ ДЕТОКСИКАЦІЇ
31.2. БІОТРАНСФОРМАЦІЯ КСЕНОБІОТИКІВ ТА ЕНДОГЕННИХ ТОКСИНІВ. МІКРОСОМАЛЬНЕ ОКИСЛЕННЯ
До сполук, що справляють несприятливі, токсичні ефекти як щодо окремих клітин, так і вищого організму в цілому, належать:
(1) чужорідні хімічні сполуки, які потрапляють в організм людини та тварин в процесі життєдіяльності; це фармацевтичні препарати, засоби побутової хімії, косметичні засоби, харчові добавки (антиоксиданти, консерванти, барвники), пестициди, промислові отрути тощо. Ці речовини отримали назву ксенобіотиків(xenos — чужий; bios — життя; грецьк.) і в останні роки є об’єктом детального дослідження ксенобіохімії — напрямку досліджень, що вивчає закономірності перетворення (ксенобіокінетики — Ю.І. Губский, 1989) та молекулярних механізмів фізіологічних ефектів зазначених сполук;
(2) кінцеві продукти метаболізму, що мають потенційно токсичні властивості (жовчні пігменти та продукти їх перетворення в кишечнику; продукти окислення стероїдних гормонів та катехоламінів, які підлягають у печінці процесам кон’югації як етапу, що передує їх екскреції). Слід зазначити, що мікросомальні оксигенази (див. нижче) та амінооксидази печінки реалізують інактивацію самих фізіологічно активних гормональних сполук, протидіючи їх надмірному накопиченню в організмі;
(3) продукти мікробної деградації (гниття) білків (амінокислот) в товстій кишці (заміщені феноли, індоли, біогенні аміни).
Типи реакцій біотрансформації ксенобіотиків та ендогенних токсинів
Як уже зазначено, знешкодження токсичних речовин у гепатоцитах — це перетворення їх у молекулярну форму із зміненими біологічними властивостями (як правило, менш токсичну), що може бути виведеною з організму з сечею або жовчю.
Зазначені процеси біотрансформації ксенобіотиків та ендогенних токсичних сполук складаються із двох фаз.
1-ша фаза — окислювально-відновлювальні та гідролітичні реакції, що каталізуються мембранозв’язаними ферментами ендоплазматичного ретикулума гепатоцитів («мікросомальними ферментами»). У результаті реакцій першої фази у складі субстратів біотрансформації утворюються функціональні групи -OH, -COOH, -SH, -NH2; таким чином, ці реакції (функціоналізації, або прекон’югації) призводять до збільшення полярності молекули ксенобіотика або ендогенного субстрату (стероїду).
2-га фаза — реакції синтезу, або кон’югації, що ґрунтуються на приєднанні до молекулярних продуктів 1-ї фази (або вихідних субстратів, що вже мали в своєму складі полярні функціональні групи) залишків глюкуронової, сірчаної кислот, гліцину, глутаміну, глутатіону, метильного або ацетильного радикалів.
У деяких випадках детоксикація хімічних речовин включає тільки одну із зазначених фаз біотрансформації — першу або другу.
Реакції мікросомального окислення
Головна роль серед реакцій першої фази біотрансформації ксенобіотиків та ендогенних сполук належить ферментним системам мембран ендоплазматичного ретикулума, що функціонують за участю цитохрому Р-450. У зв’язку з тим, що біохімічним еквівалентом мембран ендоплазматичного ретикулума клітин печінки є отримувана методом диференційного центрифугування мікросомальна фракція, тип реакцій, який розглядається, отримав у науковій літературі назву «реакцій мікросомального окислення», а відповідні ферменти — «мікросомальних оксигеназ» (А.И. Арчаков, 1975).
Реакції, що каталізуються цими ферментами, належать до типу монооксигеназних, тобто таких, що каталізують включення атома одного кисню безпосередньо в молекулу субстрату, який окислюється (глава 9):
![]()
Така реакція (окислювальне гідроксилювання) є основною в метаболізмі гідрофобних сполук у мембранах ендоплазматичного ретикулума гепатоцитів і вимагає участі в ролі донора електронів НАДФН:
![]()
Оскільки в розглянутому процесі один із атомів молекули кисню включається в молекулу води, а другий—в молекулу субстрату, що гідроксилюється, ферментні системи, які каталізують ці реакції, отримали також назву «мікросомальних оксигеназ мішаної функції".
Цитохром Р-450
Ферментні системи, що каталізують реакції мікросомального окислення гідрофобних субстратів, є електронотранспортними ланцюгами, локалізованими в мембранах ендоплазматичного ретикулума гепатоцитів (та клітин деяких інших органів, що також беруть участь у реакціях детоксикації). Компонентами цих ферментних ланцюгів є ФАД-вмісний флавопротеїн, цитохром b5 та кінцева монооксигеназа — цитохром Р-450:
![]()
Подібний цитохром Р-450-залежний електронотранспортний ланцюг каталізує реакції окислювального гідроксилювання стероїдів (синтезу та біотрансформації), що наявні в мітохондріях кори наднирникових та статевих залоз.
Цитохром Р-450 — фермент, вперше відкритий у 1958 р. американськими дослідниками Д. Гарфінкелем та М. Клінгенбергом (D. Garfinkel, M. Klingenberg). Це сімейство гемопротеїнів з молекулярною масою близько 50 кД; у різних біологічних об’єктах та тканинах виявлено більше 300 ізоформ цитохрому Р-450, що розрізняються за своєю субстратною специфічністю та особливостями первинної структури. Фізіологічне значення ізоформ цитохрому Р-450 полягає в захисті тваринного організму від численних низькомолекулярних ксенобіотиків, що надходять у внутрішнє середовище; ця система є додатковою до системи імунного захисту («друга імунна система»), яка протидіє надходженню в організм чужорідних високомолекулярних сполук біологічного походження.
Біосинтез різних ізоформ цитохрому Р-450 кодується декількома сімействами генів, які у ссавців позначаються як CYP — гени (CYTOCHROME P-450; англ.). У геномі людини за синтез цього гемопротеїну відповідають більше 100 генів, експресія яких призводить до продукції ізоформ із різною субстратною специфічністю (CYP1, CYP2, CYP3 тощо), що додатково поділяються на ензимні субсімейства. Клінічний інтерес становлять індивідуальні ізоформи, що каталізують реакції метаболізму (біотрансформації) багатьох поширених фармакологічних препаратів (CYP1A2, CYP2C8-10, CYP2C-19, CYP2D6, CYP2E, CYP3A4).
Каталітичний цикл, що реалізує реакції окислювального гідроксилювання субстратів (SH) за участю цитохрому Р-450, складається з декількох парціальних реакцій, поданих на рис. 31.5.
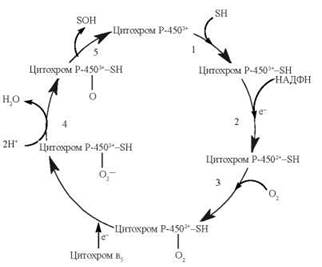
Рис. 31.5. Каталітичний цикл функціонування цитохрому Р-450.
Типи реакцій мікросомального окислення
Розглянута схема окислювально-відновлювальної біотрансформації ксенобіотиків за участю цитохрому Р-450 реалізується, залежно від хімічної природи субстрату та умов процесу, у вигляді декількох типів реакцій мікросомального окислення, до яких належать:
1) окислювальне гідроксилювання аліфатичних сполук:
1а — алканів та алкенів:
![]()
(субстратами реакції є вуглеводні, що можуть потрапляти в організм людини у процесі професійної діяльності);
1б — алкільних бічних ланцюгів циклічних сполук, наприклад:
![]()
(подібні реакції наявні, зокрема, при біотрансформації численних лікарських засобів з класу барбітуратів — гексобарбіталу, фенобарбіталу, пентобарбіталу);
2) окислювальне гідроксилювання циклічних сполук за типом гідроксилювання бензолу:
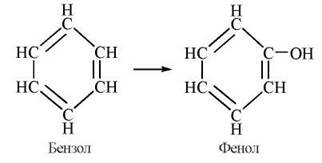
За таким типом відбувається біотрансформація моноциклічних вуглеводнів (аніліну, ацетаніліду), хлорованих циклічних вуглеводнів (зокрема, пестицидів гептахлору, альдрину тощо), поліциклічних вуглеводнів, що мають канцерогенні властивості (бензпірену, диметилбензантрацену);
3) окислювальне дезалкілування, зокрема:
- N-дезалкілування:
![]()
(субстратами реакції є такі поширені лікарські засоби, як амінопірин (амідопірин), аміназин, ефедрин, іміпрамін тощо);
- О-дезалкілування:
![]()
(субстратами реакції є, зокрема: наркотичний засіб кодеїн — продуктом реакції є морфін; фенацетин тощо);
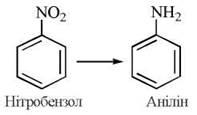
4) реакції відновлення (перебігають без участі кисню), зокрема:
- відновлення нітросполук та азосполук, наприклад:
- відновлювальне дегалогенування, наприклад:
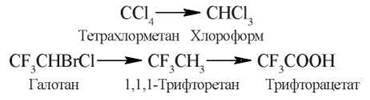
Проміжними метаболітами в реакціях відновлювального дегалогенування промислових отрут (тетрахлорметану) або летючих анестетиків (галотану, метоксифлюрану тощо) можуть бути вільні радикали (R˙), що спричиняють активацію вільнорадикальних реакцій перекисного окислення біомолекул (ліпідів, білків, нуклеїнових кислот) і призводять до важких некрозодистрофічних уражень печінки, нирок, міокарда.
Індукція мікросомальних монооксигеназ
Біологічно важливою особливістю цитохрому Р-450 є його здатність до активованого синтезу (ферментної індукції) в умовах надходження в тваринний організм низькомолекулярних гідрофобних сполук — субстратів мікросомального окислення. На даний час відомо декілька сотен хімічних речовин, що є індукторами цитохрому Р-450; введення цих сполук в організм спричиняє активацію окремих генів, які відповідають за синтез певних ізоформ гемопротеїну, специфічних для даного субстрату або групи хімічно близьких субстратів.
Фізіологічне значення феномена індукції цитохрому Р-450 полягає у збільшенні здатності клітин печінки до біотрансформації чужорідних хімічних сполук, тобто значному підвищенні її детоксикаційної функції; цей же механізм є відповідальним за зменшення або втрату специфічних фармакологічних ефектів багатьох лікарських засобів при їх тривалому застосуванні (розвиток «толерантності» до фізіологічно активних сполук). Широко відомим і таким, що застосовується в медичній практиці індуктором мікросомального окислення, є засіб седативної та протисудомної дії — Фенобарбітал (5-феніл-5-етилбарбітурова кислота).
Реакції кон’югації в гепатоцитах
Реакції кон’югації з утворенням «парних» сполук — шлях детоксикації більшості ксенобіотиків, що мають функціональні групи -OH, -COOH, -NH2, -SH (або утворюють їх у реакціях 1-ї фази біотрансформації). Цей же механізм використовується для утворення молекулярних форм, що підлягають екскреції з організму, з таких ендогенних субстратів, як жовчний пігмент білірубін, продукти бактеріального розщеплення в кишечнику циклічних амінокислот (фенолу, крезолу, індоксилу), стероїдні гормони та продукти їх гідроксилювання, продукти моноамінооксидазного розщеплення катехоламінів, серотоніну та інших біогенних амінів.
Найбільш поширеними реакціями кон’югації є:
1. Реакції глюкуронування (основний тип кон’югації в організмі людини та тварин як ксенобіотиків, так і ендогенних субстратів), у яких бере участь активна форма глюкуронату — УДФ-глюкуронова кислота (УДФГК), яка утворюється шляхом окислення УДФ-глюкози (УДФГ) НАД-залежною УДФГ-дегідрогеназою:
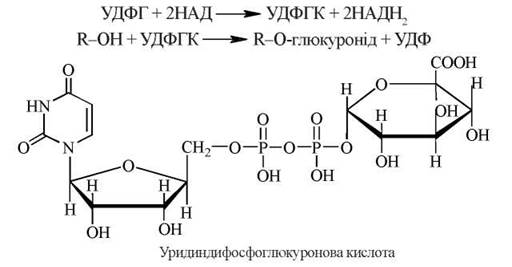
Фермент, що каталізує реакції глюкуронування — УДФ-глюкуронілтрансфераза, локалізований в мембранах ендоплазматичного ретикулума гепатоцитів та деяких інших органів і тканин, що також беруть участь в реакціях детоксикації (шлунково-кишкового тракту, нирок, шкіри).
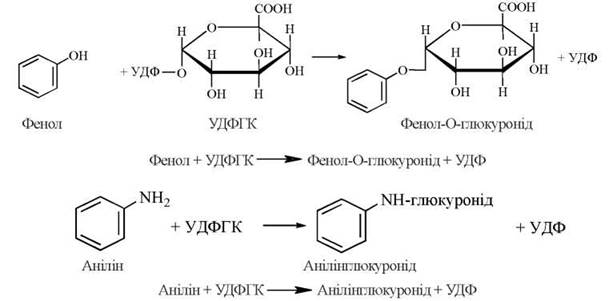
Залежно від хімічної природи субстрату, розрізняють реакції O-, N- та S-глюкуронування, наприклад:
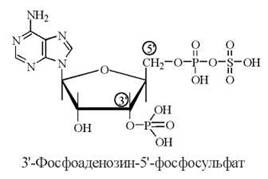
2. Реакції сульфування, донором сульфатних радикалів у яких є біологічно активна форма сірчаної кислоти — 3'-фосфоаденозин-5'-фосфосульфат (ФАФС).
Прикладом реакції сульфування є утворення в печінці кон’югату на основі індоксилу — продукту мікробного розщеплення в товстій кишці амінокислоти L-триптофану. Вільний індол утворюється в результаті дії ферментів мікроорганізмів на L-триптофан (одна з реакцій «гниття білків у кишечнику»); подальше окислення індолу до індоксилу постачає субстрат для взаємодії з ФАФС. Індоксилсульфат, що утворився, виводиться із сечею у вигляді калієвої солі, яка отримала назву «тваринного індикану»:
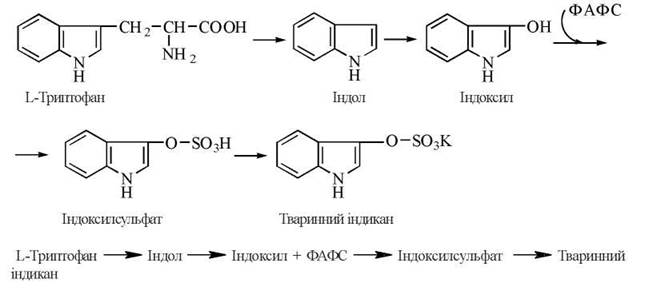
Величина екскреції тваринного індикану розглядається в клінічній практиці як індикатор активності гниття білків у кишечнику та функціонального стану печінки.
3. Реакції метилювання та ацетилювання — поширений тип кон’югації, в яких беруть участь як ксенобіотики, так і ендогенні субстрати; в цих реакціях беруть участь S-аденозилметіонін (О-метилювання) та ацетил-КоА (N-ацетилювання):
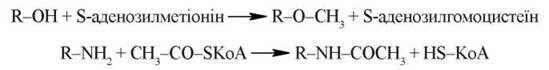
Важливим прикладом N-ацетилювання є ацетилювання сульфаніламідів — поширених хіміотерапевтичних препаратів; інтенсивність цієї реакції виступає показником активності біотрансформації лікарських засобів в організмі людини.
4. Реакції кон’югації з гліцином; клінічно важливим прикладом реакції є утворення гіпурової кислоти при взаємодії ендогенного гліцину з введеною в організм бензойною кислотою:
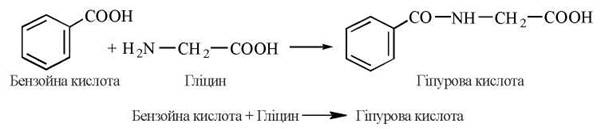
Визначення інтенсивності реакції (кількості екскретованої з сечею гіпурової кислоти після введення per os стандартної дози бензоату) лежить в основі дослідження антитоксичної функції печінки (проба Квіка).