Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 31. БІОХІМІЧНІ ФУНКЦІЇ ПЕЧІНКИ. ПРОЦЕСИ ДЕТОКСИКАЦІЇ
Захворювання печінки займають одне з найпоширеніших місць у патології людини. Гострі та хронічні гепатити, цирози печінки розвиваються внаслідок пошкоджувальної дії на гепатоцити багатьох інфекційних факторів (вірусної, бактеріальної природи), екзогенних хімічних сполук — ксенобіотиків, внаслідок радіаційного ураження, гемодинамічних розладів (серцево-судинної недостатності, шоку різного походження), аліментарного дефіциту білків, незамінних амінокислот, «ліпотропних факторів» (амінокислоти L-метіоніну, антиоксиданту α-токоферолу).
31.1. СТРУКТУРНО-ФУНКЦІОНАЛЬНА ОРГАНІЗАЦІЯ ПЕЧІНКИ. БІОХІМІЧНІ ФУНКЦІЇ ГЕПАТОЦИТІВ
Печінка посідає центральне місце в регуляції та інтеграції міжорганного обміну речовин і є «центральною біохімічною лабораторією організму».
Таке унікальне значення печінки в регуляції біохімічного гомеостазу цілісного організму зумовлене, насамперед, її ана- томо-фізіологічним розташуванням між кров’ю системи ворітної вени (v.porta) та загальним колом кровообігу (рис. 31.1).
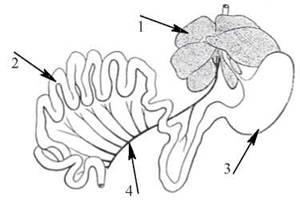
Рис. 31.1. Анатомо-фізіологічні взаємовідносини між печінкою, шлунково-кишковим трактом і ворітною веною;
1 — печінка; 2 — кишечник; 3 — шлунок; 4 — v.porta (за Э. Ньюсхолмом, К. Стартом, 1977).
Кров, що проходить через печінку, на 70 % надходить з v.porta (решта — з печінкової артерії), завдяки чому всі сполуки, які всмоктуються в шлунково-кишковому тракті, обов’язково проходять через печінку. Виходячи з цього, печінка (за рахунок біохімічних функцій гепатоцитів як головних структурно-функціональних клітин органа) виконує дві основні фізіологічні функції, що є життєво необхідними для існування організмів вищих тварин:
1. Печінка є первинним регулятором вмісту в крові моносахаридів, амінокислот, жирних кислот та гліцеролу, які утворюються внаслідок травлення поживних сполук продуктів харчування. Більше того, завдяки здатності до біосинтезу і секреції в кров багатьох класів вуглеводів, ліпідів та білків крові, печінка є основним центром розподілу поживних сполук в організмі людини і тварин.
Оскільки надходження поживних сполук із кишечника відбувається непостійно, рівні глюкози, амінокислот та жирів у крові v.porta підлягають значним коливанням протягом доби, і підтримання їх сталої концентрації в загальному кровообігу визначається саме регулюючою функцією печінки, що згладжує («демпфірує») ці коливання метаболітів.
2. Через печінку проходять після їх всмоктування в травному каналі не тільки поживні сполуки, а й численні чужорідні хімічні речовини, що всмоктуються в кишечнику (лікарські засоби, токсини тощо), і деякі кінцеві метаболіти токсичної дії (продукти обміну жовчних пігментів, катаболізму гормонів; сполуки, які утворюються внаслідок гниття білків у товстій кишці). Завдяки наявності в гепатоцитах складних ферментних систем біотрансформації, знешкодження зазначених класів сполук, печінка відіграє біологічно важливу бар’єрну функцію, оберігаючи інші органи та тканини від несприятливої дії токсичних речовин.
Особливості морфологічної організації печінки
Маса печінки у здорової дорослої людини складає близько 1500-2000 г (в середньому 20-25 г/кг маси тіла).
Основою гістологічної будови та функціональними одиницями печінки є печінкові часточки, що складаються з паренхіматозних клітин печінки — гепатоцитів, які у вигляді клітинних трабекул (балочок) конвертують у напрямку до v.centralis (рис. 31.2). Гепатоцити складають до 80 % клітинного складу печінки і забезпечують виконання основних біохімічних функцій, притаманних цьому органу.
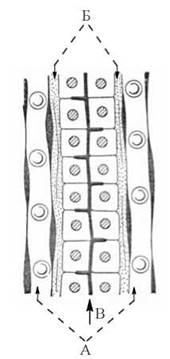
Рис. 31.2. Схема будови печінкової часточки
(А — синусоїди; Б — простори Дісе; В — жовчний капіляр).
Між окремими печінковими балками розміщуються синусоїди (судини, що є кінцевими розгалуженнями ворітної вени), кров з яких через v.centralis надходить до печінкових вен і, відповідно, — в загальний кровообіг. Стінки синусоїдів утворені витягнутими ретикулоендотеліальними («купферовськими») клітинами. Між стінками цих клітин та трабекулами (плазматичними мембранами гепатоцитів) утворюються щілиноподібні простори — простори Дісе, через які і відбувається обмін речовин між кров’ю синусоїдів та паренхіматозними клітинами печінки. Протилежні синусоїдам латеральні поверхні гепатоцитів (плазматичні мембрани) утворюють жовчні капіляри, через які відповідні біохімічні компоненти секретуються в жовч.
Біохімічні функції печінки в організмі
Крім характеру анатомо-фізіологічного розташування, кровообігу та структурної будови, функціональна роль печінки в організмі людини та вищих тварин визначається особливостями ферментного складу гепатоцитів, що дозволяють органу виконувати ряд властивих йому біохімічних функцій. Порушення цих функцій за умов печінково-клітинної недостатності, що може відбуватися при різних ураженнях гепатоцитів, супроводжується важкими розладами у функціонуванні організму, зокрема центральної нервової системи (печінкова кома) і є станом, несумісним із життям.
1. Вуглеводна (глікогенна) функція печінки
Ця функція полягає в здатності гепатоцитів утворювати лабільні резерви вуглеводів, що використовуються для підтримання необхідних концентрацій глюкози в крові та постачання цього цукру в інші органи (насамперед, головний мозок) у періоди між прийомами їжі.
Утворення й утилізація глюкозо-6-фосфату
Ініціюючим етапом включення глюкози в метаболічні перетворення є її фосфорилювання до глюкозо-6-фосфату (Г-6-Ф):
![]()
Ця ключова реакція вуглеводного метаболізму може каталізуватися в печінці двома ферментами: специфічною глюкокіназою та неспецифічною гексокіназою, що розрізняються за своєю спорідненістю до субстрату. Км для цих ферментів дорівнюють 0,01-0,1 мМ для гексокінази та 10 мМ для глюкокінази. Звідси зрозуміло, що при фізіологічних концентраціях глюкози (3,3-5,5 ммоль/л) каталітично активною є гексокіназа, а ферментативна дія глюкокінази включається лише за умов значного збільшення надходження в гепатоцити глюкози після споживання збагаченого на вуглеводи раціону (рис. 31.3).
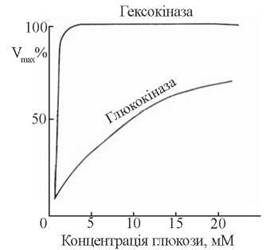
Рис 31.3. Кінетичні криві залежності швидкості фосфорилювання глюкози (Vmах) від концентрації вуглеводу за умов дії ферментів гексокінази та глюкокінази.
Активація після прийому їжі глюкокіназної реакції створює кінетичні умови для утворення значної кількості внутрішньоклітинного глюкозо-6-фосфату, який, в свою чергу, може включатися в метаболічні процеси за одним з шляхів, зазначених на схемі (рис. 31.4).
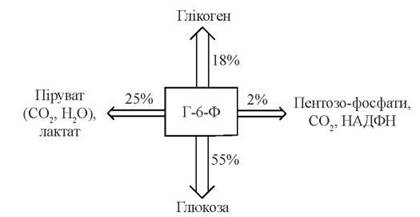
Рис. 31.4. Схема перетворень Г-6-Ф у гепатоцитах та орієнтовні кількісні взаємовідносини між окремими метаболічними шляхами.
Біосинтез та розщеплення глікогену
Завдяки функціонуванню активної глікогенсинтази, гепатоцити постійно утворюють і акумулюють у своєму складі значну кількість глікогену у вигляді нерозчинних цитозольних гранул: 3-5 % (г/100 г маси органа), що дозволяє печінці виконувати фізіологічно важливу функцію депо глюкози в організмі.
Ця метаболічна функція може здійснюватися печінкою завдяки системі фосфоролізу глікогену, включення якої стимулюється глюкагоном (в умовах зменшення концентрації глюкози в крові), а також існування в мембранах ендоплазматичного ретикулума активної глюкозо-6-фосфатази:
![]()
Порушення глікогенної функціїпечінки, тобто її здатності до створення метаболічних запасів глікогену та/або їх використання як енергетичного палива для функціонування інших органів, залежать від дії різноманітних етіологічних факторів, основними з яких є:
(а) зменшення резервів глікогену в гепатоцитах внаслідок дії пошкоджуючих агентів різного генезу, що порушують функціонування анаболічних реакцій у клітині (вірусні, токсичні гепатити, клітинна гіпоксія);
(б) порушення здатності гепатоцитів до синтезу глікогену з глюкози внаслідок уроджених ензимопатій (аглікогенози);
(в) порушення здатності гепатоцитів до використання резервів глікогену (глікогенози), зокрема внаслідок дефіциту печінкової глікогенфосфорилази (хвороба Херса) або глюкозо-6-фосфатази, що перетворює глюкозо-6-фосфат на вільну глюкозу (хвороба Гірке).
Глюконеогенез
Печінка є основним органом глюконеогенезу, тобто синтезу глюкози з невугле- водних метаболітів (лактату, глюкогенних амінокислот, гліцеролу), який активується в умовах вичерпання глікогенних резервів печінки (180-350 г глікогену) та зменшення (або відсутності) надходження цукрів із їжею.
В організмі людини запаси вуглеводів використовуються приблизно за 12 год, разом з тим людина може витримати голодування протягом декількох місяців. У цих умовах забезпечення глюкозою тканин, енергетичний обмін яких значною мірою залежить від цього моносахариду (головний мозок, інші нервові тканини, еритроцити, мозковий шар нирок, сім’яники), відбувається саме за рахунок глюконеогенезу в печінці та, частково, в нирках.
Перетворення на глюкозу інших моносахаридів
При змішаному харчуванні в кров людини з травного каналу, крім глюкози, всмоктується багато інших моносахаридів, зокрема D-фруктоза (надходить у складі сахарози), D-галактоза (у складі лактози молока) та D-маноза (у складі рослинних продуктів). Включення цих цукрів у загальний метаболізм відбувається завдяки наявності в гепатоцитах ферментних систем, що перетворюють вказані моносахариди на фосфорильовані ефіри глюкози та інтермедіати гліколізу.
2. Функція регуляції ліпідного складу крові
У печінці активно відбуваються більшість ферментативних реакцій синтезу та розшеплення різних класів ліпідів — жирних кислот, ацилгліцеролів, холестерину, фосфоліпідів (гліцеро- та сфінгофосфоліпідів), гліколіпідів.
Крім використання ліпідів для власних енергетичних та структурних потреб, печінці належить визначальна роль у регуляції окислення жирів іншими тканинами — функція, що реалізується шляхом утворення в гепатоцитах і секреції в кров триацилгліцеролів (у формі ліпопротеїнів дуже низької щільності — ЛПДНЩ) та кетонових тіл. У печінці утворюється також основна частина холестерину, що використовується в периферичних тканинах для синтезу фізіологічно активних стероїдів.
(1) Синтез та секреція триацилгліцеролів
В організмі людини основним місцем депонування високоенергетичних триацилгліцеролів є жирова тканина. Разом з тим, біосинтез триацилгліцеролів із вищих жирних кислот та гліцеролу відбувається переважно в гепатоцитах за рахунок використання метаболітів, що утворюються при окисленні глюкози (ацетил-КоА, інтермедіати гліколізу).
Виходячи з цього, в організмі повинен існувати транспортний механізм, який реалізує доставку водонерозчинних триацилгліцеролів через кров в адипоцити. Таким механізмом є утворення в гепатоцитах ЛПДНЩ, що секретуються в кров та утилізуються адипоцитами за рахунок наявності в ендотелії капілярів жирової тканини активної ліпопротеїнліпази. Біосинтез та секреція в кров гепатоцитами ЛПДНЩ зростає при збільшенні потоку жирних кислот, спрямованого з кишечника в печінку на висоті процесу травлення нейтральних жирів, а також в умовах дієти з високим вмістом вуглеводів, коли зростає ендогенний синтез у клітинах печінки довголанцюгових жирних кислот.
Порушення синтезу ЛПДНЩ у гепатоцитах за умов вірусного або токсичного ураження печінки призводить до аномального накопичення в органі триацилгліцеролів — так званого «жирового переродження печінки».
(2) Синтез та утилізація кетонових тіл
Клітини печінки не секретують у кров вільних жирних кислот, які використовуються в самому цьому органі шляхом Р-окислення або включенням до складу триацилгліцеролів (див. вище). Енергетичним субстратом («жировим паливом»), що його гепатоцити спрямовують в інші тканини, є кетонові тіла (переважно ацетоацетат), які активно утворються в печінці в результаті спеціального біосинтетичного процесу, що включає конденсацію окремих молекул ацетил-КоА.
У нормальному організмі утилізація кетонових тіл, синтезованих у печінці, відбувається в більшості позапечінкових тканин, зокрема в скелетних м’язах, міокарді, нирках та (в умовах тривалого голодування) в головному мозку.
(3) Синтез та біотрансформація холестерину
Печінка є основним місцем біосинтезу холестерину з ацетил-КоА (в середньому 250-500 мг/добу).
Використання холестерину включає в себе внутрішньопечінковий синтез жовчних кислот та позапечінкові реакції утворення біологічно активних стероїдів: вітаміну D3 та його похідних, кортикостероїдів кори наднирникових залоз, чоловічих та жіночих статевих гормонів.
3. Білоксинтезуюча функція печінки
Роль печінки в білковому обміні цілісного організму полягає в утворенні більшості білків плазми крові, які виконують важливі біохімічні та фізіологічні функції, регуляції розподілу амінокислот між окремими органами та тканинами, та синтезі сечовини як кінцевого продукту азотистого катаболізму.
(1) В гепатоцитах синтезуються всі альбуміни плазми крові (13-18 г/добу), які беруть участь у підтриманні нормального онкотичного тиску плазми, транспорті багатьох метаболітів та інших біомолекул; гіпоальбумінемія є інформативною клініко-діагностичною ознакою гострої та хронічної недостатності печінки.
(2) В печінці синтезується більша частина (близько 80 %) глобулінів плазми: гепатоцити беруть участь у біосинтезі певної частини α-глобулінів, ретикулоендотеліальні клітини продукують β-глобуліни та частину γ-глобулінів (імуноглобулінів); захворювання печінки, при яких наявні важкі порушення структури та функцій органа, супроводжуються зниженням концентрацій у крові α1-, α2- та β-глобулінів; з іншого боку, патологічні процеси, які перебігають з активацією імунокомпетентних клітин печінки, призводять до збільшення рівня γ-глобулінів.
(3) В клітинах печінки синтезується багато білкових факторів, що входять до складу згортальної, антизгортальної та фібринолітичної систем крові: V, XI, XII, XIII фактори згортання, компоненти протромбінового комплексу (II, VII, IX, X фактори), фібриноген, антитромбін, антиплазмін, гепарин.
(4) Завдяки активному перебігу реакцій обміну амінокислот (трансамінування, дезамінування, декарбоксилювання), печінка бере участь у підтриманні відносної біохімічної сталості амінокислотного складу крові; порушення білоксинтезуючої функції гепатоцитів (зокрема, при дії хімічних та біологічних пошкоджуючих факторів на рибосомальну систему трансляції) супроводжується значним збільшенням концентрації вільних амінокислот у плазмі крові; рівень аміноазоту плазми (в нормі 2,9-4,3 ммоль/л) може у хворих з важкою печінковою недостатністю збільшуватися до 21 ммоль/л, що супроводжується вираженою аміноацидурією.
4. Сечовиноутворювальна функція печінки
Печінка є єдиним органом, що містить повний набір ферментів утворення сечовини з продуктів азотистого (переважно білкового) катаболізму. Порушення функціонування циклу сечовиноутворення, що спричиняються екзогенними ушкоджуючими факторами, або спадковими ензимопатіями (генетичними дефектами в синтезі окремих ферментів біосинтезу сечовини) призводять до накопичення в крові та тканинах вільного аміаку.
Найчутливішими до такої патобіохімічної ситуації є нейрони головного мозку, в яких надлишковий аміак здатний до пригнічення функціонування циклу трикарбонових кислот за рахунок взаємодії NH4+ з а-кетоглутаратом у реакції відновлювального амінування. Гальмування реакцій ЦТК та відповідне зниження рівня АТФ в нервовій тканині спричиняють деполяризацію мембран нейронів, порушення синаптичної передачі, що клінічно проявляється розвитком печінкової енцефалопатії та коматозного стану.
5. Жовчоутворювальна та пігментна функції печінки
Важливою для фізіології та патології організму людини є роль, яку печінка відіграє в катаболізмі гемоглобіну та інших гемовмісних білків, при розщепленні яких утворюються жовчні пігменти — білірубін і білівердин, що екскретуються через кишечник (див. розділ 31.3). Ці сполуки разом з іншими органічними речовинами (жовчними кислотами, холестерином, фосфоліпідами), які продукуються гепатоцитами, входять до складу жовчі, надаючи їй специфічного золотисто-жовтуватого кольору.
Біохімічний склад жовчі
Жовч — це рідкий секрет клітин печінки, що служить як для надходження в дванадцятипалу кишку поверхнево активних сполук (жовчних кислот, фосфоліпідів), необхідних для перетравлювання і всмоктування нейтральних жирів, так і для екскреції з організму кінцевих продуктів катаболізму біомолекул і ксенобіотиків. За добу в дорослої людини утворюється 500-700 мл жовчі; вміст основних біоорганічних сполук в печінковій та міхуровій жовчі подано в табл. 31.1.
Таблиця 31.1. Біохімічний склад жовчі людини (г/л)
Компоненти жовчі |
Печінкова жовч |
Міхурова жовч |
Білки |
1,5-2,5 |
4,5-5,0 |
Жовчні кислоти |
7-14 |
90-120 |
Фосфоліпіди |
1,0-5,8 |
30-40 |
Жирні кислоти |
1,6-3,4 |
20-25 |
Холестерин |
1-2 |
3-10 |
Жовчні пігменти (білірубін, білівердин) |
0,3-0,6 |
1,2-1,5 |
6. Детоксикаційна функція печінки
Однією з найважливіших біологічних функцій печінки є знешкодження — детоксикація хімічних сполук, що не є нормальними метаболітами організму і можуть спричиняти несприятливу дію, здійснюючи загальнотоксичні, некрозогенні, мутагенні, канцерогенні ефекти. Біохімічна сутність процесу детоксикації, що відбувається в гепатоцитах, полягає в переведенні (біотрансформації) хімічної сполуки в результаті певних ферментативних реакцій в молекулярну форму з менш вираженими токсичними властивостями; продукти біотрансформацiї токсинів у печінці є, як правило, більш водорозчинними (гідрофільними) речовинами, що можуть виводитися з організму різними системами екскреції (нирками, кишечником, легенями, шкірою).
Ця функція, у зв’язку з її надзвичайною важливістю для збереження хімічного гомеостазу внутрішнього середовища організмів людини та тварин, детально розглядатиметься нижче.