Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 32. БІОХІМІЯ М’ЯЗІВ І М’ЯЗОВОГО СКОРОЧЕННЯ
М’язи є молекулярною системою, в якій відбувається трансформація хімічної енергії АТФ у механічну енергію скорочення та руху. За особливостями структурної організації м’язи людини і тварин поділяють на скелетні (смугасті), гладенькі та серцевий м’яз.
В основі всіх видів клітинного руху в еукаріотів (від дріжджів до людини) знаходиться взаємодія і взаємне переміщення філаментів, що сформовані з білків актину й міозину. До нем’язових рухів належать амебоподібні пересування лейкоцитів, макрофагів, фібробластів, сперматозоїдів та інших клітин, внутрішньоклітинні рухи, зокрема розходження хромосом, ендоцитоз та екзоцитоз. Рухливість війок і джгутиків зумовлюється взаємодією іншої пари білків — динеїну й тубуліну.
Найбільш вивченими є біохімічні процеси, що складають основу скорочення скелетних м’язів.
32.1. УЛЬТРАСТРУКТУРА І ХІМІЧНИЙ СКЛАД М’ЯЗІВ
Структурною одиницею скелетного м’яза є багатоядерна клітина — міоцит — м’язове волокно, довжина якого у людини може досягати 10-12 см, а діаметр — 0,01-0,1 мм.
Ультраструктурні компоненти міоцитів
Міоцити оточені електрично збудливою плазматичною мембраною, що отримала назву сарколеми, містять у собі цитозольну частину — саркоплазму, скорочувальні елементи — міофібрили, високодиференційовану ендоплазматичну сітку — саркоплазматичний ретикулум, розвинену систему мітохондрій — саркосом (рис. 32.1).
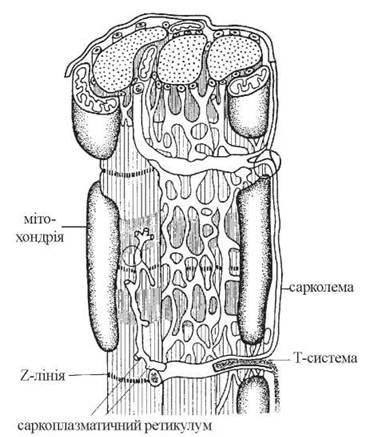
Рис. 32.1. Ультраструктура скелетного м’яза.
В активнофункціонуючих скелетних м’язах людини мітохондрії дуже чисельні; вони розміщуються впродовж міофібрил, у безпосередній близькості від них, що забезпечує мінімальну відстань для дифузії макроергічних фосфатів до скорочувальних елементів.
Скелетні м’язи мають розвинену систему мембран і канальців саркоплазматичного ретикулума (СР), які відіграють роль головного резервуара внутрішньоклітинного Са2+, контролюючи активну концентрацію іонів кальцію в цитозолі. Зміни концентрації цитозольного Са2+ є біохімічним регулятором включення процесу м’язового скорочення. З елементами СР контактує система поперечних трубочок — T-система, упродовж елементів якої відбувається поширення електричного потенціалу від сарколеми до мембран СР, спричиняючи вивільнення з СР іонів кальцію.
Значну частину об’єму м’язових клітин займають скорочувальні елементи — міофібрили, що спаковані в паралельні пучки. Молекулярною основою міофібрил є організовані у вигляді ниток (філаментів) скорочувальні білки — актин і міозин.
Саркомери — структурно-функціональні елементи скорочувального апарату скелетних м’язів. Саркомери утворені пучками міофібрил, які відокремлені один від одного перпендикулярними смугами — Z-лініями.
Електронно-мікроскопічне вивчення саркомерів дозволило виявити в них упорядковані елементи, які створюють характерну для скелетних м’язів поперечну смугастість (рис. 32.2), а саме:
I-диски (ізотропні), що утворені «тонкими» філаментами (діаметром близько 6 нм) міофібрил;
А-диски (анізотропні), що утворені «товстими» філаментами (діаметром 1517 нм) міофібрил, які перекриваються з «тонкими» філаментами;
Н-зона — частина А-диска, в якій «товсті» філаменти не перекриваються з «тонкими».
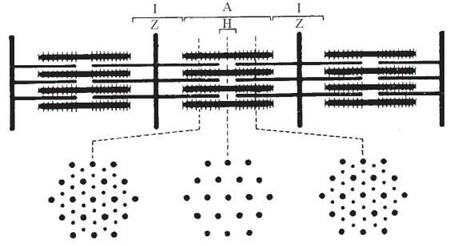
Рис. 32.2. Структурна організація саркомерів міофібрил.
Біохімічний склад м’язів
Скелетні м’язи ссавців містять у своєму складі: 72-80 % води; 16-20 % білків; 0,9-2,2 % небілкових азотистих сполук (креатин, креатинфосфат, АТФ, АДФ, амінокислоти тощо); безазотисті органічні сполуки (глікоген — 0,3-3,0 %; фосфоліпіди — 0,4-1,0 %; холестерин — 0,06-0,2 %); мінеральні елементи (K+, Ca2+, Na+ тощо).
Білки м’язів
Білки скелетних м’язів складаються з водонерозчинних білків міофібрил (становлять 75-80 % загального вмісту білків м’язів) і водорозчинних білків саркоплазми — так званого міогену.
До складу фракції міогену входять переважно ферменти, що каталізують катаболічні реакції, які забезпечують біоенергетику м’язового скорочення — глікогенфосфорилаза, ферменти гліколізу, креатинфосфокіназа, аденілаткіназа, кисеньдепонуючий білок міоглобін. В саркосомах містяться ферменти циклу трикарбонових кислот, біологічного окислення й окисного фосфорилювання.
Білки міофібрил
До складу міофібрил входять такі білки:
1) до складу товстих ниток — білок міозин;
2) до складу тонких ниток — білки актин, тропоміозин, тропоніновий комплекс (тропонін Т, тропонін I, тропонін С);
3) білок α-актинін — компонент Z-лінії саркомерів; з цим білком сполучені кінці F-актинових молекул тонких філаментів.
Таблиця 32.1. Білковий склад скелетного м’яза (за J. Musil та співавт., 1980, із змінами)
Білок |
М.м., кД |
Вміст, % |
Міозин |
460 |
55 - 60 |
Актин (G) |
46 |
20 - 25 |
Тропоміозин |
70 |
4 - 6 |
Комплекс тропоніну |
76 |
4 - 6 |
TnT |
37 |
|
TnI |
24 |
|
TnC |
18 |
|
α-Актинін |
180 |
1 - 2 |
Інші (міоген) |
Суміш |
5 - 10 |
Міозин — фібрилярний білок, що утворює товсті філаменти міофібрил. Молекула міозину асиметрична, складається з двох важких поліпептидних ланцюгів, що мають конформацію α-спіралі й закручені один відносно одного; довжина молекули — 160 нм. N-кінці важких ланцюгів утворюють глобулярні «голівки», які нековалентними зв’язками сполучені з додатковими чотирма легкимиполіпептидними ланцюгами.
В умовах триптичного гідролізу міозин розщеплюється на два фрагменти — мероміозини: легкий мероміозин — LMM (light meromyosin — англ.) та важкий мероміозин — HMM (heavy meromyosin— англ.). Подальший гідроліз HMM папаїном спричиняє утворення двох ідентичних глобулярних субфрагментів S1 (голівок міозину) і паличкоподібного субфрагмента S2 (рис. 32.3).
До складу голівок S1 входять каталітичні центри з АТФ-азною активністю і центри для зв’язування з актином (при відсутності АТФ).
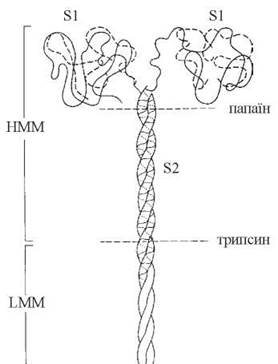
Рис. 32.3. Будова молекули міозину.
Фібрилярні «хвости» молекул міозину контактують між собою в поздовжньому напрямку, утворюючи товсті філаменти саркомерів, до складу кожного з яких входять близько 400 молекул міозину. Глобулярні голівки виступають із зовнішньої поверхні філамента (рис. 32.4).
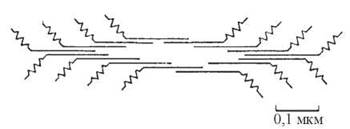
Рис. 32.4. Молекулярна організація товстого (міозинового) філамента.
Актин — білок, що існує в двох формах: G- та F-актин. G-актин — глобулярний білок, що має вигляд кулеподібних молекул діаметром близько 5 нм. Молекули G-актину (субодиниці) нековалентно сполучаються між собою, утворюючи намистоподібні утворення — ланцюги фібрилярного F-актину.
У м’язових клітинах F-актин представлений фібрилярними структурами, що складаються з двох ланцюгів, переплетених один навколо одного (рис. 32.5):
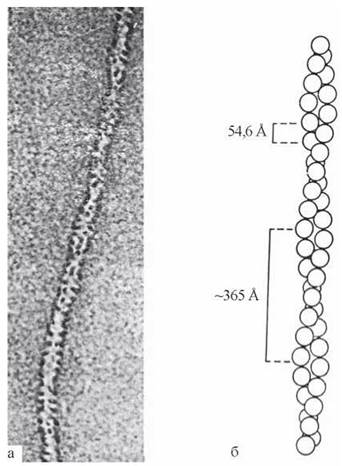
Рис. 32.5. Актиновии філамент: а — електронна мікрофотографія; б — схема утворення двоспіральних ланцюгів F-актину з G-актину.
F-актин складає основу будови тонких ниток саркомерів. У складі тонких ниток ланцюги F-актину сполучені з тропоміозином і тропонінами.
Тропомюзин — білкові молекули витягнутої форми, що складаються з двох поліпептидних ланцюгів (α та β), які утворюють подвійну спіраль. Паличкоподібні молекули тропоміозину (довжиною 40 нм і товщиною 2 нм) розміщуються в борозенках між двома ланцюгами F-актину таким чином, що кожна молекула тропоміозину контактує із сімома молекулами (субодиницями) G-актину.
Тропонін — білок тонких філаментів, що складається з трьох субодиниць: TnT, TnI, TnC. Тропонінові комплекси мають глобулярну форму і розміщуються впродовж актинового філамента з інтервалами в 38,5 нм, контактуючи з кінцями молекул тропоміозину (рис. 32.6).
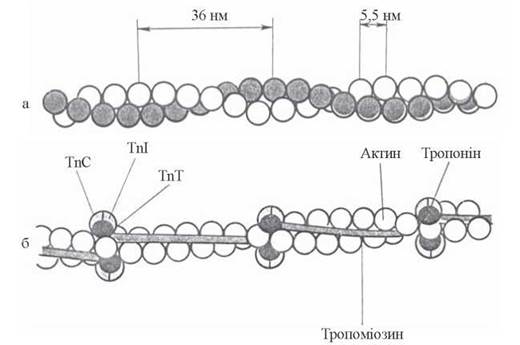
Рис. 32.6. Схема взаємодії тропоміозину (Tm) і тропонінів з актином: а — спіраль F-актину, б — взаємодія Tm та тропонінів із субодиницями G-актину.
Найбільш вивченим компонентом тропонінового комплексу є TnC — кальцій-зв’язуючий білок, близький за структурою і властивостями до кальмодуліну — універсального трансдуктора кальцієвих сигналів у біохімічних системах. Білок TnI взаємодіє з актином, TnT — забезпечує взаємодію тропонінового комплексу з тропоміозином.