Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 32. БІОХІМІЯ М’ЯЗІВ І М’ЯЗОВОГО СКОРОЧЕННЯ
32.2. МОЛЕКУЛЯРНІ МЕХАНІЗМИ М’ЯЗОВОГО СКОРОЧЕННЯ
В основу сучасного уявлення про механізми м’язового скорочення покладено запропоновану Г.Хакслі та іншими дослідниками модель ниток (філаментів), що плавно переміщаються
(slide — англ.) впродовж одна одної (H.E. Huxley, J.Hanson, A.F. Huxley, R. Niedergerke, 1954). Головні постулати цієї моделі, що були підтверджені біохімічними, біофізичними й електронно- мікроскопічними дослідженнями:
- товсті (міозинові) та тонкі (актинові) філаменти міофібрил не змінюють своєї довжини протягом м’язового скорочення;
- протягом м’язового скорочення зменшується довжина всього саркомера внаслідок зустрічного руху та перекривання товстих і тонких філаментів;
- скорочувальна сила генерується внаслідок активної взаємодії одного типу філаментів з іншим, сусіднім типом філаментів.
Схема, що ілюструє взаємний рух товстих і тонких філаментів сарюмера в процесі м’язового скорочення, подана на рис. 32.7.
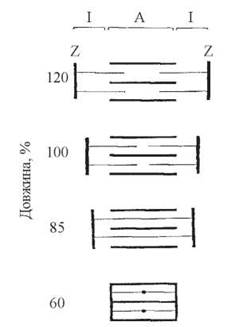
Рис. 32.7. Модель взаємного переміщення філаментів у саркомері (за H.E. Huxley та ін.).
Було також встановлено, що м’язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і розслаблення м’язів.
Гідроліз АТФ до АДФ та ФH здійснюється завдяки АТФ-азній активності глобулярних голівок S1 міозину. Вперше наявність АТФ-азної активності в міозині була виявлена в 1939 р. російськими вченими В.О. Енгельгардтом і М.М. Любимовою.
Залежна від АТФ взаємодія актину з міозином, що призводить до взаємного переміщення тонких і товстих філаментів саркомера, відбувається наступним чином (рис. 32.8):
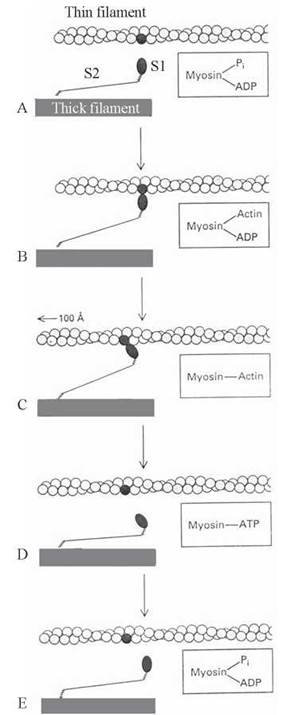
Рис. 32.8. Схема молекулярних механізмів м’язового скорочення (за L.Stryer, 1995, із змінами).
A. У м’язі, що перебуває в стані спокою, S1-голівки міозину не сполучені з актиновими філаментами. Продукти гідролізу АТФ (АДФ та ФH) зв’язані з міозином.
B. При збудженні м’яза Sl-голівки зсуваються в напрямку тонких філаментів і сполучаються з нитками актину (G-субодиницями). ФH вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у просторовому розташуванні голівки S1, що зв’язана з актином (зміщенням кута між голівкою і віссю міофібрили з 90° на 45°). Зміна просторової орієнтації S1-голівки міозину відносно нитки актину призводить до розвитку напруги і пересування тонкого філамента відносно товстого приблизно на 100 А° (10 нм) у напрямку середини саркомера.
D. Взаємодія з актином молекули АТФ супроводжується розривом зв’язку між актином і міозином. S1-голівка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та ФH, завдяки АТФ-азній активності вільних голівок міозину. Продукти гідролізу знову сполучаються з актином. Актинові та міозинові філаменти готові до нового циклу взаємодії та пересування.
Регуляція скорочення скелетних м’язів
Загальна схема м’язового скорочення, що полягає у взаємному переміщенні актинових і міозинових філаментів, стосується усіх типів м’язів. Разом з тим, біохімічні механізми включення процесу та регуляція скорочення і розслаблення суттєво відрізняються в скелетному і серцевому м’язах (з одного боку) та гладенькому — з іншого.
Ініціація м’язового скорочення — процес, що включається генерацією потенціалу дії на сарколемі внаслідок хімічного сигналу, який надходить із нервово-м’язового синапсу (наприклад, при вивільненні холінергічним нейроном ацетилхоліну і взаємодії медіатора з локалізованим у сарколемі холіновим рецептором).
Головним біохімічним регулятором скорочення та розслаблення м’язів є зміни цитозольної концентрації іонів Са2+, яка в стані спокою (розслаблення) становить близько 10-8-10-7 моль/л. Поширення потенціалу дії з сарколеми на трубочки Т-системи, що контактують із мембранами саркоплазматичного ретикулума, спричиняє вихід Са2+ з канальців СР, які відіграють роль депо Са2+ в міоцитах (у комплексі з білком секвестрином). Внаслідок цих процесів концентрація Са2+ в саркоплазмі досягає 10-5 моль/л, що ініціює молекулярні процеси, які є м’язовим скороченням.
Тропоміозин-тропонінова система як регулятор скорочення
Взаємодія між голівками міозину й актином залежить від просторового розташування в тонких (актинових) філаментах тропоміозину. Просторове переміщення молекул тропоміозину, що стерично вивільняє або закриває сайти зв’язування S1-голівок міозину з G-субодиницями актину, може відбуватися за механізмом, схематично зображеним на рис. 32.9.
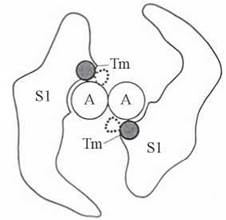
Рис. 32.9. Просторове зміщення молекул тропоміозину (Tm), що впливає на можливість взаємодії S1-голівок міозину з актином (А) (вигляд у розрізі).
У свою чергу, просторові (конформаційні) зсуви молекул тропоміозину ініціюються конформаційними змінами в тропоніновій системі, які спричиняються змінами в концентрації Са2+.
Збільшення концентрації вільного Са2+ призводить до активації Са-залежного компонента тропонінової системи — TnC, що через зміну конформації останнього передає хімічний сигнал на інші компоненти тропонінової системи — TnI та TnT, який контролює просторове розташування тропоміозину. Внаслідок цих молекулярних подій тропоміозин звільняє ділянки взаємодії між актином і S1-голівками міозину, що включає цикл скорочення міофібрил.
Послідовність потоку хімічної інформації, що призводить до скорочення скелетних м’язів, можна подати як:
![]()
Зменшення концентрації Са2+ у саркоплазмі відбувається внаслідок його закачування в канальці саркоплазматичного ретикулума, що відбувається внаслідок дії кальцієвого насоса — Са2+-АТФази мембран СР В цих умовах виключається активація тропонінового комплексу, тропоміозин переходить у положення, яке блокує взаємодію міозинових голівок з актиновими філаментами. М’яз переходить у розслаблений стан.
Цикл АТФ-АДФ у регуляції скорочення
Як випливає з розглянутого вище механізму, необхідною передумовою готовності м’яза до скорочення є АТФ-азна реакція гідролізу АТФ, що постачає АДФ і ФH. Тільки в комплексі з АДФ та ФHS1-голівки міозину готові до скорочення (стан А та Е на рис. 32.8) і «чекають» хімічного сигналу для взаємодії з актиновими філаментами.
З іншого боку, дисоціація зв’язку між міозиновими й актиновими філаментами (тобто повернення м’яза в стан розслаблення) залежить від наявності АТФ, який взаємодіє з S1-голівками міозину, переводячи м’яз у стан розслаблення (етап С-D). В умовах зменшення концентрації АТФ у міоцитах (пошкодження біоенергетичних процесів, гіпоксія) переважна більшість S1-голівок міозину залишаються сполученими з актином — розвивається ригідність м’язів, крайнім проявом якої є трупне задубіння.
Скорочення гладеньких м’язів
Включення процесу скорочення в гладеньких м’язах також ініціюється кальцієм, проте механізми його впливу на функціонування актин-міозинової системи суттєво відрізняються від розглянутих.
Регуляція циклу скорочення-розслаблення в гладеньких м’язах реалізується за рахунок зворотного фосфорилювання-дефосфорилювання легких ланцюгів молекул міозину.
Фосфорилювання міозину в гладеньких м’язах відбувається при дії Са-залежного ферменту кінази легких ланцюгів (КЛЛ) міозину (за рахунок макроергічних фосфатів АТФ), дефосфорилювання — ферменту протеїнфосфатази легких ланцюгів.
Біохімічна послідовність реакцій:
1. Збільшення внутрішньоклітинної концентрації Са2+ (за рахунок входу з екстрацелюлярного простору та вивільнення з клітинних депо).
2. Взаємодія Са2+ з кальмодуліном (КМ) (з утворенням комплексу КМ-4Са2+).
3. Активація комплексом КМ-4Са2+ ферменту КЛЛ.
4. Фосфорилювання легких ланцюгів у голівках молекул міозину (p-ланцюгів). Внаслідок фосфорилювання p-ланцюгів голівки міозину стають здатними до взаємодії з актином.
5. Зв’язування міозинових голівок з молекулами актину в тонких філаментах — запуск циклу скорочення м’яза.
Розслаблення гладенького м’яза відбувається в умовах зниження концентрації Са2+, що спричиняє зупинення механізму активації КЛЛ; дефосфорилювання легких ланцюгів трансформує міозинові голівки в молекулярний стан, в якому вони неспроможні взаємодіяти з актином.