Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ II. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ МЕТАБОЛІЗМУ
ГЛАВА 7. ФЕРМЕНТИ II. МЕХАНІЗМИ КАТАЛІЗУ. КІНЕТИКА. РЕГУЛЯЦІЯ
7.1. МЕХАНІЗМИ ДІЇ ФЕРМЕНТІВ
Ферменти збільшують швидкості біохімічних реакцій, які вони каталізують, у 108-1020 разів; при відсутності ферменту будь-яка метаболічна реакція практично не відбувається. Відомо, що константа швидкості хімічної реакції залежить від її енергії активації та температури, що виражається рівнянням Арреніуса в експоненційній формі:
k = Ae-ΔE/RT.
Під енергією активації (ДЕ в рівнянні Арреніуса) в хімічній термодинаміці розуміють додаткову енергію, необхідну для переходу молекул (субстратів S) у перехідний (активований) стан (S*), який передує їх перетворенню в продукти реакції. Згідно з цим, експоненційний член рівняння е-ΔЕ/RT (фактор Больцмана) — доля молекул у системі, які мають енергію, достатню для хімічного перетворення.
Оскільки всі метаболічні процеси в живих організмах перебігають в ізотермічних умовах, каталітична дія ферментів реалізується за рахунок зниження останніми енергії активації (ΔЕ) біохімічної реакції, що збільшує фактор Больцмана, і, відповідно, константу швидкості реакції на декілька порядків:
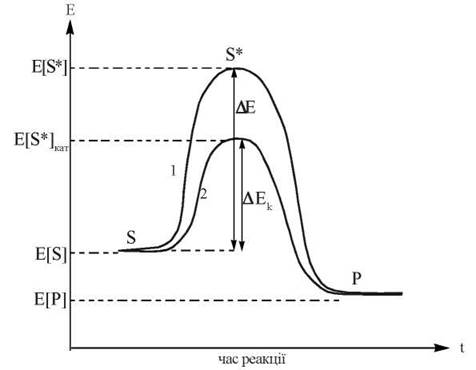
Рис. 7.1. Енергетичні діаграми хімічної реакції (S → P) без каталізатора (1) та в присутності каталізатора — ферменту (2). ΔЕ та ΔЕк — енергія активації реакції без та в присутності каталізатора, відповідно.
Порівняно з хімічними каталізаторами, ферменти значно зменшують ΔЕ реакцій, які вони каталізують. Так, наприклад, у реакції розщеплення перекису водню
![]()
енергія активації може зменшуватися під дією неорганічних каталізаторів (йодиду, платини) або, більш сильно, під впливом специфічного ферменту каталази, що призводить до відповідних величин збільшення швидкості реакції.
Таблиця 7.1. Неферментативний та ферментативний каталіз розщеплення перекису водню (t = 25 °С; константу швидкості некаталізуючої реакції прийнято за одниницю) (за S. Rapoport, 1964)
Умови реакції |
Енергія активації (ккал/моль) |
Кількість активованих молекул |
Збільшення константи швидкості реакції |
Без каталізатора |
18 |
1,3 · 10-13 |
1 |
+ Йодид |
14 |
1 · 10-10 |
8 · 104 |
+ Платина |
12 |
3 · 10-9 |
2 · 104 |
+ Каталаза |
2 |
4 · 10-2 |
3 · 1011 |
Активні центри ферментів
Зниження енергії активації біохімічної реакції і, як результат високої каталітичної ефективності ферментів досягають за рахунок взаємодії субстратів із певними ділянками ферментної молекули (активними, або каталітичними центрами), що супроводжується зближенням та орієнтацією відповідних хімічних груп субстратів і створює стеричні умови, необхідні для реалізації специфічних актів каталізу.
Активний центр — ділянка молекули ферментного білка, що взаємодіє із субстратом під час ферментативної реакції і необхідна для перетворення субстрату в каталітичному процесі.
Він формується з певних ділянок поліпептидного ланцюга, що просторово зближені за рахунок унікальної тривимірної конформації ферментного білка.
До складу активних центрів різних ферментів входять радикали певних амінокислотних залишків, головним чином ОН-групи серину, треоніну та тирозину, імідазольне кільце гістидину, SH-група цистеїну, СОО--групи дикарбонових амінокислот, NH3+-групи аргініну та лізину (рис. 7.2). В утворенні активних центрів беруть участь також кофактори даного ферменту: простетичні групи, іони металів (рис. 7.3).
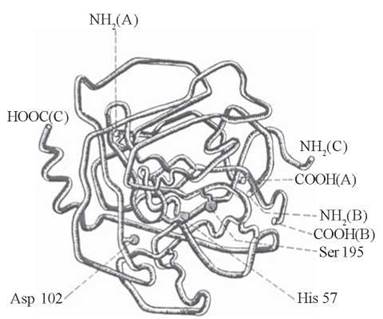
Рис. 7.2. Тривимірна будова ферменту хімотрипсину. Активний центр ферменту сформований амінокислотними залишками Ser-195, His-57 та Asp-102.
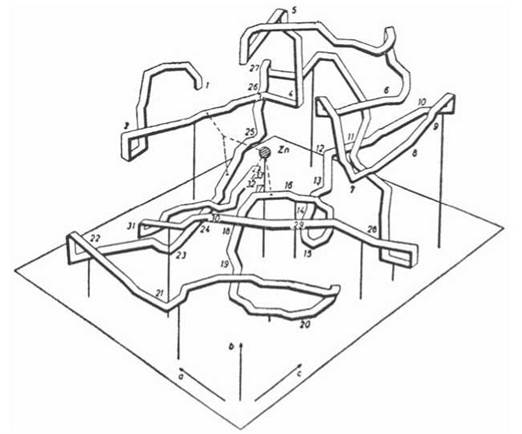
Рис. 7.3. Розташування атома Zn в активному центрі ферменту карбоангідрази.
Активний центр локалізується, як правило, в заглибленні, просторовій ніші, що утворюється в макромолекулі білка-ферменту. Структура активного центру є комплементарною до просторової будови субстрату, що стало основою уявлення Е. Фішера про відповідність ферменту і субстрату як «ключа і замка». Пізніші теорії ферментативного каталізу (Д. Кошленд) враховують можливі взаємні зміни просторових конформацій ферменту і субстрату під час їх взаємодії («теорія індукованої відповідності ферменту і субстрату»).
У структурі активного центру розрізняють:
- ділянку, що зв’язує субстрат, або контактну («якірну») ділянку; вона містить радикали полярних (зв’язують молекули субстрату за рахунок водневих зв’язків або дипольних взаємодій) або неполярних амінокислотних залишків (створюють в активному центрі гідрофобні зони, що взаємодіють із відповідними радикалами в субстраті);
- каталітично активну ділянку, до складу якої входять хімічні групи, що беруть безпосередню участь у перетворенні субстрату (групи -ОН, -SH, ≥N, -NH3+, -СОО-).
Механізми перетворення субстрату за каталітичної дії ферменту
У механізмі ферментативного перетворення субстрату беруть участь такі молекулярні ефекти:
1. Ефекти зближення та орієнтації. Адсорбція та фізико-хімічна взаємодія субстратів з активними центрами ферментів супроводжуються локальним зростанням концентрації реагуючих молекул, їх зближенням та найбільш ефективною орієнтацією одна до одної та до каталітично активних груп активного центру.
2. Ефекти кислотно-основного каталізу. Певні функціональні групи радикалів амінокислот, що входять до структури активних центрів, мають властивості кислот або основ Бренстеда, тобто донорів чи акцепторів протонів (амінні, карбоксильні, сульфгідрильні, імідазольні групи).
Прикладом кислотно-основного каталізатора є імідазольна група гістидину, яка у взаємодії з гідроксильною групою серину створює кислотно-основну пару Бренстеда. Функціональні групи ≥N та -OH, що відіграють каталітичну роль, розміщені, як правило, в різних ділянках пептидного ланцюга та зближуються за рахунок унікальної третинної структури ферментного білка.
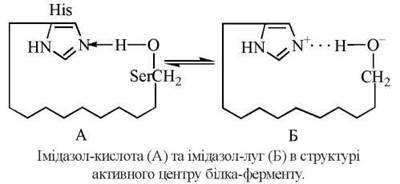
3. Ефекти нуклеофільного та електрофільного каталізу. Функціональні групи амінокислотних залишків, що входять до складу активних центрів, можуть виступати в каталітичному акті перетворення субстратів як донори електронів (нуклеофіли) або акцептори електронів (електрофіли), тобто як основи або кислоти Льюіса, відповідно.
Нуклеофільні групи в складі активних центрів ферментів:
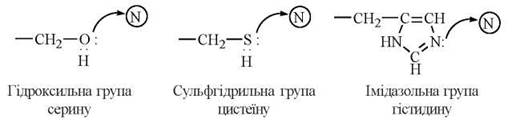
Електрофільні групи в складі активних центрів ферментів:
- NH3+ — групи аргініну та лізину;
- іони металів-кофакторів (Mg2+, Fe3+, Mn2+, Cu2+).
Механізми каталітичної дії хімотрипсину
Механізми ферментативної дії найбільш вивчені для гідролаз, які є каталізаторами з активними центрами кислотно-основного типу. Представниками таких ферментів є біокаталізатори, до складу активних центрів яких входять гістидин-серинові каталітичні комплекси; це такі поширені ферменти, як хімотрипсин (КФ 3.4.4.5), трипсин (КФ 3.4.4.4), тромбін (КФ 3.4.4.13), еластаза (КФ 3.4.21.11), ацетилхолін- естераза (КФ 3.1.1.7).
Хімотрипсин (α-хімотрипсин) — протеолітичний фермент (протеаза), що розщеплює пептидні зв’язки за участю води в молекулах певних білків та пептидів. Як уже зазначалося (рис. 7.2), каталітичний центр хімотрипсину утворюється з гідроксильної групи серину та імідазольної групи гістидину, що розташовані в 195-му (Ser-195) та 57-му (His-57) положеннях пептидного ланцюга молекули ферменту.
Перший етап каталітичного акту.
Імідазол діє як основа Бренстеда, віттягуючи на себе протон від ОН-групи серину, що спричиняє появу надлишкової електронної щільності на атомі кисню серину та полегшує нуклеофільну атаку групи -СО-субстрату гідроксилом серину. Як результат цього процесу, відбувається ацилування ферменту за рахунок перенесення ацильного радикала від субстрату на сериновий залишок (Ser-195) ферменту (рис. 7.4 а,б).
Другий етап каталітичного акту.
Атом гістидину (His-57) здійснює нуклеофільну атаку на кисень ацильного похідного серину, що сприяє відщепленню та перенесенню ацилу на зовнішній акцептор — молекулу води (рис. 7.4 в,г).
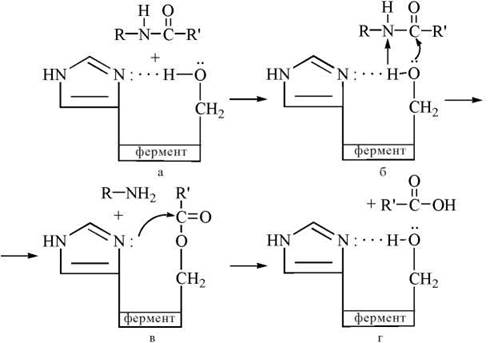
Рис. 7.4. Участь функціональних груп активного центру хімотрипсину (His-57 та Ser-195) в каталітичному акті розщеплення пептидного зв'язку в молекулі субстрату.
Механізми каталітичної дії ацетилхолінестерази
Ацетилхолінестераза (КФ 3.1.1.1) — фермент, що розщеплює гідролітичним шляхом молекулу нейромедіатора ацетилхоліну:
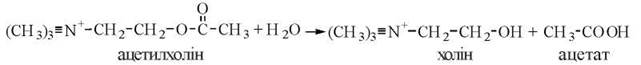
Ацетилхолінестераза також належить до гістидин-серинових гідролаз і здійснює гідролітичне розщеплення субстрату з проміжним утворенням ацетильованого за залишком серину ферменту. Разом із тим, до активного центру ацетилхолінестерази входить гідроксильна група тирозину, що, виконуючи функцію лужного каталізатора, сприяє гідролізу ацетильованого серину та регенерації вихідної структури активного центру ферменту.