Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 13. МЕТАБОЛІЗМ ВУГЛЕВОДІВ. III. ОБМІН ГЛІКОГЕНУ ТА ГЛІКОКОН’ЮГАТІВ
13.4. МЕТАБОЛІЗМ ВУГЛЕВОДНИХ КОМПОНЕНТІВ ГЛІКОКОН’ЮГАТІВ
Глікозилювання невуглеводних молекул є важливим класом біохімічних реакцій, що призводять до утворення гібридних молекул глікокон’югатів. У результаті реакцій глікозилювання олігосахаридні та полісахаридні ланцюги приєднуються ковалентними зв’язками до поліпептидів або ліпідів, утворюючи фізіологічно важливі глікопротеїни, гліколіпіди та протеоглікани.
Біосинтез глікон’югатів
Процеси глікозилювання білків і ліпідів відбуваються в ендоплазматичному ретикулумі та апараті Гольджі і каталізуються специфічними глікозилтрансферазами. Біохімічні реакції синтезу олігосахаридних фрагментів глікопротеїнів, гліколіпідів та гетерополісахаридних фрагментів протеогліканів (глікозамінгліканів) в цілому співпадають і будуть розглянуті на прикладі більш детального вивченого процесу утворення вуглеводних компонентів глікопротеїнів. Проте існують суттєві відмінності в молекулярних механізмах біосинтезу О- та N-зв’язаних глікопротеїнів.
1. Синтез О-зв’язаних глікопротеїнів
Олігосахаридні ланцюги глікопротеїнів О-глікозидного типу конструюються шляхом ступеневого приєднання моносахаридних залишків до ОН-груп серину або треоніну поліпептидної частини молекули. Донорами вуглеводних залишків у цих реакціях є нуклеотидцукри, зокрема УДФ-N-ацетилгалактозамін (UDP-GalNAc), УДФ-галактоза (UDP-Gal) та ЦМФ-К-ацетилнейрамінова (сіалова) кислота (СМР-NeuAc).
Ферменти, що каталізують перенос моносахаридного залишку від нуклеотид- цукрів на OH-Ser(Thr), — мембранозв’язані глікопротеїн-глікозилтрансферази.
Першим цукром в олігосахаридному ланцюзі глікопротеїну, що приєднується безпосередньо до ОН-групи серину (треоніну) поліпептидного компонента є, як правило, N-ацетилгалактозамін (GalNAc), другим — галактоза (Gal) або N-ацетилнейрамінова кислота (NeuAc):
![]()
Така послідовність реакцій глікозилювання призводять до утворення біомолекул, прикладами яких є О-зв’язані полісахариди глікопротеїнів слини (муцинів) (а) та сіалоглікопротеїнів еритроцитарних мембран людини (б):
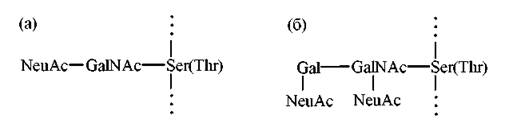
Початок процесу глікозилювання, тобто приєднання перших моносахаридних залишків до пептидного ланцюга, відбувається в ендоплазматичному ретикулумі, тобто під час синтезу поліпептиду (трансляції), приєднання термінальних моносахаридів — в комплексі Гольджі.
2. Синтез N-зв’язаних глікопротеїнів
Особливістю синтезу N-зв’язаних глікопротеїнів є участь високомолекулярного спирту ізопреноїдної природи — доліхолфосфату, який виступає в ролі проміжного переносника олігосахаридних фрагментів.
За хімічною будовою доліхол є високомолекулярним спиртом, що, подібно до каучука, має найбільшу довжину з природних вуглеводнів. Гідрофобна основа доліхолу занурена в товщу ліпідного біслою біомембран, а ОН-група, що взаємодіє з водною фазою, здатна акцептувати моносахаридні фрагменти при послідовній дії специфічних глікозилтрансфераз.
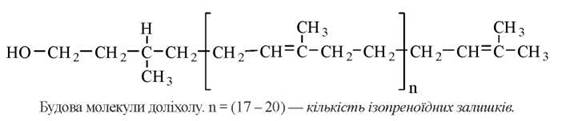
Включенню доліхолу (Dol) в реакції глікозилювання передує його фосфорилювання за участю ферменту доліхолкінази та ATP як донору фосфату:
![]()
Фосфорильований доліхол взаємодіє з активованою молекулою N-ацетилглюкозаміну у формі UDP-GlcNAc в реакції, яка становить перший етап глікозилювання доліхолу:
![]()
За рахунок послідовної дії специфічних глікозилтрансфераз та за участю відповідних нуклеотидцукрів відбувається формування олігосахарид-пірофосфорилдоліхолу — молекулярної структури, що є донором олігосахаридних фрагментів у процесі N-глікозилювання глікопротеїнів. У подальшому олігосахариди, сполучені з молекулами доліхол-пірофосфату, в цілому вигляді переносяться на амідні групи одного або декількох залишків аспарагіну акцепторного білка. Реакція каталізується мембранозв’язаною олігосахарид-трансферазою і відбувається в ендоплазматичному ретикулумі та апараті Гольджі.
N-зв’язані глікопротеїни, що утворилися в результаті розглянутої послідовності реакцій, мають спільне для всіх глікопротеїнів пентасахаридне ядро (Man)3(GlcNAc)2, сполучене з NH-групою аспарагіну:

Із зазначеним пентасахаридом зв’язані різні за будовою зовнішні олігосахаридні ланцюги. Ці зовнішні розгалужені олігосахаридні фрагменти, залежно від складу моносахаридних залишків та будови ланцюгів, поділяються на складні, гібридні та збагачені манозою олігосахариди.
Глікопротеїни, що утворилися в результаті процесів О- та N-глікозилювання, залишаються зв’язаними з мембранними структурами у вигляді інтегральних білків мембран або секретуються в екстрацелюлярний простір.
3. Синтез гліколіпідів
Гліколіпіди — важливі структурні компоненти біомембран, що визначають, разом із мембранними глікопротеїнами, антигенні властивості клітин.
Подібно до утворення глікопротеїнів, формування гліколіпідів, зокрема глікосфінголіпідів, відбувається за механізмом послідовного нарощування олігосахаридів за участю специфічних глікозилтрансфераз. Донорами моносахаридів та їх похідних є нуклеотидцукри, що переносять залишки цукрів на молекулярну основу, якою виступає церамід (ацилсфінгозин). Процес відбувається за схемою:
![]()
За розглянутим механізмом відбувається синтез гліколіпідів мембран еритроцитів, що складають антигенні детермінанти груп крові людини за системою АВО. Генетично детерміновані відмінності в групах крові визначаються особливостями молекулярної будови олігосахаридних компонентів мембранних гліколіпідів та глікопротеїнів, зокрема інтегрального білка мембран еритроцитів — глікофорину.
В осіб із групою крові О функціонує ген (Н), експресія якого супроводжується наявністю в мембранах еритроцитів гліколіпіду, що містить у своєму складі базовий олігосахарид із термінальною фукозою — олігосахарид типу О, або так званий антиген Н. Особини з групами крові А та В мають алельні гени (IA та IB, відповідно), що відповідальні за синтез глікозилтрансфераз, які здатні модифікувати базовий олігосахарид О, приєднуючи до нього залишки N-ацетилгалактозаміну (тип А) або галактози (тип В).
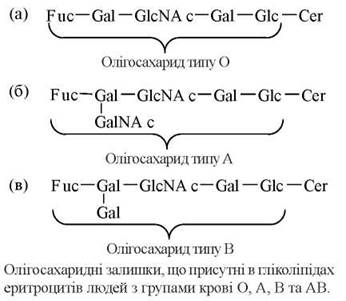
Гетерозиготні особини, в еритроцитах яких експресовані обидва типи олігосахаридів (А та В) мають групу крові АВ. Відомо більше 30 різних груп крові, що розрізняються антигенними детермінантами еритроцитів, тобто будовою мембранних гліколіпідів та глікопротеїнів.
Катаболізм глікокон’югатів
Розщеплення гетерополісахаридних фрагментів глікокон’югатів — протеогліканів, глікопротеїнів і гліколіпідів реалізується за участю глікозидаз, що локалізовані в лізосомах, та специфічні до різних типів глікозидних зв’язків.
Найбільш вивченими є лізосомальні ферменти, які беруть участь у деградації вуглеводних компонентів протеогліканів (глікозамінгліканів) та гліколіпідів. Уроджені порушення розщеплення цих сполук (ензимопатії) проявляються глікозидозами, за яких відбувається внутрішньоклітинне накопичення певних форм гетерополісахаридів.
Деградація гетерополісахаридних структур протеогліканів каталізується ферментами, які за своєю субстратною специфічністю поділяються на ендоглікозидази, екзоглікозидази, сульфатази. До глікозидаз, що беруть участь у катаболізмі глікозамінгліканів, належать:
Гіалуронідаза — широко розповсюджена в тканинах ендоглікозидаза, що діє на гіалуронову кислоту та хондроїтинсульфати, розщеплюючи їх до тетрасахаридних фрагментів.
β-Глюкуронідаза — екзоглікозидаза, що відщеплює глюкуронову та ідуронову кислоту від тетрасахаридів (див. вище) та таких гетерополісахаридів, як дерматансульфати, гепарансульфати, хондроїтинсульфати, гіалуронова кислота. При спадковій недостатності ферменту у хворих спостерігається виділення глікозамінгліканів із сечею.
β-Галактозидази — множинні ферменти, що розщеплюють внутрішні в-галактозидні зв’язки в олігосахаридних залишках протеогліканів, глікопротеїнів та гліколіпідів.
β-D-Ацетилгексозамінідаза — екзоглікозидаза, що відщеплює від вуглеводних компонентів глікокон’югатів термінальні N-ацетилгексозаміни GlcNAc та GalNAc. Спадкова недостатність ферменту спостерігається при таких гліколіпідозах, як хвороби Тея-Сакса та Зандхоффа.
α-L-Ідуронідаза — екзоглікозидаза, що відщеплює від полісахаридних ланцюгів термінальні залишки L-ідуронової кислоти. Відомо декілька форм спадкових порушень, пов’язаних із недостатністю цього ферменту.
Існує декілька лізосомальних сульфатаз, що відщеплюють сульфатні залишки від різних мономерних одиниць у складі глікозамінгліканів, зокрема арилсульфатаза А, арилсульфатаза В та арилсульфатаза С. Недостатність сульфатаз проявляється декількома формами глікозидозів.