Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ IV. МОЛЕКУЛЯРНІ МЕХАНІЗМИ СПАДКОВОСТІ ТА РЕАЛІЗАЦІЇ ГЕНЕТИЧНОЇ ІНФОРМАЦІЇ
ГЛАВА 19. БІОСИНТЕЗ НУКЛЕОТИДІВ
Структурними компонентами інформаційних нуклеїнових кислот — ДНК та РНК є нуклеотиди пуринового та піримідинового ряду (дезоксирибонуклеотиди та рибонуклеотиди). Біосинтез мононуклеотидів є життєво важливим процесом, оскільки він забезпечує утворення біомолекул нуклеїнових кислот та нуклеотидних коферментів, необхідних для реалізації всієї сукупності генетичної інформації, що міститься в живих клітинах.
19.1. БІОСИНТЕЗ ПУРИНОВИХ НУКЛЕОТИДІВ
Ферментні системи організму людини і тварин здатні до синтезу нуклеотидних структур на основі біомолекул-попередників. У процесі біосинтезу пуринових нуклеотидів беруть участь молекули амінокислот (гліцину, аспартату та глутаміну) та каталітично активні одновуглецеві групи у формі похідних тетрагідрофолату (Н4-фолату) і активного СО2, що приєднуються безпосередньо до пентозної частини нуклеотиду - рибозо-5-фосфату.
Організм людини і тварин може також в обмеженій кількості синтезувати пуринові та піримідинові нуклеотиди шляхом використання готових молекул азотистих основ, що вивільняються при катаболізмі нуклеїнових кислот і потрапляють в організм із їжею, але основним механізмом поповнення внутрішньоклітинного пулу нуклеотидів є їх синтез de novo, тобто з більш простих метаболічних попередників.
Походження окремих атомів C та N у молекулі пурину, що входить до складу пуриннуклеотидів, подано на схемі:
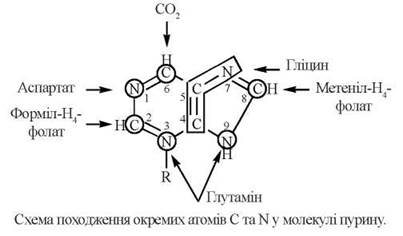
Пуриновим рибонуклеотидом, який синтезується de novo в результаті послідовного приєднання атомів вуглецю та азоту до молекули рибозо-5-фосфату, є інозин-5'-монофосфат (ІМФ), який у подальшому перетворюється на аденозин-5'-монофосфат (АМФ) та гуанозин-5'-монофосфат (ГМФ).
Реакції біосинтезу ІМФ
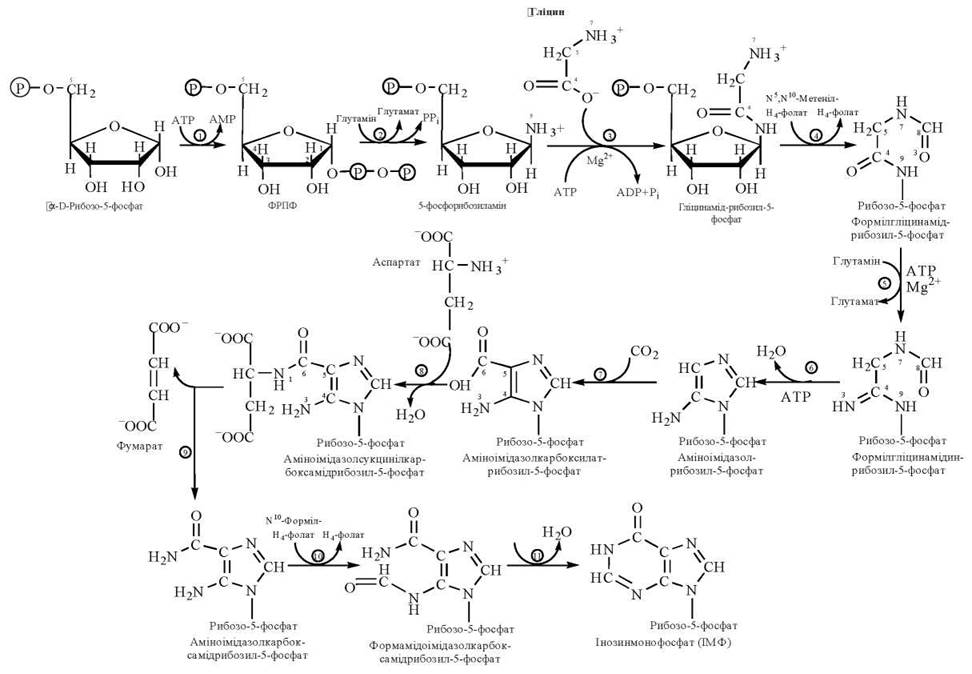
Рис. 19.1. Метаболічна карта біосинтезу пуринових нуклеотидів.
Послідовність ферментативних реакцій, що призводять до утворення ІМФ, є такою (рис. 19.1):
(1) взаємодія α-D-рибозо-5-фосфату з АТФ з утворенням 5-фосфорибозил-1-пірофосфату (ФРПФ);
(2) взаємодія ФРПФ із глутаміном з утворенням 5-фосфорибозиламіну;
(3) взаємодія 5-фосфорибозиламіну з гліцином з утворенням гліцинамід- рибозил-5-фосфату (ГАР);
(4) взаємодія ГАР з активною формою форміату ![]() (N5,N10-метеніл-Н4-фолатом) з утворенням форміл-ГАР;
(N5,N10-метеніл-Н4-фолатом) з утворенням форміл-ГАР;
(5) взаємодія форміл-ГАР з глутаміном (донором аміногрупи) з утворенням формілгліцинамідино-рибозил-5-фосфату (форміл-ГАМ);
(6) взаємодія форміл-ГАМ з АТФ із замиканням імідазольного кільця, тобто утворенням сполуки, що містить п’ятичленне кільце пуринового циклу — аміноімідазол-рибозил-5-фосфату (АІР);
(7) карбоксилювання АІР з утворенням аміноімідазолкарбоксилат-рибозил-5-фосфату (АІКР);
(8) взаємодія АІКР із аспартатом (донором аміногрупи) з утворенням проміжної сполуки — аміноімідазолсукцинілкарбоксамід-рибозил-5-фосфату (АІСКР);
(9) розщеплення АІСКР з елімінацією фумарату та утворенням аміноімідазолкарбоксамід-рибозил-5-фосфату (АІКАР);
(10) формілювання АІКАР за рахунок ![]() -групи N10-форміл-Н4-фолату з утворенням формамідоімідазолкарбоксамід-рибозил-5-фосфату (ФАІКАР);
-групи N10-форміл-Н4-фолату з утворенням формамідоімідазолкарбоксамід-рибозил-5-фосфату (ФАІКАР);
(11) дегідратація та циклізація ФАІКАР з утворенням першого пуринового нуклеотиду — інозинмонофосфорної (інозинової кислоти, ІМФ).
Уся послідовність біохімічних реакцій — блискучий приклад складності «молекулярної логіки живого»!
Утворення АМФ та ГМФ
Інозинмонофосфат є попередником в утворенні інших пуринових рибонуклеотидів — аденозинмонофосфату (АМФ) та гуанозинмонофосфату (ГМФ).
Синтез АМФ здійснюється шляхом таких реакцій:
1) заміщення кисню при С-6 пурину на аміногрупу, донором якої є аспарагінова кислота; проміжний продукт реакції — аденілосукцинат, утворення якого потребує хімічної енергії у формі макроергічного зв’язку ГТФ;
2) розщеплення аденілосукцинату з вивільненням фумарату та утворенням аденозин-5'-монофосфату.
Синтез ГМФ відбувається також у дві стадії:
1) окислення вуглецю (С-2) в кільці пурину з утворенням ксантилової кислоти (ксантозин-5'-монофосфату); реакція потребує наявності НАД+ як акцептора водню;
2) заміщення кисню при C-2 на аміногрупу, донором якої є амідна група глутаміну; амідування спряжене з розщепленням двох макроергічних зв’язків АТФ — в результаті реакції утворюється гуанозин-5'-монофосфат.
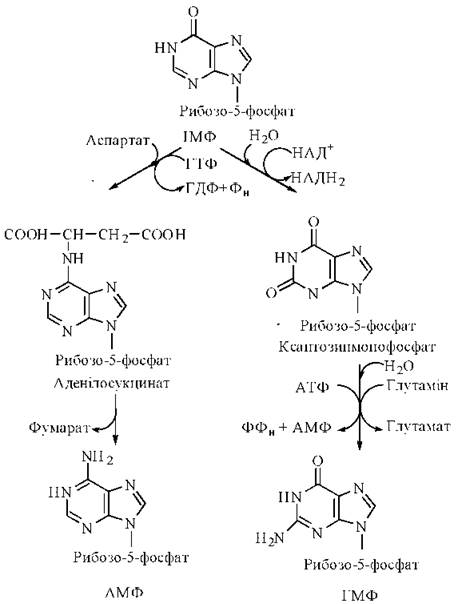
Схема утворення аденілової (АМФ) та гуанілової (ГМФ) кислот з ІМФ.
Утворення АТФ та ГТФ
Оскільки біосинтез полінуклеотидів РНК і ДНК вимагає наявності нуклеозидтрифосфатів (НТФ) та дезоксирибонуклеозидтрифосфатів (дНТФ) (глава 20), важливою метаболічною ланкою є фосфорилювання відповідних пуринових та піримідинових (див. нижче) нуклеозидмонофосфатів.
Перетворення нуклеозидмонофосфатів на нуклеозиддифосфати та нуклеозидтрифосфати реалізується за рахунок макроергічних зв’язків АТФ і каталізується послідовною дією ферментів нуклеозидмонофосфокіназ та нуклеозиддифосфокіназ:
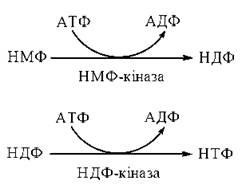
Зокрема, утворення ГТФ з ГМФ реалізується таким шляхом:
![]()
Перетворення АМФ на АДФ відбувається в результаті дії аденілаткінази:
![]()
АТФ, макроергічні зв’язки якої витрачаються в зазначених кіназних реакціях, регенерується в результаті окисного фосфорилювання.
Регуляція синтезу пуринових нуклеотидів
Синтез пуринових нуклеотидів регулюється за принципом негативного зворотного зв’язку — кінцеві продукти біосинтетичного шляху (АМФ, ГМФ, АТФ, ГТФ) гальмують певні ферментативні реакції їх утворення. Враховуючи біологічну важливість для самого існування клітини координованого синтезу нуклеотидів як попередників в утворенні ДНК і РНК, контроль їх кількісного складу здійснюється на декількох регуляторних ділянках (рис. 19.2).
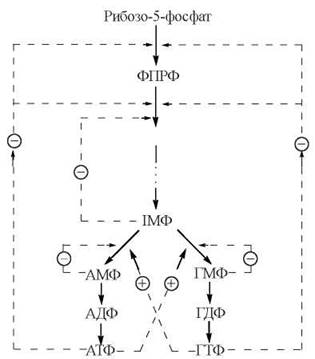
Рис. 19.2. Пункти контролю синтезу пуринових нуклеотидів.
1. Контроль ранньої стадії синтезу пуриннуклеотидів реалізується двома механізмами:
1.1. Шляхом зменшення при дії АМФ та ГМФ активності ферменту, що перетворює α-D-рибозо-5-фосфат на 5-фосфорибозил-1-пірофосфат (ФРПФ) — 5-фосфорибозил-1-пірофосфатсинтетази.
1.2. Шляхом інгібірування при дії ІМФ, АМФ та ГМФ активності регуляторного алостеричного ферменту, що перетворює ФРПФ на 5-фосфорибозиламін — глутамін-ФРПФ-амідотрансферази; це — найважливіший пункт контролю швидкості всього біосинтетичного шляху.
2. Контроль пункту розгалуження в синтезі пуриннуклеотидів, тобто перетворення ІМФ на АМФ та ГМФ відбувається за такими механізмами:
2.1. АМФ гальмує власне утворення з ІМФ шляхом інгібірування активності ферменту аденілосукцинатсинтетази, який перетворює ІМФ на аденілосукцинат;
2.2. ГМФ гальмує власне утворення з ІМФ шляхом інгібірування ферменту ІМФ-дегідрогенази, який перетворює ІМФ на ксантозинмонофосфат.
2.3. АТФ та ГТФ є джерелами метаболічної енергії для синтезу один одного: АТФ необхідний для перетворення ІМФ на ГМФ (та ГТФ), тоді як ГТФ необхідний для перетворення ІМФ на АМФ (та АТФ); тому збільшення (зменшення) концентрації кожного з нуклеозидтрифосфатів призводить до відповідних змін у швидкості утворення іншого нуклеозидтрифосфату, що забезпечує їх координований синтез.
Біосинтез пуринових нуклеотидів із азотистих основ
Розглянутий біосинтез пуринових нуклеотидів із простих попередників—синтез de novo — потребує значних витрат метаболічної енергії у формі макроергічних зв’язків АТФ і ГТФ і відбувається не у всіх тканинах. Цей складний метаболічний шлях має місце переважно в печінці, тоді як в інших тканинах, зокрема в еритроцитах, лейкоцитах, клітинах головного мозку відбувається утворення нуклеотидів із «готових» вільних пуринових основ — аденіну, гуаніну та 6-оксипурину (гіпоксантину).
Джерелом пуринових основ для такого синтезу є пурини, які утворюються з нуклеотидів, синтезованих у печінці, та нуклеотидів, які постійно вивільняються в результаті катаболізму (гідролітичного розщеплення) нуклеїнових кислот і нуклеотидів власних тканин та таких, що надходять у складі харчових продуктів.
Цей механізм більш швидкого біосинтезу пуриннуклеотидів шляхом повторного включення в метаболізм вільних азотистих основ отримав назву «шляху реутилізації» (salvage reactions — англ.).
Реакції повторного використання пуринів для синтезу нуклеотидів перебігають за участю таких ферментів:
(1) аденінфосфорибозилтрансферази, що каталізує реакцію:
![]()
(2) гіпоксантингуанінфосфорибозилтрансферази, що каталізує реакції:
![]()