Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ IV. МОЛЕКУЛЯРНІ МЕХАНІЗМИ СПАДКОВОСТІ ТА РЕАЛІЗАЦІЇ ГЕНЕТИЧНОЇ ІНФОРМАЦІЇ
ГЛАВА 21. БІОСИНТЕЗ БІЛКІВ У РИБОСОМАХ
21.2. РИБОСОМАЛЬНА БІЛОКСИНТЕЗУЮЧА СИСТЕМА
Сучасна ера у розумінні клітинних та молекулярних механізмів трансляції почалася з досліджень П. Замечніка (P. Zamecnik) та його колег, які використали С14-мічені амінокислоти для з’ясування внутрішньоклітинної локалізації білкового синтезу. Було показано, що синтез радіоактивних (С14) білків в печінці експериментальних щурів відбувається в мікросомальній фракції, а саме — в рибосомах. Включення амінокислот у поліпептидні ланцюги in vitro вимагало наявності матричних (інформаційних) РНК — мРНК (іРНК) та транспортних (тРНК) як переносників амінокислот у ділянки білкового синтезу (P. Zamecnik, F. Lipmann, 1960).
Компоненти білоксинтезуючої системи рибосом
Компонентами білоксинтезуючої системи, що реалізують процес трансляції в прокаріотичних та еукаріотичних клітинах, є:
рибосоми — рибонуклеопротеїдні структури з константами седиментації 70s та 80s у прокаріотів та еукаріотів (відповідно), що взаємодіють у процесі трансляції з іншими компонентами системи білкового синтезу; тривимірна будова рибосом має вигляд, поданий на рис. 21.2;
Рис. 21.2. Модель будови 708-рибосоми (вигляд з чотирьох боків).
Тривимірне зображення малої субодиниці рибосоми порівнюють з телефонною трубкою, великої — з ковшем.
мРНК (іРНК), або інший матричний полі- рибонуклеотид, що програмує послідовність включення амінокислот у поліпептидний ланцюг згідно з інформацією, яка міститься в генетичній ДНК;
α-L-амінокислоти в кількості, що відповідає амінокислотному складу повноцінних функціональних білків (звичайно, близько 20 амінокислот);
тРНК, що виконують функцію адапторів у процесі трансляції, взаємодіючи з кодонами мРНК та певними амінокислотами — близько 20 типів різних тРНК, відповідно до кількості амінокислот, що вони акцептують (рис. 21.3);
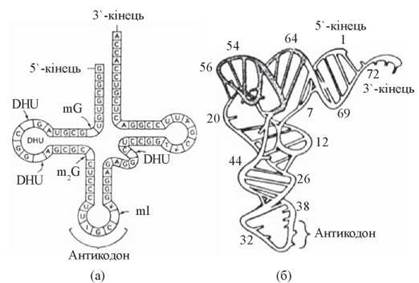
Рис. 21.3. Вторинна (а) та третинна (б) структура аланінової тРНК дріжджів (DHU - дигідроуридин; mG, ml — метильовані гуанозин та інозин).
аміноацил-тРНК-синтетази (АРС-ази) — ферменти, що активують амінокислоти та сполучають амінокислотні залишки з 3'-кінцями акцепторних гілок тРНК. АРС-ази є ферментами з високою специфічністю як відносно певної амінокислоти, так і тРНК, що їй відповідає;
регуляторні білки — білкові фактори ініціації (IF), елонгації (EF) та термі- нації, або рилізинг-фактори (RF); білкові фактори еукаріотів мають позначення eIF, eEF та eRF, відповідно;
коферменти — ГТФ, АТФ.
Рибосоми еукаріотів
У клітинах ядерних організмів рибосоми мають дещо складніші, ніж у прокаріотів, біохімічний склад та молекулярну організацію (рис. 3.10).
Рибосоми здатні до зворотної дисоціації на дві субодиниці:
![]()
В умовах in vitro дисоціація рибосом за субодиниці відбувається за умов зменшення концентрації іонів Mg2+. У клітині існує динамічна рівновага між субодиницями та цілими рибосомами: останні утворюються переважно на період трансляції. В період трансляції певна кількість рибосом (від одиниць до декількох десятків) можуть взаємодіяти з однією молекулою мРНК, утворюючи полірибосоми, або полісоми.
В еукаріотичних клітинах рибосоми можуть функціонувати у вигляді рибосом, зв’язаних з мембранами ендоплазматичного ретикулума («шорсткого ендоплазматичного ретикулума» — ШЕР) або вільних, не зв’язаних з мембранами ШЕР, рибосом. Співвідношення між вільними та мембранозв’язаними рибосомами змінюється при різних фізіологічних станах; в умовах патології клітин суттєво збільшується кількість рибосом, не зв’язаних з мембранами (Ю.І. Губський, 1989).
Транспортні РНК та активація амінокислот
Загальні риси будови різних тРНК були детально розглянуті вище (глава 3, п. 3.4). Для кожної з 20 a-L-амінокислот існує щонайменше один специфічний для неї тип тРНК. Разом з тим, різні молекули тРНК відзначаються схожістю у вторинній та третинній структурі, що пояснюється загальним характером біохімічної функції. Важливою структурною особливістю тРНК є наявність у складі антикодонової петлі специфічного триплету нуклеотидів — антикодону, який є комплементарним кодону мРНК і забезпечує сполучення між тРНК та мРНК (кодон-антикодонову взаємодію) під час утворення ініціюючого комплексу. Саме ці дві біохімічні властивості тРНК — здатність до взаємодії з певною амінокислотою, по-перше, і здатність до взаємодії із специфічним кодоном мРНК, по-друге, є молекулярною основою адапторної функції тРНК, тобто можливості сполучати два інформаційні потоки — «нуклеотидний» та «амінокислотний» в процесі фенотипічної експресії генетичної інформації.
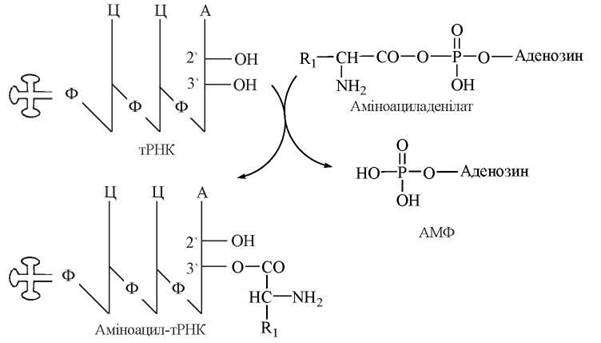
Взаємодія між тРНК та відповідною їй амінокислотою вимагає взаємного розпізнавання (рекогніції) цих молекул, що здійснюється лише за умов наявності спеціальних білків, які мають специфічні сайти для рекогніції як тРНК, так і α-L-амінокислоти. Цей процес розпізнавання та наступного приєднання двох біомолекул різних класів відбувається в два етапи і каталізується аміноацил-тРНК-синтетазами.
Схема взаємодії тРНК з амінокислотами
1. Активація амінокислоти за участю АТФ з утворенням аміноациладенілату:
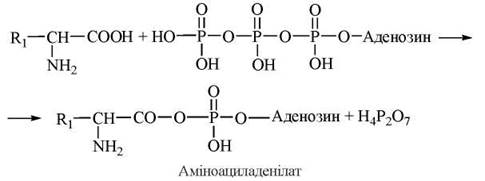
2. Взаємодія аміноациладенілату з 3'-ОН-групою кінцевого аденозильного залишку на акцепторній гілці тРНК; утворення в результаті реакції аміноацил-тРНК: