Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ V. ГОРМОНИ В СИСТЕМІ МІЖКЛІТИННОЇ ІНТЕГРАЦІЇ ФУНКЦІЙ ОРГАНІЗМУ
ГЛАВА 23. ГОРМОНАЛЬНА РЕГУЛЯЦІЯ МЕТАБОЛІЗМУ ТА БІОЛОГІЧНИХ ФУНКЦІЙ КЛІТИНИ. I. БІОХІМІЧНІ СИСТЕМИ ВНУТРІШНЬОКЛІТИННОЇ ТРАНСДУКЦІЇ ГОРМОНАЛЬНИХ СИГНАЛІВ
23.2. МОЛЕКУЛЯРНО-КЛІТИННІ МЕХАНІЗМИ ДІЇ ПЕПТИДНИХ ГОРМОНІВ ТА БІОГЕННИХ АМІНІВ
Гормони здійснюють свої ефекти відносно контролю метаболічних процесів у клітинах-мішенях шляхом комплексування із специфічними рецепторами — білковими молекулами, які взаємодіють з біорегулятором з утворенням ліганд- рецепторних комплексів і здійснюють трансформацію хімічного гормонального сигналу у відповідну, генетично запрограмовану для даного типу клітин, реакцію ефекторних систем.
Залежно від клітинної локалізації рецептора, характеру його взаємодії з гормоном та механізмами реалізації гормонального сигналу, всі гормони поділяють на дві великі групи:
1. Гормони, що не проникають всередину клітин і взаємодіють зі своїми рецепторами, локалізованими в плазматичних мембранах клітини; до цієї групи належить більшість гормонів білково-пептидної природи та похідні амінокислот.
2. Гормони, які для реалізації своєї специфічної дії проникають всередину клітин, де вони взаємодіють з внутрішньоклітинними цитозольними (в деяких випадках — ядерними) рецепторами; до цієї групи належать ліпофільні стероїди, а також тиреоїдні гормони.
Гормони першої групи здійснюють трансформацію регуляторного сигналу в специфічну функціональну активність клітини-мішені за рахунок таких молекулярних подій (рис. 23.3):
(1) взаємодії гормону на поверхні плазматичної мембрани з білковим рецептором;
(2) передачі хімічного сигналу з рецептора, модифікованого за рахунок взаємодії з лігандом (гормоном, іншим біорегулятором), через трансформуючі білки-трансдуктори(G-білки) на внутрішньоклітинні сигнальні системи;
(3) утворення (або вивільнення) внутрішньоклітинних сигнальних молекул — вторинних посередників (циклічних нуклеотидів цАМФ, цГМФ, фосфоінозитидів, іонів Са2+);
(4) взаємодії вторинних посередників з ферментними білками клітини з включенням (як правило, через активацію специфічних протеїнкіназ) ефекторних систем клітини, тобто послідовних стадій розвитку клітинної біохімічної реакції на гормональний стимул.
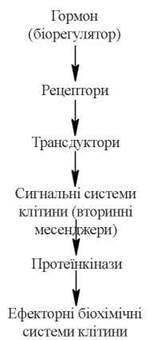
Рис. 23.3. Послідовність трансформації гормонального (біорегуляторного) сигналу в реакцію ефекторних систем клітини через внутрішньоклітинні сигнальні системи.
Рецептори білково-пептидних гормонів та нейромедіаторів
Рецептори для фізіологічно активних сполук — гормонів та інших біорегуля- торів — поділяють на два класи, що розрізняються за своєю молекулярною організацією та послідовністю біохімічних реакцій, які включаються після взаємодії ФАС із специфічними рецепторними білками:
1) рецептори I класу — іонотропні рецептори — такі, що в результаті взаємодії з ФАС спричиняють відкриття іонних каналів на плазматичній мембрані і генерують розвиток надзвичайно швидких (мілісекундних) іонних струмів (Са2+, N+, К+, Сl-). Фізіологічними лігандами для іонотропних рецепторів є нейротрансміттери (ацетилхолін, адреналін, медіаторні амінокислоти тощо), що локалізовані в синапсах нейронів і в нервово-м’язових пластинках.
2) рецептори II класу — метаботропні рецептори — такі, що після взаємодії з ФАС призводять до активації біохімічних ефекторних систем клітини через трансдукуючий G-білок. Реакція ефекторних систем клітини на дію сполук, що взаємодіють з метаботропними рецепторами, є більш повільною і розвивається протягом декількох секунд. Фізіологічними лігандами метаботропних рецепторів є гормони й інші біорегулятори білково-пептидної природи та біогенні аміни — похідні амінокислот (адреналін, дофамін, серотонін, гістамін); до метаботропних належать також м-холінорецептори нейромедіатора ацетилхоліну.
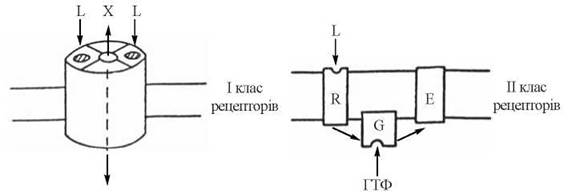
Рис. 23.4. Іонотропні (I клас) та метаботропні (II) рецептори ФАС.
Позначення: L — ліганд (біорегулятор); X — іон, R — рецептор; G — білок-трансдуктор; E — ефекторна молекула (В.Б. Долго-Сабуров та ін., 1989).
Молекулярна організація метаботропних рецепторів
Метаботропні рецептори для гормонів є білковими молекулами (в деяких випадках — глікопротеїнами), поліпептидний ланцюг яких пронизує товщу мембрани з утворенням, як правило, семи трансмембранних спіральних сегментів (петель); N-кінець рецепторного поліпептиду розташований в енкстрацелюлярному просторі і може бути глікозильованим, С-кінець — занурений у цитозоль.
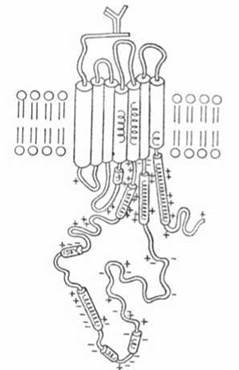
Рис. 23.5. Структура метаботропного рецептора біорегуляторів (на прикладі м-холінорецептора ацетилхоліну).
Білки-трансдуктори та вторинні месенджери
Система трансдукції хімічного сигналу, що його сприймає клітина від біорегулятора, включає взаємодію модифікованого гормон-рецепторного комплексу з білками-трансдукторами, які здійснюють трансформацію та подальшу передачу регуляторного сигналу.
Білки-трансдуктори — G-білки (або N-білки) — внутрішньомембранні білки, які сприймають хімічний сигнал від рецептора, модифікованого за рахунок взаємодії з гормоном або медіатором, та спричиняють зміни функціональної активності ефекторних систем клітини. За молекулярною будовою G-білки є тримерами, що складаються з трьох субодиниць (α, β, γ); α-субодиниця має ГТФ-азну активність — активація G-білка при взаємодії з модифікованим рецептором та передача регуляторного сигналу на каталітичну субодиницю ферменту аденілатциклази супроводжується гідролізом ГТФ до ГДФ та Фн.
Існує декілька типів G-білків:
Gs-білки (стимулюючі) — такі, що активують аденілатциклазу — фермент, що утворює головний вторинний посередник — цАМФ;
Gi-білки (інгібіруючі) — такі, що інгібірують аденілатциклазу;
Gq- білки — такі, що активують фосфоліпазу С — фермент, який спричиняє активацію фосфоінозитидного циклу — ферментної системи, яка призводить до збільшення концентрації Са2+ в цитозолі за рахунок його вивільнення з внутрішньоклітинних депо.
Вторинні месенджери
Сигнал на подальше включення каскаду біохімічних реакцій передається вторинними посередниками, або месенджерами (messenger — посланець, вісник, англ.) — біомолекулами, що передають інформацію від гормону (первинного месенджеру) на ефекторні системи клітини.
До вторинних месенджерів належать: циклічні нуклеотиди — циклічний аденозинмонофосфат (3',5'-АМФ; цАМФ) і циклічний гуанозинмонофосфат (3',5'-ГМФ, цГМФ), фосфоінозитиди та іони Са2+.
Зростання внутрішньоклітинної (цитозольної) концентрації зазначених вторинних посередників здійснюється шляхом:
(1) активації аденілатциклази, що утворює циклічний АМФ;
(2) активації гуанілатциклази, що утворює циклічний ГМФ;
(3) активації фосфоліпази С, що призводить до включення фосфоінозитидного каскаду — механізму мобілізації внутрішньоклітинного Са2+;
(4) надходження Са2+ з екстрацелюлярного простору за рахунок відкриття кальцієвих каналів на плазматичній мембрані (механізм, більш притаманний іонотропним рецепторам).
Протеїнкінази та ефекторні системи клітини
Основними тригерами, що включають ефекторні системи клітини у відповідь на дію гормонів, є ферменти протеїнкінази, дія яких призводить до зміни каталітичної активності певних регуляторних ферментів шляхом їх ковалентної модифікації (АТФ-залежного фосфорилювання) — див. главу 7.
Таким чином, ефекторними механізмами, які реалізують трансформацію гормонального (регуляторного сигналу) через систему вторинних посередників у послідовність специфічних біохімічних реакцій клітини, є:
(1) цАМФ-залежне фосфорилювання ферментних білків (здійснюється через цАМФ-залежні протеїнкінази);
(2) цГМФ-залежне фосфорилювання ферментних білків (здійснюється через цГМФ-залежні протеїнкінази);
(3) Са2+/кальмодулінзалежне фосфорилювання ферментних білків (здійснюється Са/кальмодулін-залежними протеїнкіназами);
(4) Са2+/фосфоліпідзалежне фосфорилювання ферментних білків (здійснюється Са/фосфоліпідзалежними протеїнкіназами);
(5) фосфорилювання ферментних білків через тирозинзалежні кінази; на відміну від вищезазначених протеїнкіназ, що фосфорилюють у ферментних білках залишки серину або треоніну; цей особливий клас кіназ фосфорилює залишки тирозину. Даний тип активації ферментних білків (реалізується при дії на клітини інсуліну, епідермального, тромбоцитарного та інших факторів росту) не потребує наявності вторинних посередників і здійснюється безпосередньо в результаті взаємодії біорегулятора з мембранним рецептором.
Розглянемо детальніше основні з ефекторних механізмів, які реалізуються при дії на клітини гормонів першої групи.
цАМФ та аденілатциклаза
Циклічний аденозинмонофосфат (3',5'-АМФ; цАМФ) був відкритий американським дослідником Е. Сазерлендом при вивченні біохімічних механізмів глікогенолізу в печінці та м’язах, що стимулюється адреналіном і глюкагоном. Подальші дослідження встановили універсальність цАМФ як вторинного посередника в передачі сигналів фізіологічно активних сполук на клітину.
Утворення цАМФ з АТФ відбувається при дії мембранної аденілатциклази:
![]()
його розщеплення з утворенням неактивного продукту — нециклічного аденозин-5'-монофосфату — при дії фосфодіестерази циклічних нуклеотидів:
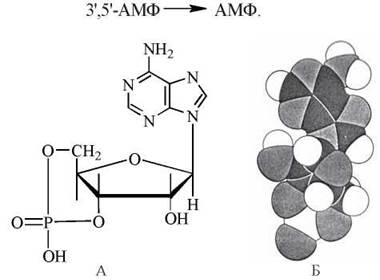
Структурна формула (А) і молекулярна модель (Б) циклічного 3',5'-АМФ.
Взаємодія цАМФ з цАМФ-залежною протеїнкіназою — кіназою А з подальшим фосфорилюванням ключових ферментних та структурних білків є внутрішньоклітинною молекулярною подією, що дозволяє цьому месенджеру виконувати функцію унікального посередника в гормональному контролі клітинних функцій.

Рис. 23.6. Сазерленд (Sutherland) Ерл У. (1915-1974), американський біохімік, фармаколог Встановив будову та роль цАМФ у передачі гормонального сигналу. Нобелівська премія (1971).
До гормонів, що використовують цАМФ як вторинний посередник, належать: адреналін, вазопресин, глюкагон, гонадотропін хоріонічний, дофамін (при взаємодії з D1-рецепторами), кальцитонін, кортикотропін, ліпотропін, лютеїнізуючий гормон, меланоцито-стимулюючий гормон, норадреналін (при взаємодії з β-рецепторами), тиротропний гормон, фолікулостимулюючий гормон.
Поряд з гормонами та медіаторами, що активують аденілатциклазну каскадну систему (діють через трансдуктор Gs), існує певна група біорегуляторів, що гальмують аденілатциклазу і зменшують внутрішньоклітинний рівень цАМФ (діють через Gi- білок). До біорегуляторів, що інгібірують аденілатциклазу, належать: ангіотензин II, ацетилхолін (при взаємодії з м-холінорецепторами), дофамін (при взаємодії з D2-рецепторами), норадреналін (при взаємодії з α2-адренорецепторами), опіоїдні пептиди, соматостатин.
Загальну схему передачі гормональних сигналів на аденілатциклазну систему через трандуктори Gs та G подано на рис. 23.7.
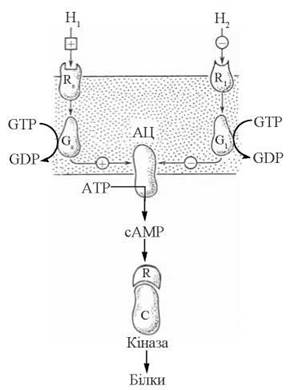
Рис. 23.7. Схема гормональної регуляції клітинних функцій через аденілатциклазну систему. Позначення: H — гормон; R — рецептор; G — трансдуктор.
Са2+ як внутрішньоклітинний месенджер та система фосфоінозитидів
Іони кальцію — еволюційно прадавні внутрішньоклітинні месенджери та регулятори багатьох ферментних систем і фізіологічних функцій клітин, зокрема клітинного росту, поділу клітин, скорочення м’язових та інших скоротливих білків, згортання крові, секреції гормонів та нейромедіаторів, передачі нервового імпульсу тощо.
Регуляторна функція Са2+ (передавання сигналу від гормону, медіатора та активація ефекторних біохімічних систем) здійснюється шляхом зростання внутрішньоклітинної (цитозольної) концентрації іона (звичайно, від 10-8-10-9 до 10-6 М). Це значне зростання концентрації вільного Са2+ здійснюється шляхом включення зовнішньоклітинним біорегулятором одного з таких механізмів:
— відкриття кальцієвих каналів (рецепторчутливих каналів) на плазматичній мембрані і входу в клітину екстрацелюлярного Са2+ (механізм, що реалізується здебільшого при взаємодії нейромедіаторів з іонотропними рецепторами);
— виходу іонів кальцію в цитозоль з його внутрішніх депо — мітохондрій та цистерн (канальців) ендоплазматичного (саркоплазматичного) ретикулума (мобілізація кальцію з внутрішніх депо); включення цього механізму потребує стимуляції гормоном чи іншим біорегулятором фосфоінозитидної системи, інтермедіати якої і спричиняють вихід кальцію з органел.
Перехід клітини із стану активації до функціонального спокою відбувається в результаті зменшення цитозольної концентрації кальцію до вихідної, що забезпечується «викачуванням» Са2+ з цитозолі в екстрацелюлярний простір та «закачуванням» іона у внутрішньоклітинні депо. Цей процес є енергозалежним транспортом проти градієнта концентрації і досягається за рахунок функціонування Са2+-АТФаз плазматичних мембран та мембран внутрішньоклітинних органел.
Кальмодулін
Універсальним акцептором хімічного регуляторного сигналу від іонів Са2+ є кальмодулін (КМ) — білок з молекулярною масою близько 17 кД, який може зв’язувати чотири іони кальцію:
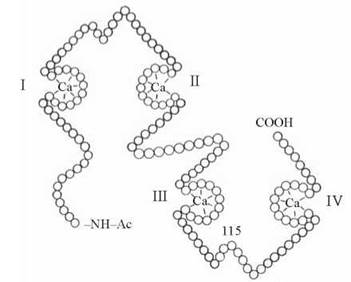
Будова кальмодуліну з головного мозку. I-IV—сайти зв’язування Са2+.
Специфічне зв’язування Са2+ з молекулою КМ призводить до змін конформації білка, який набуває властивості взаємодіяти з чутливими до КМ білками, в тому числі протеїн-кіназами (Са/КМ-залежними протеїнкіназами), які регулюють функції багатьох важливих ферментів, збільшуючи їх каталітичну активність (табл. 23.1).
Таблиця 23.1. Ферменти, що регулюються комплексом Са/КМ
Назва ферменту |
|
Аденілатциклаза |
Кіназа фосфорилази b |
Гуанілатциклаза |
Піруваткарбоксилаза |
Фосфодіестераза циклічних нуклеотидів |
Піруватдегідрогеназа |
Са ,Mg-ATФаза |
Піруваткіназа |
Глікогенсинтаза Гліцерол-3-фосфат-дегідрогеназа |
Фосфоліпаза А2 |
Фосфоінозитидна система та мобілізація Са2+
Встановлення біологічної ролі деяких фосфоінозитидів як агентів, що спричиняють вихід іонів Са2+ з внутрішньоклітинних резервуарів, відкрило додаткову сигнальну систему, що пов’язує гормонорецепторну взаємодію на плазматичній мембрані із стимуляцією біохімічних ефекторних систем клітини.
Головною подією у включенні фосфоінозитидного циклу (каскаду, системи) є активація ферменту фосфоліпази С, яка відбувається в результаті взаємодії деяких екзогенних біорегуляторів з мембранними рецепторами та подальшої передачі хімічного сигналу через трансдукторний Gq-білок. Субстратом фосфоліпази С є мембранний фосфоліпід фосфатидил-інозитол-4,5-дифосфат (ФІФ2), що в цій реакції розщеплюється до інозитол-1,4,5-трифосфату (ІФ3) та 1,2-діацилгліцеролу (ДАГ).
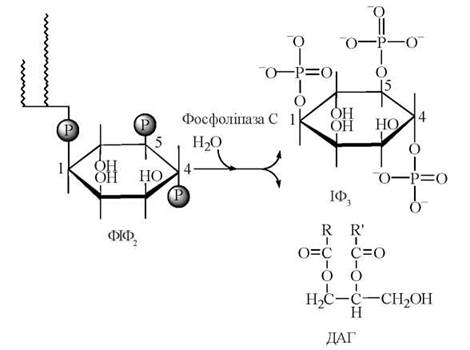
Подальші метаболічні перетворення ІФ3 та ДАГ призводять до ресинтезу фосфатидил-інозитол-4,5-дифосфату (ФІФ2), тобто замикання фосфоінозитидного циклу (рис. 23.8).
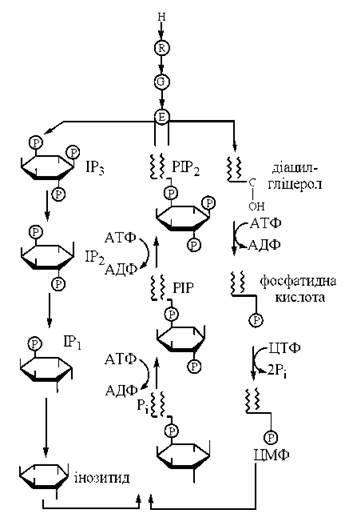
Рис. 23.8. Фосфоінозитидний цикл.
Продукти реакції, яка каталізується гормоночутливою фосфоліпазою С — ІФ3 та ДАГ, є внутрішньоклітинними месен- джерами:
- ІФ3 спричиняє вихід у цитозоль іонів Са2+, депонованих в ендоплазматичному ретикулумі, і збільшення концентрації іона в цитозолі. Вивільнення Са2+ з ендоплазматичного (або, в гладеньких м’язах, — саркоплазматичного ретикулума) зумовлене відкриттям при дії ІФ3 мембранних каналів для кальцію, що локалізовані в зазначених ультраструктурних утвореннях, і є важливим механізмом тонкої фізіологічної регуляції рівня іонізованого цитозольного кальцію.
- ДАГ є активатором Са/фосфоліпідзалежної протеїнкінази (протеїнкінази С) — ферменту, каталітична активність якого проявляється за умов взаємодії з іонами Са2+ та фосфоліпідом фосфатидилсерином. Протеїнкіназа С є ферментом, що виявлений практично у всіх клітинах організмів вищих тварин, за виключенням зрілих без’ядерних еритроцитів; найбільша кількість ферменту знаходиться в головному мозку, селезінці, клітинах лейкозів людини. Згідно з сучасними уявленнями, протеїнкіназа С активує (шляхом фосфорилювання за залишками серину та треоніну) клітинні білки, що визначають швидкість процесів клітинної проліферації, нормального та пухлинного тканинного росту, реакцію клітин на ростостимулюючі фізіологічно активні сполуки та онкогени.
Біохімічне значення діацилгліцеролу полягає також у наявності в його 2-му (β-) положенні залишку арахідонової кислоти (С20:4); гідроліз ДАГ із вивільненням арахідонату поставляє субстрат для біосинтезу важливого класу біорегуляторів — ейкозаноїдів (глава 25).
Фізіологічно активні сполуки, які спричиняють запуск циклу фосфоінозитидів через фосфоліпазу С:
вазопресин, ацетилхолін (при взаємодії з м-холінорецепторами), норадреналін (при взаємодії з α1-адренорецепторами), серотонін (при взаємодії з 5-НТ1-рецепторами), сполука Р, тироліберин.
Прикладами клітинних функцій, залежних від функціонування фосфоінозитидного каскаду, є: глікогеноліз в гепатоцитах; скорочення м’язів; агрегація тромбоцитів та вивільнення ними серотоніну; секреція інсуліну острівковими клітинами підшлункової залози; секреція адреналіну хромафінними клітинами наднирникових залоз, секреція гістаміну мастоцитами.
Схему гормональної регуляції біохімічних та фізіологічних функцій клітини за участю фосфоінозитидів та іонів Са2+ подано на рис. 23.9.
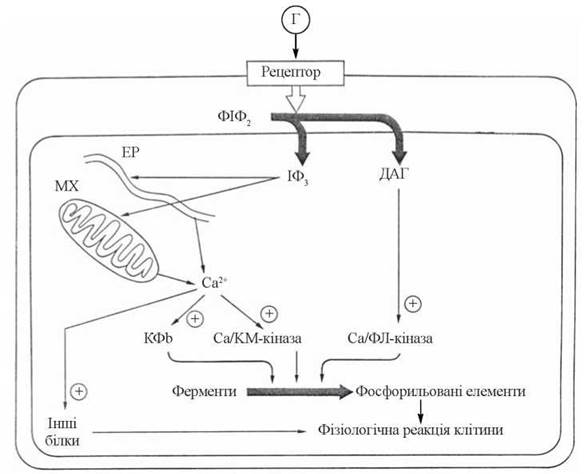
Рис. 23.9. Фосфоінозитидзалежна регуляція клітинних функцій.
Позначення: ФІФ2 — фосфатидил-інозитол-4,5-дифосфат; ІФ3 — інозитол-1,4,5-трифосфату; ДАГ — діацилгліцерол; КФb — кіназа фосфорилази b; Са/КМ-кіназа — Са/кальмодулін-кіназа; Са/ФЛ-кіназа — Са/фосфоліпід-кіназа; ЕР — ендоплазматичний ретикулум; МХ — мітохондрії.