Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ V. ГОРМОНИ В СИСТЕМІ МІЖКЛІТИННОЇ ІНТЕГРАЦІЇ ФУНКЦІЙ ОРГАНІЗМУ
ГЛАВА 24. ГОРМОНАЛЬНА РЕГУЛЯЦІЯ МЕТАБОЛІЗМУ ТА БІОЛОГІЧНИХ ФУНКЦІЙ КЛІТИНИ. II. ГОРМОНИ - ПОХІДНІ ПЕПТИДІВ ТА АМІНОКИСЛОТ
24.2. ГОРМОНИ ПІДШЛУНКОВОЇ ЗАЛОЗИ ТА ШЛУНКОВО-КИШКОВОГО ТРАКТУ
А. Гормони підшлункової залози
Підшлункова залоза — орган мішаної секреції, ацинарна частина якої виконує екзокринну функцію, секретуючи в дванадцятипалу кишку травні ферменти та іони, а ендокринна (острівці Лангерганса) — продукує декілька гормональних факторів пептидної природи. Синтез та секреція пептидних гормонів забезпечують різні типи клітин острівкого апарату:
A (α)-клітини — глюкагон;
B (β)-клітини — інсулін;
D (δ)-клітини — соматостатин;
F-клітини — панкреатичний поліпептид.
1. Інсулін — поліпептидний гормон (м.м. 5,7 кД), молекула якого складається з двох ланцюгів — А та В, що мають, відповідно, 21 та 30 амінокислотних залишків. Пептидні ланцюги сполучені між собою дисульфідними зв’язками, що з’єднують залишок А7 із залишком В7 та залишок А20 із залишком В19; крім того, третій дисульфідний місток зв’язує між собою залишки 6 та 11 А-ланцюга.

Інсулін був першим білком, для якого була встановлена повна амінокислотна послідовність (Ф. Сенгер, 1955). Враховуючи важливе медико-біологічне значення гормону для лікування цукрового діабету, інсулін був також першим білком, отриманим для фармацевтичних цілей g біотехнологічним методом з використанням рекомбінантних ДНК.

Рис. 24.1. Сенгер (Sanger) Фредерік (народ. 1918 р.), видатний англійський біохімік. Професор Кембріджського ун-ту. Винайшов метод визначення первинної структури білків, розшифрував первинну структуру інсуліну. Двічі лауреат Нобелівської премії (1958, 1980).
Вивчення третинної структури інсуліну дозволило сформувати уявлення про будову його активного центру, який визначає взаємодію білка з мембранним рецептором та реалізацію гормональної активності (рис. 24.2).
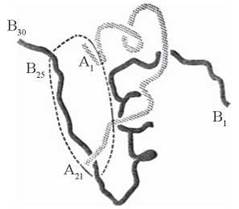
Рис. 24.2. Просторове розміщення А- та В-ланцюгів у молекулі інсуліну. Пунктиром позначений домен, що взаємодіє з рецептором.
Біосинтез та секреція інсуліну
Інсулін синтезується в рибосомах В- (β-) клітин підшлункової залози у вигляді препрогормону — білка з м.м. 11,5 кД, який у результаті обмеженого протеолізу послідовно перетворюється в ендоплазматичному ретикулумі та апараті Гольджі на прогормон (м.м. 9 кД) та зрілий інсулін.
Молекули інсуліну спаковуються в секреторні гранули, де вони утворюють комплекси з іонами цинку. Секреція інсуліну з клітини відбувається шляхом еміоцитозу, який полягає в міграції гранул до плазматичної мембрани, злитті гранул з мембраною, розчиненні мембрани та «екструзії» — викиду вмісту мембрани в екстрацелюлярний простір. Секреція інсуліну є енергозалежним процесом, головним фізіологічним стимулом секреції є збільшення концентрації глюкози в крові понад рівень фізіологічної норми (3,3-5,5 ммоль/л).
Характеристика гормональної активності
Інсулін позначають як «гормон засвоєння та депонування вуглеводів» (В.Б. Розен, 1984). Відповідно, цукровий діабет (хвороба, що пов’язана з порушеннями в синтезі, секреції інсуліну та/або реактивності інсулінових рецепторів — глава 12) характеризується стійкою гіперглюкоземією, порушеннями вуглеводного обміну та метаболічно зв’язаних з обміном глюкози перетворень ліпідів і амінокислот. Ця гормональна дія інсуліну зумовлена такими біохімічними механізмами:
(1) Вплив на обмін вуглеводів:
(1.1.) стимуляцією транспорту глюкози з екстрацелюлярного простору через плазматичні мембрани всередину клітин — ефект спостерігається здебільшого в клітинах м’язів, адипоцитах жирової тканини, лімфоцитах і є основною причиною швидкого (протягом декількох секунд) зниження рівня глюкоземіїтсля ін’єкції інсуліну. Разом з тим, інсулін не впливає на мембранний транспорт глюкози в гепатоцитах, клітинах головного мозку, нирок; стимуляція поглинання глюкози цими тканинами при дії інсуліну спричиняється активацією гормоном швидкості внутрішньоклітинної утилізації глюкози (див. нижче);
(1.2.) сприянням утилізації глюкози в м’язах, печінці, жировій тканині тощо шляхами гліколізу, пентозофосфатного шляху (ПФШ) та синтезу глікогену:
(1.2.1.) стимуляція гліколізу в гепатоцитах відбувається за рахунок активації інсуліном синтезу (індукції) глюкокінази — ферменту, що перетворює глюкозу на глюкозо-6-фосфат, а також фосфофруктокінази та піруваткінази;
(1.2.2.) стимуляція ПФШ обміну глюкози відбувається за рахунок активації глюкозо-6-фосфат-дегідрогеназної реакції (цей ефект інсуліну особливо важливий для жирової тканини та печінки, оскільки створює метаболічні умови, сприятливі для ліпогенезу);
(1.2.3.) інсулінзалежна стимуляція глікогенезу зумовлюється такими ферментативними механізмами:
(а) збільшенням глюкокіназної активності, що призводить до додаткового утворення глюкозо-6-фосфату, який може перетворюватися на глюкозо-1-фосфат — безпосередній субстрат глікогенезу;
(б) активацією глікогенсинтази: інсулін сприяє переходу ферменту в дефосфорильовану — активну форму (ефект зумовлений зниженням під впливом інсуліну рівня цАМФ внаслідок активації фосфодіестерази циклонуклеотидів і, відповідно, зменшенням активності протеїнкінази, що фосфорилює глікогенсинтазу);
(в) зменшенням активності глікогенфосфорилази (що також зумовлено падінням концентрації цАМФ і активності відповідної протеїнкінази); сукупність цих (б, в) метаболічних ефектів інсуліну спрямована на запасання глікогену в тканинах (анаболічна дія гормону);
(1.3.) гальмуванням процесів глюконеогенезу в печінці;
інсулін призводить до інгібірування синтезу глюконеогенних ферментів ФЕП-кінази, Фр-1,6-дифосфатази, Г-6-Ф-ази — цей процес є більш повільним (порівняно з впливом інсуліну на транспорт глюкози, гліколіз та глікогенез) і вимагає для свого прояву декількох годин.
(2) Вплив на обмін ліпідів.
Характеризується стимуляцією анаболічних шляхів ліпідного обміну і збільшеним депонуванням нейтральних жирів в клітинах, що проявляється здебільшого в жировій тканині та в печінці. Ліпогенні ефекти інсуліну зумовлені такими біохімічними механізмами:
(2.1.) активацією синтезу вищих жирних кислот за рахунок збільшення притоку відповідних субстратів: ацетил-КоА та НАДФН, що утворюються при метаболізмі глюкози (див. вище);
(2.2.) активацією синтезу триацилгліцеролів із жирних кислот та гліцерол-3- фосфату, який також постачається у збільшеній кількості при гліколітичному розщепленні глюкози (утворюється з діоксіацетонфосфату в гліцерол-3-фосфатдегідрогеназній реакції);
(2.3.) гальмуванням ліполізу в адипоцитах, що зумовлено зменшенням концентрації цАМФ, необхідного для активації ТГ-ліпази та протидією ліполітичному впливу катехоламінів та глюкагону.
Згідно із зазначеним, цукровий діабет характеризується активацією ТГ-ліпази жирової тканини із збільшеним надходженням НЕЖК у плазму крові, стимуляцією їх перетворення в кетонові тіла (кетогенезом) та виникненням при некомпенсованій течії захворювання кетоацидозу. Крім того, оскільки інсулін зменшує утворення в печінці основних транспортерів триацилгліцеролів та холестерину — ЛПДНЩ та ЛПНЩ — »атерогенних ліпопротеїнів», цукровий діабет II типу (глава 16) характеризується додатковим розвитком атеросклерозу та ожиріння.
(3) Вплив на обмін амінокислот та білків.
Дія інсуліну на амінокислотний та білковий обмін найбільш виражена в м’язах, печінці, нирках, сполучній тканині, має анаболічний характер і характеризується:
(3.1.) стимуляцією транспорту нейтральних амінокислот через плазматичні мембрани (ефект, найбільш виражений у м’язах);
(3.2.) активацією процесів рибосомальної трансляції, синтезу рРНК та деяких мРНК (у м’язах, печінці, нирках, сполучній тканині).
(4) Вплив на процеси клітинного росту та проліферації.
Інсулін має виражені ростостимулюючі ефекти, що пов’язані як із стимуляцією надходження в клітини енергетичних та пластичних субстратів для росту (глюкози, жирних кислот, амінокислот), так і з безпосереднім активуючим впливом на біосинтез (реплікацію) ДНК, прискоренням переходу клітин у S-фазу. Інсулін здійснює позитивний вплив на проліферацію тваринних клітин у культурі, подібний до дії пептидних факторів росту — фактора росту епідермісу (ФРЕ), фактора росту фібробластів (ФРФ), тромбоцитарного фактора росту (ТФР), біологічні ефекти яких також підсилюються інсуліном.
Молекулярні механізми дії інсуліну
Незважаючи на численні багаторічні дослідження кращих наукових центрів світу, молекулярні основи біохімічних та фізіологічних ефектів інсуліну, зокрема механізми трансформації його рецептор-лігандної взаємодії в специфічні реакції ефекторних систем клітини, залишаються не повністю розшифрованими.
Рецепторні тирозин-кінази
Рецептори для інсуліну, що локалізовані в мембранах гормоночутливих клітин, суттєво відрізняються від розглянутих вище рецепторів для білково-пептидних гормонів як за структурною організацією, так і за механізмами трансдукції гормонального сигналу. Ці інсулінові рецептори мають спільні принципи біохімічної організації та функціонування з рецепторами пептидних факторів росту (ФРE, ФРФ, ТФР) і отримали назву рецепторних тирозин-кіназ. Клас рецепторів, що розглядається, поєднує в собі функції як власнерецептора (тобто молекулярної структури, що специфічно сполучається з біорегулятором), так і трансдуктора, а також ферменту, тобто ініціаторного компонента ефекторної системи, яка реалізує біологічну реакцію клітини на дію гормону.
Характеристика будови та механізмів функціонування рецепторних тирозин-кіназ:
1) рецептори — інтегральні білки, що пронизують плазматичні мембрани; вони складаються із зовнішнього (екстрацелюлярного) домену, який послуговує для взаємодії з лігандом (гормоном, фактором росту), внутрішньомембранної частини та цитозольного компонента, що виконує каталітичні функції тирозин-кінази (рис. 24.3);
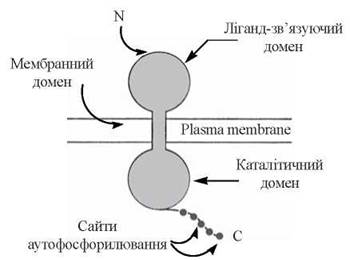
Рис. 24.3. Модель трансмембранної організації рецепторної тирозин-кінази.
2) за своєю молекулярною організацією рецептори інсуліну є гетеродимерами, що складаються із субодиниць двох типів, сполучених дисульфідними містками з утворенням олігомерів α2β2; обидві субодиниці глікозильовані. α-Субодиниця (м.м. 135 кД) розташована ззовні клітини і містить інсулін-зв’язуючі ділянки; β-субодиниця (м.м. 95 кД) — трансмембранний білок, цитозольний домен якого має тирозин-кіназну активність (рис. 24.4);
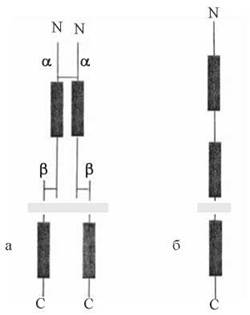
Рис. 24.4. Схема молекулярної організації рецепторів (рецепторних тирозин-кіназ) для інсуліну (а) та епідермального фактора росту (б).
3) зв’язування ліганда-біорегулятора з екстрацелюлярним доменом призводить до активації протеїнкіназної активності цитозольного домену рецепторної тирозин-кінази, який починає фосфорилювати власні тирозинові залишки (R-OH), розташовані близько С-кінця молекули (процес аутофосфорилювання):
![]()
В свою чергу, аутофосфорильовані сайти взаємодіють з певними ферментними білками-мішенями (Е-ОН) і здійснюють їх фосфорилювання (та модифікацію каталітичної активності), тобто подальше передавання хімічного регуляторного сигналу:
![]()
Важливим ферментом, що фосфорилюється в такому процесі, є фосфоліпаза С — ключовий фермент стимуляції фосфоінозитидного циклу, що спричиняє активацію протеїнкінази С та мобілізацію іонів інтрацелюлярного Са2+. Проте, розглянута послідовність реакцій є остаточно встановленою лише для пептидних факторів росту (зокрема ФРЕ), а питання про вторинні месенджери для інсуліну і подальшу послідовність ферментатвних реакцій, що реалізують множинні клітинні ефекти цього гормону, остаточно не з’ясовано.
Фактори росту та онкобілки
Значний біомедичний інтерес становить та обставина, що тирозин-кіназну активність мають деякі онкобілки — продукти експресії в клітинах ссавців онкогенів. Так, зокрема, тирозин-кіназами є онкобілки — продукти генів src, erbB, abI тощо, що спричиняють розвиток різних видів злоякісних пухлин.
Більше того, певні онкобілки близькі за будовою (мають гомологічні амінокислотні послідовності) з тирозин-кіназними рецепторами біорегуляторів: онкоген erbB (що спричиняє еритробластоз у птахів) кодує онкобілок, який має властивості рецептора ЕФР, онкоген sis (спричиняє саркому у мавп) структурно подібний до ТФР тощо. За цими даними можна припустити, що онкогени геному людини (і відповідні онкобілки) також можуть утворюватися в результаті мутацій генів, які відповідають за експресію білкових (тирозин-кіназних) рецепторів для біорегуляторів (в тому числі інсуліну), що контролюють ріст і проліферацію нормальних клітин (Ю.І. Губський, 1999).
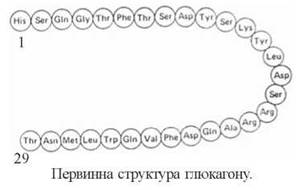
2. Глюкагон — одноланцюговий поліпептид (м.м. 3,5 кД), що складається з 29 амінокислотних залишків. Основним місцем синтезу гормону є A (α)-клітини острівкової частини підшлункової залози, проте значна кількість глюкагону може утворюватися і в інших клітинних елементах дифузної ендокринної системи шлунково-кишкового тракту. Глюкагон синтезується у вигляді
прогормону (проглюкагону), який перетворюється на молекули зрілого глюкагону.
Біологічні функції глюкагону полягають у регуляції вуглеводного та ліпідного обміну; за спрямованістю своєї метаболічної дії глюкагон є контрінсулярним гормоном, тобто його ефекти на обмін вуглеводів та жирів здебільшого протилежні ефектам інсуліну. Основною мішенню гормональної дії глюкагону є гепатоцити печінки.
(1) Вплив глюкагону на обмін вуглеводів характеризується:
а) стимуляцією глікогенолізу (без впливу на відповідний процес у м’язах) за рахунок активації глікоген-фосфорилази; молекулярний механізм дії гормону полягає в активації мембранної аденілатциклази з подальшим включенням цАМФ-залежного фосфоролітичного каскаду (глава 13);
б) гальмуванням глікогенезу шляхом інгібірування активності глікогенсинтази за рахунок її цАМФ-залежного фосфорилювання;
в) стимуляцією синтезу глюкози з амінокислот; активуючи синтез ферменту ФЕП-кінази (через підвищення швидкості транскрипції гена ФЕП-кінази), глюкагон виступає як найбільш потужний активатор глюконеогенезу в печінці.
Сума зазначених ефектів (а, б, в) проявляється гіперглюкоземічною дією глюкагону.
(2) Вплив глюкагону на обмін ліпідів характеризується ліполітичною дією глюкагону. За рахунок збільшення концентрації цАМФ в адипоцитах глюкагон активує ТГ-ліпазу жирової тканини, що супроводжується виходом НЕЖК в плазму крові; вільні жирні кислоти виступають як енергетичні субстрати в ході β-окислення та частково перетворюються на кетонові тіла. За умов інсулінової недостатності глюкагон-залежне утворення ацетоацетату робить суттєвий внесок в розвиток кетонемії, що спостерігається при цукровому діабеті.
Б. Гормони шлунково-кишкового тракту
Клітинна організація шлунково-кишкового тракту характеризується наявністю дифузної ендокринної системи, що нараховує до 16 типів гормонопродукуючих клітин. На даний час виділено та охарактеризовано більше 20 біорегуляторних пептидів, які синтезуються цими клітинами.
За хімічною будовою гастроінтестинальні гормони (ентерогормони) є коротко- ланцюговими пептидами та поліпептидами, що складаються з декількох або декількох десятків амінокислотних залишків. Більшість сполук гормональної та медіаторної дії, які належать до гастроінтестинальних пептидів, синтезуються також у центральній нервовій системі, гіпоталамусі, інших залозах внутрішньої секреції.
Біохімічно ідентифікованими гормонами шлунково-кишкового тракту є: гастрин, холецистокінін, секретин, шлунковий інгібіторний пептид, вазоактивний інтестинальний пептид, мотилін, соматостатин, панкреатичний поліпептид, ентероглюкагон, енкефаліни, сполука Р, бомбезин (гастрин-рилізинг-пептид).
Гастрин — ентерогормон, що синтезується G-клітинами антральної частини шлунка, а також клітинами слизової оболонки дванадцятипалої кишки.
Властивості гастрину притаманні декільком сполукам, що мають однакові чотирнадцять С-кінцевих амінокислот, але розрізняються довжиною поліпептидного ланцюга (містять 14; 17 або 34 амінокислотні залишки). Кожна з молекулярних форм гастрину може існувати в сульфатованому або несульфатованому вигляді.
Фізіологічно найбільш активним є пептид антральних G-клітин — гастрин 17; цей гормон стимулює функціональну активність обкладинних та головних клітин слизової оболонки шлунка, виступаючи головним стимулятором секреції шлунком соляної кислоти та пепсину.
Гормонально активні пухлини шлунка — гастриноми призводять до аномально збільшеної секреції соляної кислоти та супроводжуються виникненням виразок шлунка, що є резистентними до звичайної антацидної фармакотерапії.
Холецистокінін — гормон, що продукується І-клітинами слизової оболонки дванадцятипалої кишки та проксимального відділу порожньої кишки.
Холецистокінін є сполукою з надзвичайною молекулярною гетерогенністю: властивості холецистокініну мають, принаймні, п’ять пептидів, що складаються з 4, 8, 12, 33 та 39 амінокислотних залишків!
Фізіологічна активність цього ентерогормону полягає в стимуляції скорочень жовчного міхура та секреції панкреатичних ферментів; секреція холецистокініну стимулюється при надходженні в кишечник пептидів, амінокислот, довголанцюгових жирних кислот, кальцію, кислих еквівалентів. Найбільш активним є холецистокінін 8; цей пептид виявлений також у головному мозку, його унікальна центральна дія полягає в розвитку почуття ситості.
Секретин — гормон, який секретується S-клітинами дванадцятипалої кишки та проксимального відділу порожньої кишки. Є пептидом, що складається з 27 амінокислотних залишків.
Секретин стимулює секрецію бікарбонату та води підшлунковою залозою у відповідь на надходження в кишечник кислих продуктів шлунка.