СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
09. УГЛЕВОДЫ: КЛАССИФИКАЦИЯ И СТРОЕНИЕ
К углеводам относят полигидроксикарбонильные соединения и их производные. Другое распространенное название этого класса органических веществ - сахара.
❖ Классификация углеводов. Углеводы делят на три большие группы:
♦ моносахариды - простейшие полигидроксикарбонильные соединения, обычно не подвергающиеся гидролизу;
♦ полисахариды - природные полимеры, состоящие из моносахаридных остатков, соединенных гликозидной связью, способные гидролизоваться до моносахаридов, например, целлюлоза;
♦ олигосахариды - промежуточный класс углеводов, содержащих от 2 до 10 моносахаридных остатков, например, сахароза.
❖ Классификация моносахаридов. Моносахариды в свою очередь подразделяются:
✵ По типу карбонильной группы:
♦ альдозы - в состав входит альдегидная группа, например, глюкоза;
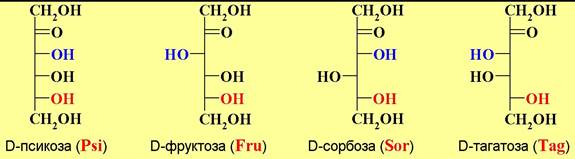
♦ кетозы - в состав входит кетогруппа, например, фруктоза.
✵ По числу углеродных атомов:
♦ триозы - 3 атома углерода (см. далее D-ряд альдоз);
♦ тетрозы - 4 атома углерода (см. далее D-ряд альдоз);
♦ пентозы - 5 атомов углерода (см. далее D-ряд альдоз);
♦ гексозы - 6 атомов углерода (см. далее D-ряд альдоз);
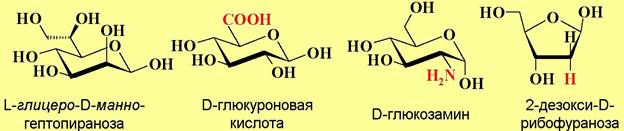
♦ высшие сахара - больше 6 атомов углерода, например, L-глицеро-D- манно-гептопираноза.
✵ По функциональным группам:
♦ нейтральные - только гидроксильные и карбонильные функции;
♦ кислые - присутствует карбоксильная функция, например, D- глюкуроновая кислота;
♦ аминосахара - присутствует аминогруппа, например, D-глюкозамин;
♦ дезоксисахара - вместо гидроксильной группы находится атом водорода, например, 2-дезокси-D-рибофураноза.
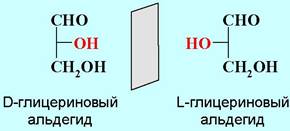
❖ Строение моносахаридов. Даже простейший моносахарид - глицериновый альдегид, имеет асимметрический центр и, соответственно, может находиться в виде пары энантиомеров. Правовращающий изомер был принят в качестве стандарта в DL-номенклатуре, разработанной одним из основоположников химии углеводов и биоорганической химии Нобелевским лауреатом (1902 г.) Э. Фишером.

От триозы синтетически можно перейти к тетрозам. В основе этого синтеза лежит присоединение синильной кислоты по альдегидной группе с последующим восстановлением α-гидроксинитрилов, например, амальгамой натрия. При этом наряду с увеличением углеродной цепи на один атом углерода возникает новый асимметрический центр и, следовательно, образуется пара диастереомеров.
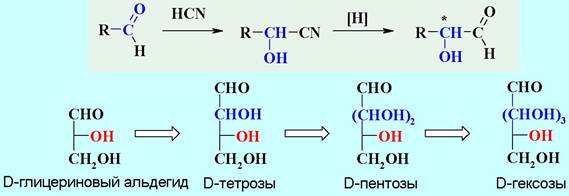
Этот метод позволяет из одного моносахарида получить два моносахарида с большей на один углеродный атом цепью. Эти углеводы являются эпимерами - моносахаридами, отличающимися конфигурацией верхнего тетраэдра. Пару эпимеров разделяют обычно кристаллизацией их производных. Переход от D-триозы к D-тетрозам и т. д. образует ряд D-альдоз. У всех этих моносахаридов одинаковая конфигурация нижнего асимметрического центра.
У тетроз имеется два асимметрических атома углерода и, согласно формуле: N = 2n, где n - число асимметрических центров, для них возможно существование 4 стереоизомеров - 2 диастереомеров и 2 их зеркальных форм. У пентоз таких изомеров 8, а у гексоз, соответственно, 16.
Аналогично на основе L-глицеринового альдегида строится и L-ряд альдоз.
Таблица 6. Ряд D-альдоз.
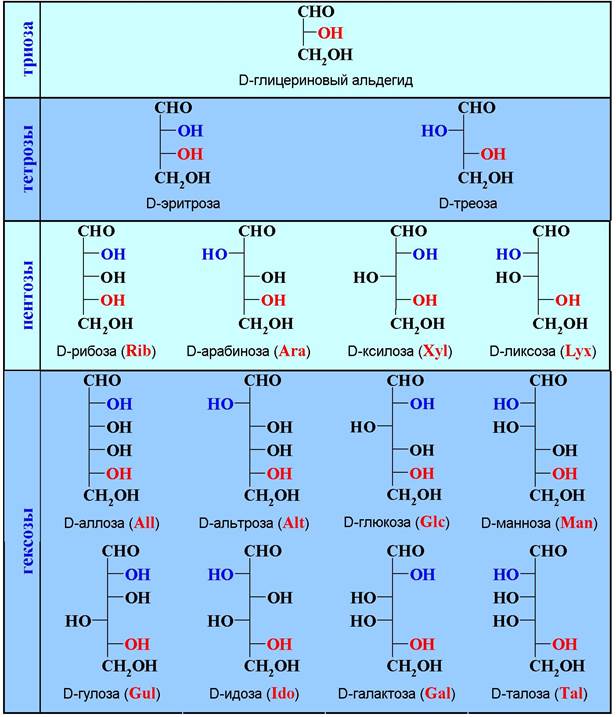
Для обозначения взаимного расположения гидроксильных групп диастереоизомеров (конфигурации) используются тривиальные основы. Таким образом, название альдоз состоит из обозначения конфигурации нижнего тетраэдра (D или L), тривиальной основы и окончания -оза.
У кетоз меньше асимметрических атомов углерода и поэтому 2- кетогексозы представлены 4 диастереомерами D-ряда.
❖ Циклические формы моносахаридов. Известно, что альдегиды и кетоны способны реагировать со спиртами, образуя полуацетали. Моносахариды имеют в своем составе, как карбонильную группу, так и гидроксильные функции, поэтому возможны внутримолекулярные реакции образования циклических ацеталей.
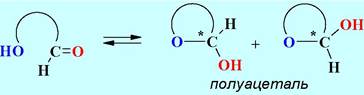
При циклизации возможно получение двух типов циклических форм: пятичленных - фураноз и шестичленных - пираноз. Образование циклических полуацеталей сопровождается возникновением еще одного асимметрического центра и, следовательно, реализуется возможность образования двух диастереомерных форм.
Полуацетальный атом углерода (на рисунках обозначен *) называют аномерным или гликозидным, а, соответственно, эти два диастереомера - аномерами. Аномер обозначается как α, если в проекции Фишера конфигурация атома углерода с аномерным гидроксилом совпадает с конфигурацией нижнего асимметрического центра, а при несовпадении - β.
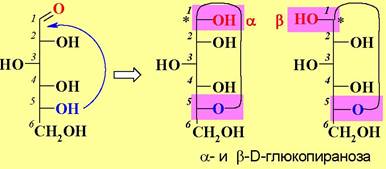
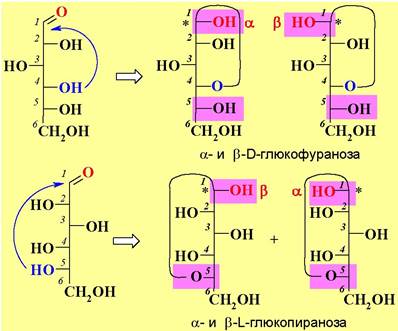
❖ Проекции Хеуорса. Так как проекция Фишера плохо соответствует пространственной циклической форме моносахаридов, то была предложена проекция Хеуорса. Цикл в этой проекции располагается перпендикулярно плоскости бумаги, а связи Н-С-ОН - параллельно. Часто с целью упрощения структуры связи С-Н не изображают.

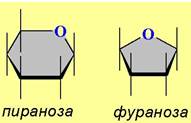
Данная проекция была предложена английским химиком У. Хеуорсом, который за цикл исследований по химии углеводов, а также витамина С, в 1937 г. был удостоен Нобелевской премии по химии.
Для перехода из проекции Фишера в проекцию Хеуорса необходимо выполнить следующие операции в соответствии с правилами работы с проекцией Фишера:
1. Осуществить две перестановки с целью вертикального расположения цикла.
2. Повернуть всю проекцию на 90° (уронить на бок).
3. Перенести функции на проекцию Хеуорса.
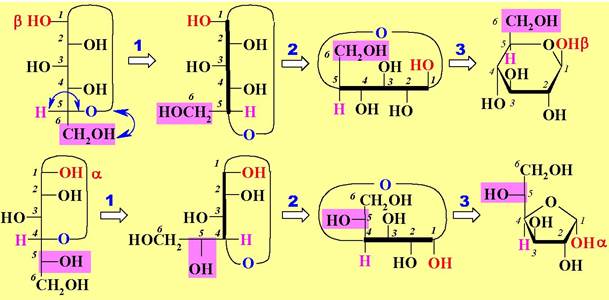
Иначе переход от проекции Фишера к проекции Хеуорса можно представить следующим образом. Заместители, находящиеся в проекции Фишера слева, располагаются в проекции Хеуорса над плоскостью цикла, а заместители, расположенные в проекции Фишера справа, размещаются в проекции Хеуорса под плоскостью цикла.
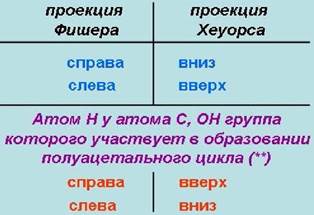
Исключение составляет водородный атом у атома углерода, гидроксильная группа которого участвует в образовании полуацетального цикла (на рисунках обозначен **), в этом случае реализуется обратное расположение.
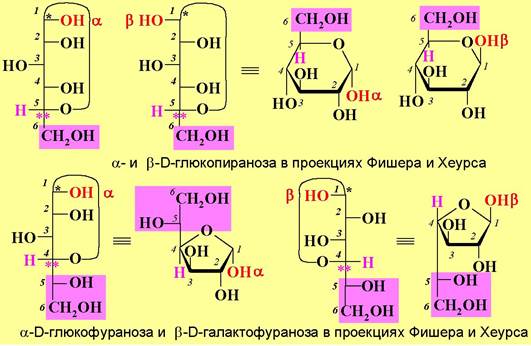
❖ Кольчато-цепная таутомерия. Если в кристаллах моносахариды находятся в циклической форме, то в растворах реализуется таутомерное равновесии между четырьмя циклическими и ациклической формой (кольчато-цепная таутомерия). Вклад линейной формы углеводов очень незначителен (доли процента), но, тем не менее, возможно протекание реакций по альдегидной группе.
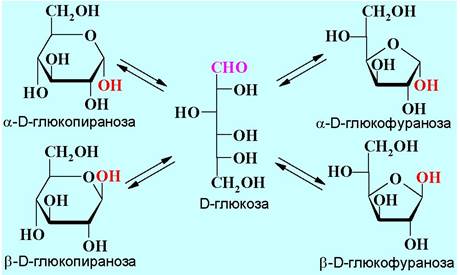
❖ Мутаротация. Кольчато-цепная таутомерия моносахаридов объясняет явление мутаротации - изменение для растворов моносахаридов в течение некоторого времени угла вращения плоскополяризованного света до постоянного значения. При растворении углевод, находящийся в одной из циклических форм, переходит в равновесную смесь пяти форм. Так, полученный перекристаллизацией D-глюкозы из воды, образец α-D-глюкопиранозы при растворении в воде имеет первоначальное удельное вращение [α]D+106°. Соответственно, водный раствор β-D-глюкопиранозы, кристаллизованной из пиридина, - [α]D +22,5°. При стоянии растворов удельное вращение меняется и в обоих случаях достигает постоянного значения [α]D +52,5°.
Таблица 7. Содержание циклических форм моносахаридов в водных растворах
Моносахарид |
Содержание (%) |
|||
α-Пираноза |
β-Пираноза |
α-Фураноза |
β-Фураноза |
|
D-Глюкоза |
~38 |
~62 |
0,1 |
<0,2 |
D-Манноза |
65,5 |
34,5 |
- |
- |
D-Галактоза |
29 |
64 |
3 |
4 |
D-Альтроза |
27 |
40 |
20 |
13 |
D-Рибоза |
21 |
59 |
6 |
14 |
D-Ксилоза |
36,5 |
63 |
~0,5 |
|
D-Фруктоза* |
2,5 |
65 |
6,5 |
25 |
* ~0,8% кето-формы
❖ Конформации моносахаридов. Проекция Хеуорса также полностью не отражает реального пространственного строения моносахаридов. Например, шестичленное кольцо пираноз не является плоским, а обычно находится в конформации «кресло». Различают две конформации «кресло», обозначаемые 1С4 и 4С1 (в первом случае 1-й атом углерода находится выше плоскости цикла, а 4-й атом - ниже плоскости; во втором - наоборот).
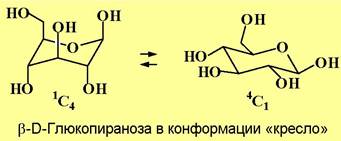
Для пятичленных циклов фураноз часто реализуется конформация «конверт».
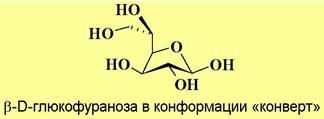
В нормальных условиях моносахариды могут находиться преимущественно, как в одной, так и другой конформации «кресло». Из курса органической химии известно, что более устойчива та конформация, в которой заместители, особенно объемные, находятся в экваториальных положениях. Например, β-D-глюкопираноза существует в конформации 4С1, в которой все заместители имеют экваториальную ориентацию. Наряду с этими факторами в углеводах существуют и другие специфические факторы, влияющих на устойчивость конформаций, рассмотрение которых не входит в рамки данного курса.