СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
14. БИОЛОГИЧЕСКИЕ ПРОЦЕССЫ, ПРОТЕКАЮЩИЕ С УЧАСТИЕМ НУКЛЕИНОВЫХ КИСЛОТ
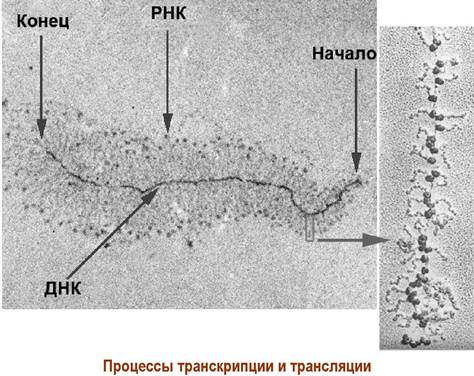
Нуклеиновые кислоты обеспечивают протекание важнейших биологических процессов в живой клетке, в т. ч. репликацию ДНК и биосинтез белка на основе информации, заложенной в ДНК (транскрипция и трансляция).
Репликация
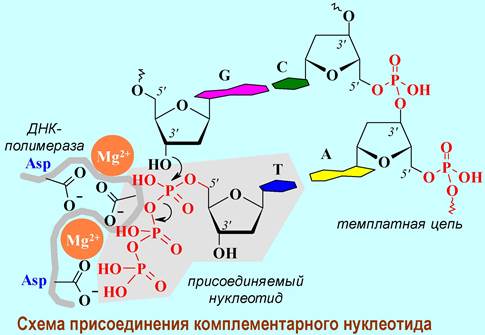
Репликация - процесс удвоения ДНК. Одновременно реализуется расплетение двойной спирали и достройка комплементарных цепей к каждой из них. Ключевую роль в процессе играет реплицирующие ДНК-полимеразы, которые из набора мононуклеозидтрифосфатов (pppdA, pppdG, pppdC, pppdT) осуществляют синтез полинуклеотида, используя исходную цепь ДНК в качестве матрицы.
Присоединение каждого нового нуклеотида определяется образованием прочных водородных связей с комплементарным участком матрицы, что обеспечивает высокую точность построения дублирующей цепи ДНК. В среднем при репликации наблюдается не более одной ошибки на 1 миллиард нуклеотидов.
Рассмотрим ключевые моменты процесса репликации хромосомы E. coli.
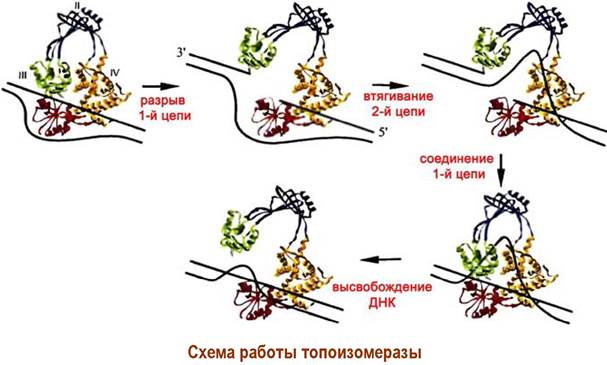
❖ Расплетение двойной спирали. Так как в качестве матриц выступают одноцепочечные ДНК, то предварительно должно произойти разъединение двойной спирали на отдельные цепи. Расплетение спирали должно было бы сопровождаться вращением цепей. Предотвращает это явление специальный фермент топоизомераза, состоящий из 4 субъединиц с общей молекулярной массой ~400 кДа.
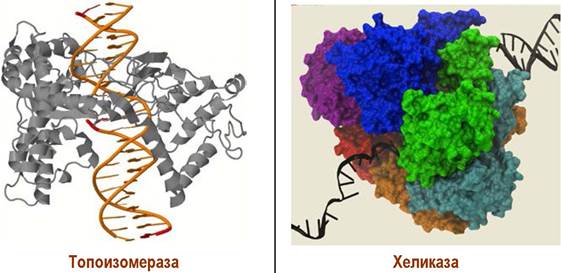
Топоизомераза состоит из 4 субъединиц с общей молекулярной массой ~400 кДа. Этот фермент вносит разрывы в одну цепь ДНК, затем втягивает вторую цепь и снова соединяет звенья нуклеиновой кислоты.
Фермент хеликаза (300 кДа, 6 идентичных субъединиц) осуществляет разрыв водородных связей между комплементарными парами нуклеотидов двойной спирали ДНК. Действующие совместно с ней ДНК-связывающие белки, также имеющие субъединичное строение - 4 идентичные белковые молекулы с общей молекулярной массой 75,6 кДа, удерживают молекулы нуклеиновой кислоты в разъединенном одноцепочечном состоянии. На разделение каждой пары оснований расходуется энергия гидролиза двух молекул АТР до ADP и фосфата.
❖ ДНК-полимеразы. Фактически ДНК-полимераза представляет собой мультиферментный комплекс. Наиболее крупный компонент этого комплекса называют ДНК-полимеразой III. Биосинтез ДНК обеспечивает димерный блок этого фермента, каждая его часть катализирует синтез одной новой цепи ДНК со скоростью до 1000 нуклеотидов в секунду. Фермент включает 10 типов субъединиц, и его общая молекулярная масса достигает 791,5 кДа. Составные части фермента:
♦ два кора, состоящих из трех субъединиц - α (129,9 кДа), ε (27,5 кДа), θ (8,6 кДа), и обеспечивающих 5’ —> 3’-полимеразную и 3’ —> 5’-экзонуклеазную активность;
♦ две Ƭ-субъединицы по 71,1 кДа, соединяющие два кора;
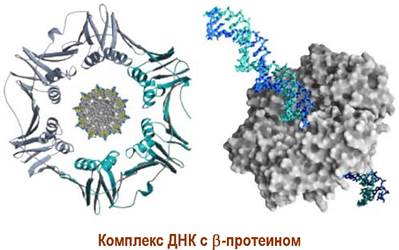
♦ два β-протеина, который состоят из двух симметричных белковых единиц по 40,6 кДа и обеспечивают захват цепи ДНК;
♦ y-комплекс в составе 5 субъединиц (y - 47,5 кДа, δ - 38,7 кДа, δ’ - 36,9 кДа, χ - 16,6 кДа, Ψ - 15,2 кДа), способствующий движению мультифермента по цепи ДНК.
✵ ДНК-полимераза I (молекулярная масса ~103 кДа) участвует в замене участков РНК-затравки на соответствующие фрагменты ДНК, т. е. она обладает как 5’ —> 3’-полимеразной, так и 5’ —> 3’-экзонуклеазной активностью.
Общая скорость процесса составляет до 20 нуклеотидов в сек.
❖ Матричный синтез.
✵ Лидирующая цепь. Процесс полимеризации начинается с 3'-конца и движется по направлению к 5'-концу. Для начала работы фермента необходимо наличие затравки (праймера), в качестве которого обычно выступает соответствующий участок РНК в 10-60 нуклеотидов. Синтезируется он с помощью фермента праймазы (белок массой ~60 кДа). Далее ДНК- полимеразный комплекс непрерывно наращивает вторую комплементарную цепь, называемую лидирующей цепью.
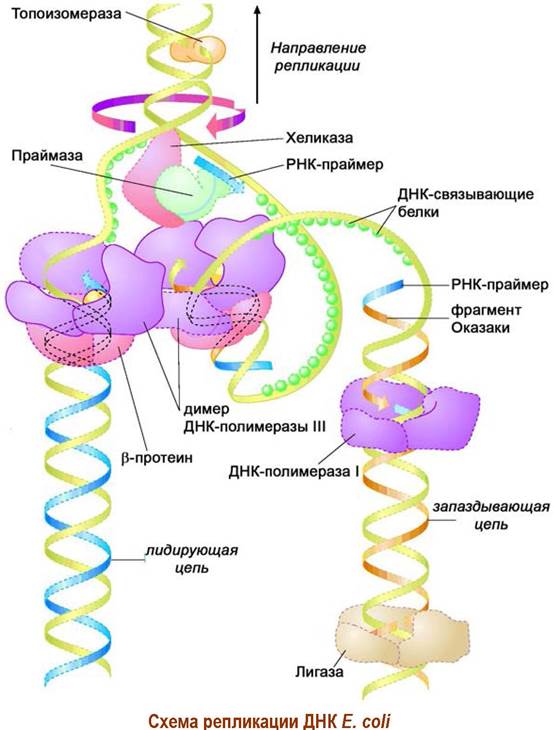
✵ Запаздывающая цепь. Другая двойная цепь синтезируется отдельными участками, содержащими по 1000-2000 п. о. Их называют фрагментами Оказаки по фамилии впервые описавших их японского биохимика Рэйдзи Оказаки и его жены Тсунэко Оказаки.
Чтобы обеспечить возможность работы второго блока ДНК-полимеразы III, которая синтезирует комплементарную цепь только в направлении от З'-конца к 5'-концу матрицы, вторая матричная цепь ДНК делает поворот на 180°.
Рядом с местом расплетения ДНК праймаза в комплексе со специфическими белками связывается с матричной цепью ДНК и формирует затравку. Затем ДНК-полимеразой III в направлении к 5’-концу строится комплементарная цепь ДНК. За это время процесс расплетения уходит вперед и снова присоединяется праймер, от него до предыдущего праймера растет цепь ДНК и т. д. Таким образом формируется цепь, состоящая попеременно из фрагментов РНК и ДНК.
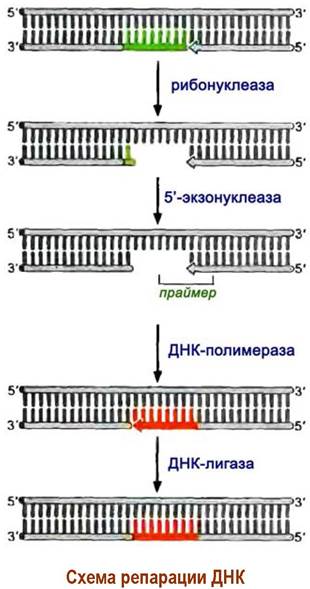
Для образования непрерывной цепи ДНК реализуется система репарации ДНК, заключающаяся в удалении РНК-затравки и замене ее на ДНК. У бактерий процесс удаления нуклеотидов РНК обеспечивается 5’ —> 3’-экзонуклеазной активностью ДНК-полимеразы I. При этом каждый отщепленный рибонуклеотид параллельно замещается соответствующим дезоксирибонуклеотидом. Двухцепочечный участок ДНК выполняет функцию праймера.
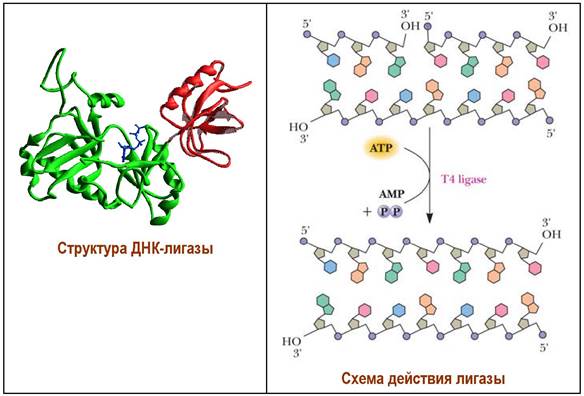
На завершающем этапе ферменты ДНК-лигазы (молекулярная масса 74 кДа) сшивают отдельные фрагменты полинуклеотида фосфодиэфирными связями. После репликации образовавшиеся цепи закручиваются обратно в спирали без энергетических затрат или действия каких-либо ферментов.
Транскрипция
Транскрипция - процесс биосинтеза РНК, комплементарной участку ДНК. Генетическая информация, хранимая в ДНК, не используется непосредственно для биосинтеза белка. С участков цепи ДНК снимается копийная РНК - матричная или информационная РНК.
Ключевую роль в процессе транскрипции играет фермент ДНК- зависимая РНК-полимераза (транскриптаза). Этот фермент был открыт в 1960 г. американскими учеными Сэмом Вейссом, Одри Стивенсом, Джеймсом Боннером и Джерардом Гурвицем.

Первый ферментативный синтез РНК был проведен испаноамериканским биохимиком С. Очоа. В 1959 г. он совместно с американским ученым А. Корнбергом был удостоен Нобелевской премии по физиологии и медицине за цикл работ по транскрипции. В 2006 г. Нобелевскую премию по химии «за получение точных изображений молекул РНК-полимеразы в различные моменты процесса транскрипции» получил сын Артура Корнберга - Роджер.
В случае E. coli транскриптаза представляет собой комплекс 5 типов субъединиц (2α, β, β’, ω и σ) с общей молекулярной массой 450 кДа.
Кор-фрагмент этого фермента имеет постоянную структуру - α2, β, β’, ω. Для E. coli найдено несколько σ-субъединиц с молекулярными массами 70, 32 и 28 кДа. Первая участвует в транскрипции большинства генов, а остальные - в случае коротких или некоторых специальных генов.

Транскрипция состоит из стадий инициации - начальный этап, элонгации - наращивание цепи РНК, и терминации - прекращение матричного синтеза. В обеспечении процесса принимает участие большое количество (у E. coli более 100) специальных белков - факторов.
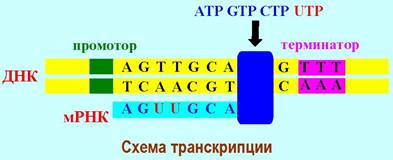
Инициация начинается с того, что комплекс кор-фермента и σ- субъединицы связывается со специальным стартовым участком ДНК - промотором, охватывая нуклеиновую кислоту. На небольшом участке происходит расплетение двойной спирали ДНК и синтезируется небольшой фрагмент (около 10 нуклеотидов) комплементарной РНК. Затем σ-субъединица отсоединяется и остается комплекс ДНК с кор-ферментом. На этом завершается этап инициации. Таким образом, основная роль σ-частицы заключается в узнавании промотора и обеспечении инициации процесса транскрипции.
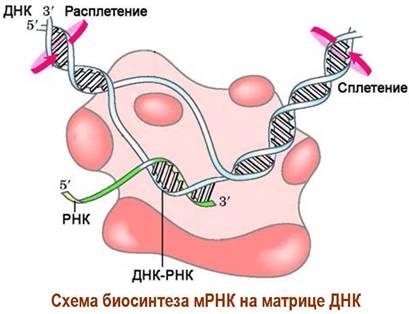
Далее, используя в качестве исходного материала набор мононуклеотид- трифосфатов (АТР, GTP, СТР, UTP) и в качестве матрицы одну из цепей ДНК, транскриптаза ведет матричный синтез комплементарной цепи. При этом вместо пары А-T синтезируется пара A-U. Процесс синтеза РНК протекает в направлении от 5’- к 3’-концу, то есть по матричной цепи ДНК РНК- полимераза движется в направлении 3’ —> 5’.
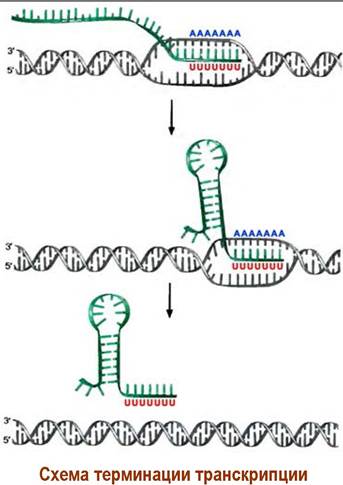
Прекращение процесса транскрипции (терминация) происходит при достижении РНК- полимеразы специального участка ДНК - терминатора, который, как один из вариантов, содержит подряд несколько остатков аденозина. Образующийся блок пар А-U слабо связан и происходит отделение синтезированной РНК от цепи ДНК. Альтернативно удалению РНК способствуют специальные факторы терминации.
❖ Процессинг. В случае прокариот получаемая после биосинтеза мРНК способна сразу участвовать в биосинтезе белка. В тоже время для получения рибосомальных РНК и тРНК из синтезированной РНК-предшественника (пре- РНК) требуется специальная процедура «доработки» - процессинг.
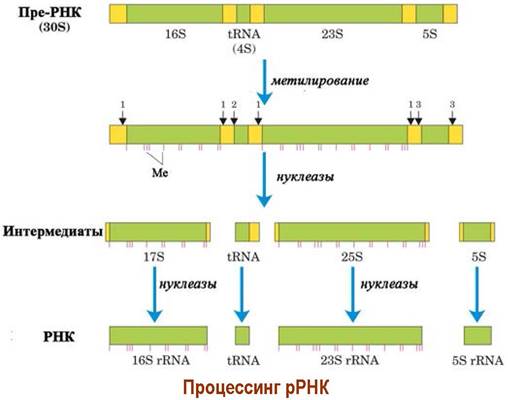
Он заключается в биохимическом метилировании ряда нуклеотидов и удалении отдельных фрагментов нуклеиновой кислоты рибонуклеазами. Так из одной 30S пре-РНК E. coli получаются 23S, 16S и 5S рРНК, а также несколько тРНК.
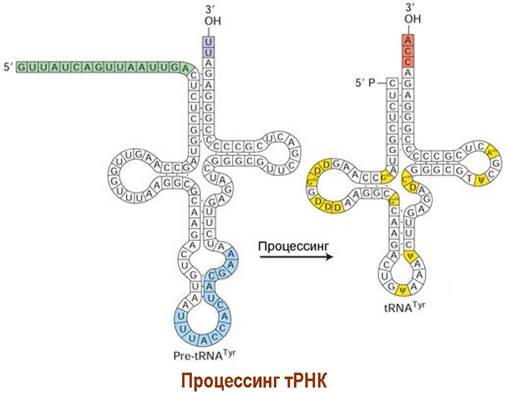
тРНК далее подвергаются воздействию рибонуклеаз, удаляющих ненужные нуклеотиды, и подвергаются специфической модификации - отдельные нуклеотиды дезаминируются, метилируются, восстанавливаются.
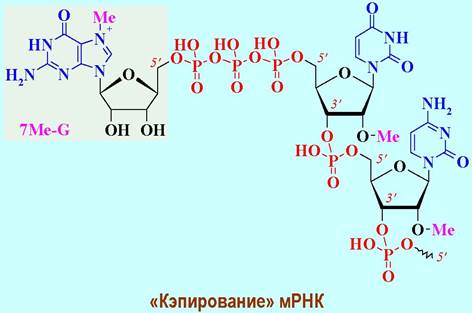
✵ Процессинг мРНК эукариот. В отличие от прокариот мРНК эукариот подвергаются процессингу. В частности, с целью защиты 5’-конца через трифосфатный мостик уникальной связью 5’ —> 5’ присоединяется 7- метилгуанозин (7Ме-G) и метилируются 2’-гидроксильные группы двух концевых нуклеотидов - так называемое «кэпирование».
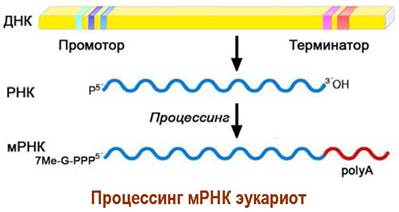
С 3’-концом мРНК конденсируется фрагмент полиаденозина с длиной от 100 до 250 остатков, что обеспечивает защиту от экзонуклеаз и облегчает взаимодействие с рибосомами. Общая длина мРНК может достигать нескольких тысяч нуклеотидов.
❖ Сплайсинг. Ген эукариот наряду с экзонами - участками, кодирующими синтез белков, содержат интроны - некодирующие фрагменты ДНК. Соответственно, в процессе транскрипции образуются пре-мРНК, содержащие экзоны и интроны. Перед трансляцией интроны должны быть удалены. Такая процедура называется сплайсингом - сращиванием концов.
С химической точки зрения происходит атака 2’-гидроксильной группы остатка аденозина в 3’- концевой части интрона по фосфатному мостику 5’-конца соединяемого фрагмента. Затем 3’- гидроксильная группа первого экзона связывается с 5’-фосфатной группой второго экзона, отделяя циклический интрон.
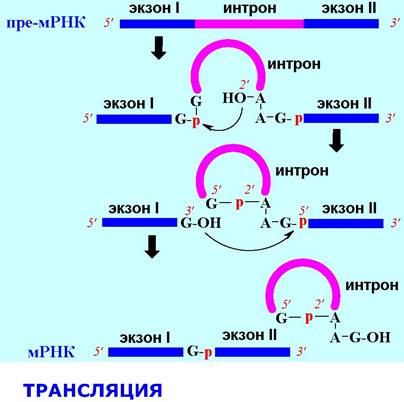
Трансляция - многоступенчатый процесс синтеза полипептидной цепи согласно информации, заключенной в последовательности нуклеотидов мРНК. Трансляция протекает в специальной внутриклеточной структуре - рибосоме, с участием белковых комплексов и аминоацил-тРНК (РНК, несущая аминокислоту, см. ниже). На всех этапах трансляции: инициации, элонгации и терминации, задействованы специфические белки-ферменты - факторы.
❖ Рибосома - клеточная органелла, осуществляющая биосинтез белка на основе генетической информации. Впервые они были описаны в 1950-х годах американским клеточным биологом румынского происхождения Дж. Паладе (Нобелевская премия 1974 г. по физиологии и медицине) как уплотненные частицы, или гранулы.

В 1958 г. Ричард Робертс предложил термин «рибосома» вместо ранее используемого «рибонуклеобелковая частица микросомальной фракции».
В 2009 г. Нобелевская премия по химии «за исследования структуры и функций рибосомы» была присуждена международной группе исследователей в составе Т. Стейца (США), А Йонат (Израиль) и В. Рамакришнана (Великобритания).

Для прокариот характерно наличие 70S рибосом (S - константа седиментации), а для эукариот - 80S рибосом. Например, в клетке E. coli содержится около 15 тыс. рибосом.
70S рибосома E. coli достигает в диаметре 18-20 нм. Ее молекулярная масса ~2,5 млн. Да. Она состоит из двух больших субъединиц: 50S (~1,6 млн. Да) и 30S (~0,9 млн. Да) соответственно. Каждая субъединица имеет сложное нуклеопротеидное строение. Около 60-65% массы рибосомы приходится на РНК и 35-40% - на белковые структуры.
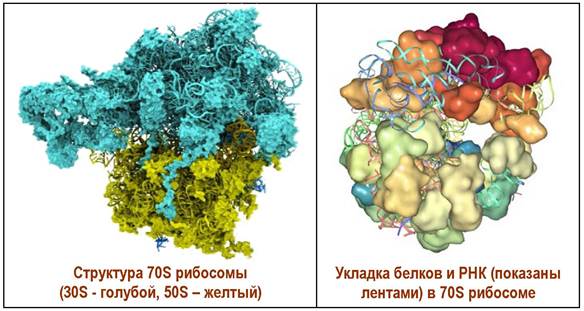
Малая субъединица состоит из 21 белка и 168 РНК, а большая, соответственно, из 31 белка и двух полинуклеотидов: 238 РНК и 58 РНК. Белковые молекулы содержат большое количество остатков основных аминокислот - лизина и аргинина, что способствует конденсации с остатками фосфорных кислот полинуклеотидов.
Большая и малая субъединицы способны как к объединению в рибосому, так и к разделению (см. далее). На этот процесс, в частности, влияет концентрация ионов магния. В целом малая субъединица отвечает за инициацию процесса трансляции, а большая, обладающая каталитической способностью образовывать пептидную связь, - за элонгацию.
80S рибосома эукариот имеет массу ~4,2 млн. Да и диаметр около 23 нм. Она состоит из 60S (~2,8 млн. Да) и 40S (~1,4 млн. Да) субъединиц. Первая в своем составе имеет три полинуклеотида (28S, 5,8S и 5S) и 49 белков. Меньшая включает 18S РНК и 33 белка. Синтез рибосом у эукариот осуществляется в ядрышке.
При значительной схожести в строении рибосом эукариот и прокариот они имеют и существенные различия, обеспечивающие преимущественное связывание некоторых лекарственных средств (например, антибиотиков) с 70S рибосомами, что и обеспечивает им избирательное антибактериальное действие.
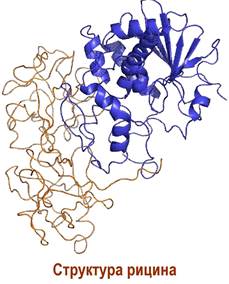
✵ Рицин. 80S рибосома является мишенью для ряда растительных ядов (фитотоксинов), например, рицина, выделяемого из клещевины. Семена этого растения содержат до 1 мг/г токсина, летальная доза которого для человека составляет 10 мкг/кг.
Этот токсин представляет собой гетеродимер, состоящий из цепи А (~32 кДа), обладающей N-гликозидазной активностью, и протеина В (~34 кДа), являющегося лектином. С помощью лектина, узнающего остатки галактозы и галактозамина, токсин способен закрепляться на поверхности клетки. Внутри клетки димер расщепляется, выделяя токсический компонент А. Гликозидаза рицина действует по аденозиновому остатку в 28S РНК 60S- субъединицы рибосомы, вследствие чего нарушается процесс трансляции.

Токсин такого же типа (вискумин) обнаружен в ядовитом паразитарном растении омеле.
❖ Генетический код. Основная часть матричной РНК представляет собой комплементарную копию определенного участка ДНК и, соответственно, несет информацию об аминокислотной последовательности синтезируемого белка. Иначе эти нуклеиновые кислоты называют информационными РНК. Тип аминокислоты кодирует не отдельный нуклеотид, а последовательность трех нуклеотидов (кодон). Из 64 возможных комбинаций кодонов 61 соответствуют основным аминокислотам (генетический код). Кроме того, существуют три, так называемых, «стоп»-кодона, служащие сигналом прекращения биосинтеза. Ряд аминокислот кодируется несколькими кодонами.
За установление принципов генетического кода в 1968 г. Нобелевскую премию по физиологии и медицине получили американские ученые М. Ниренберг, Х. Корана и Р. Холли.
В 1979 г. было выявлено отклонение от стандартного генетического кода, например, у митохондрий растительных клеток кодон CGG кодирует присоединение триптофана, а у дрожжей рода Candida кодон CUG отвечает за присоединение серина.

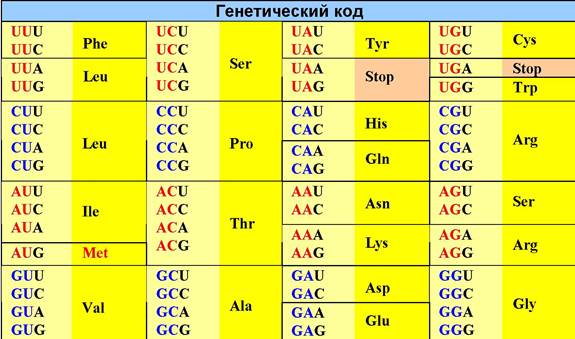
❖ Аминоацил-тРНК. Считывание информации с мРНК осуществляется тРНК, имеющую комплементарную последовательность нуклеотидов в антикодоновой петле (см. строение тРНК). Соответственно, для ряда аминокислот существует несколько тРНК.
Процесс присоединения аминокислоты к тРНК катализируется специфической для данной аминокислоты аминоацил-тРНК-синтетазой. Этот фермент обеспечивает протекание двух реакций: синтез аминоациладенилата и затем образование аминоацил-тРНК. Соответственно, он имеет два центра связывания - аминокислоты и тРНК.
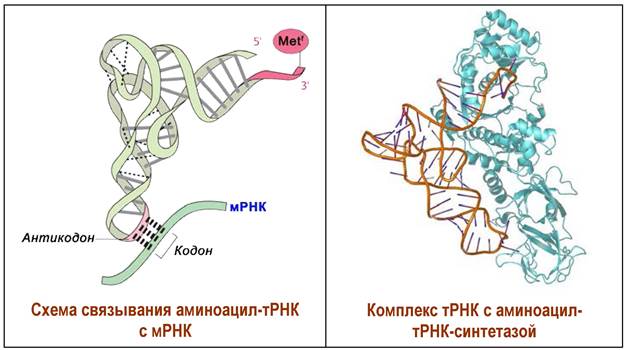
Вначале с помощью АТР происходит активация аминокислоты. Образовавшийся смешанный ангидрид фосфорной кислоты и аминокислоты обладает высокой реакционной способностью. Благодаря чему аминокислоты могут присоединяться к гидроксильным группам 3’-концевого остатка аденина тРНК, образуя аминоацил-тРНК.
❖ Трансляция в прокариотах.
✵ Инициация. Процессы трансляции прокариот и эукариот базируются на общих принципах, но существенно различаются в деталях. Рассмотрим более простую трансляцию в прокариотах.
В генетическом коде отсутствует стартовый кодон. В 5’-концевой области мРНК, с которой начинается биосинтез, рядом с инициирующим кодоном AUG находится особая группа нуклеотидов - последовательность Шайна- Дальгарно (например, AGGA или GGUUUGG). Свое название она получила от впервые описавших её австралийских учёных Джона Шайна и Линн Даль- гарно. На этой последовательности посредством комплементарного 3'- концевого участка своей 16S РНК закрепляется 30S субъединица рибосомы. Таким образом определяется начало трансляции.
В качестве инициирующего кодона практически у всех эукариот и у подавляющего количества прокариот выступает триплет AUG. У последних в ряде мРНК старт трансляции может начинаться с других кодонов, например, GUG или UUG, также находящихся в инициаторном участке мРНК.
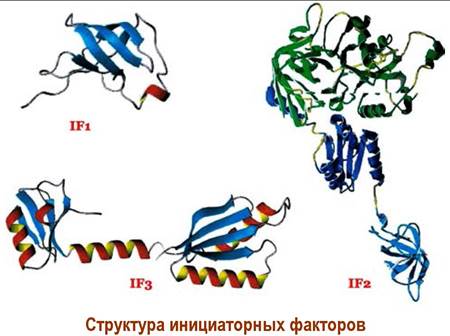
Малая рибосомная субъединица (30S) прокариот, до вовлечения в трансляцию, существует в комплексе с инициаторным фактором IF3, который предотвращает ее ассоциацию с 50S-субъединицей рибосомы. По этой причине данный белок называют «фактором диссоциации». У многих прокариот в комплекс входит также белок IF1, повышающий сродство малой субчастицы к IF2 и IF3.
Присоединение малой рибосомной субъединицы к мРНК может происходить двумя равно реализующимися путями. По первому - вначале происходит ассоциация блока «30S субъединица + IF3/IF1» с мРНК, а затем присоединяется инициирующая тРНК-Меtf в комплексе с инициаторным фактором IF2 и GTP.
По второму - вначале образуется комплекс «30S субъединица + IF3/IF1 + тРНК-Меtf + IF2(GТР)», который далее закрепляется на мРНК.
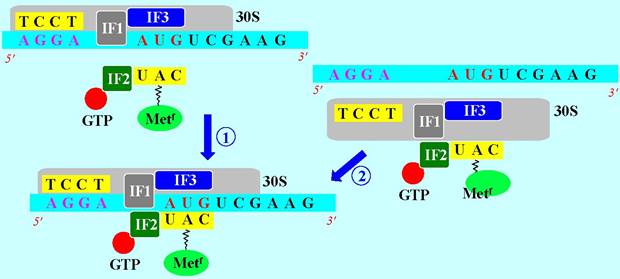
Инициирующая тРНК-Metf отличается от обычной тРНК-Met тем, что несет N-формилированную аминокислоту. Антикодоном этой тРНК является последовательность UAC, полностью комплементарная кодону AUG и частично комплементарная другим, рассмотренным выше, инициаторным кодонам прокариот - GUG и UUG.
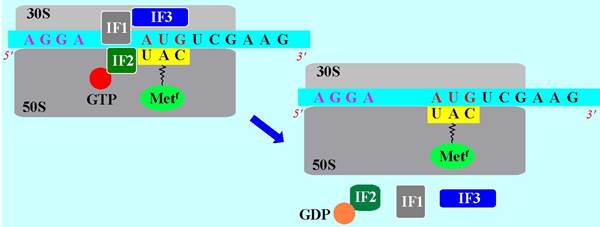
Далее к блоку «мРНК - 30S субъединица - тРНК-Меtf» присоединяется 50S субъединица, происходит изменение конформации белка IF2. Активируются его ферментативные свойства, и осуществляется гидролиз GTP до GDP. Инициаторный фактор IF2(GDP) теряет сродство к тРНК и покидает комплекс. Одновременно диссоциируют инициаторные факторы IF3 и IF1. 70S рибосомальный комплекс готов к работе.
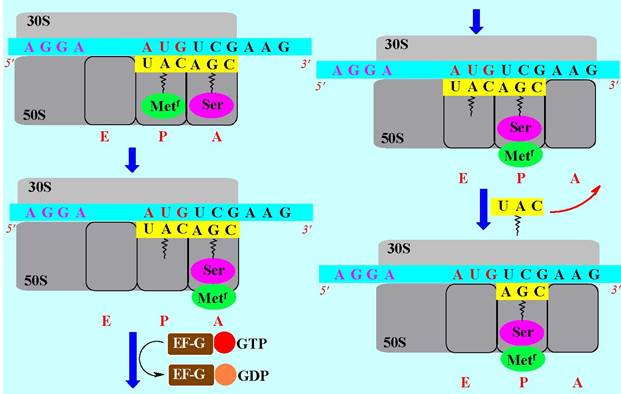
✵ Элонгация. 50S субъединица имеет два участка связывания тРНК: в P-участке (P - peptidyl) координируются тРНК с амидированными формами: N-формил-Met или содержащие пептидные цепи, а в A-участке (A - aminoacyl) - тРНК со свободными аминокислотами.
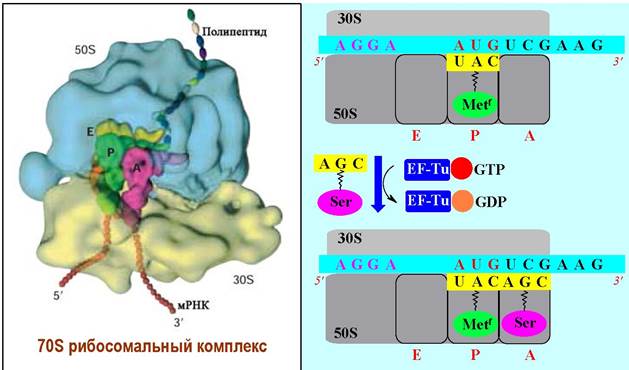
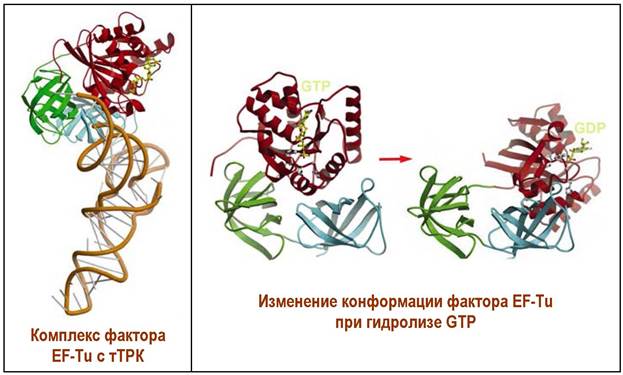
При формировании стартового комплекса тРНК-Metf располагается в Р- участке. тРНК. Комплементарная второму кодону мРНК доставляет соответствующую аминокислоту в А -участок и связывается с помощью GTP- содержащего фактора элонгации EF-Tu. Далее происходит гидролиз GTP до GDP, изменение конформации белка и уход этого фактора элонгации.
В реакции пептидного синтеза аминогруппа второй аминокислоты выступает в качестве нуклеофила. С помощью находящегося в большой субъединице участка структуры рибосомы, выполняющего роль фермента пептидилтрансферазы, происходит аминолиз сложноэфирной связи N-формил- метионина с нуклеотидом. В результате образуется дипептидил-тРНК и свободная тРНК.
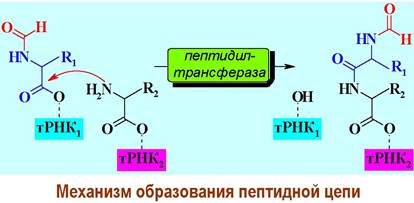
Дипептидил-тРНК смещается в P-участок, сдвигая за собой мРНК точно на тринуклеотид Дезаминоацилированная инициирующая тРНК переходит в P-участок (Е - exit, с англ. выход) и отделяется от рибосомы. Этот процесс называется транслокацией и происходит с помощью фактора EF-G.
В дальнейшем в соответствии с последовательностью кодонов в матричной РНК аминоацил-тРНК вновь координируются в А -участке и доставляют последующие аминокислоты, которые поочередно соединяются друг с другом, образуя белковую цепь.
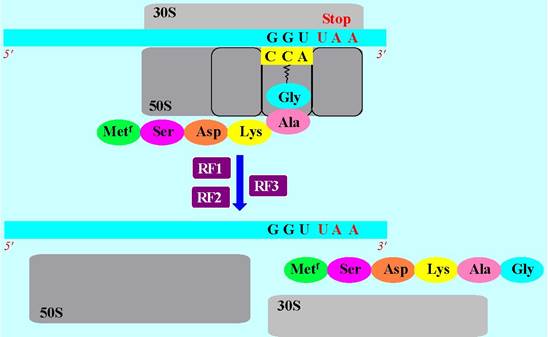
✵ Терминация. По достижении «стоп»-кодона, для которого не существует комплементарной тРНК, биосинтез белка останавливается, и полипептидная цепь отщепляется от комплекса, а 70S рибосома распадается на субъединицы. Эти процессы происходят при участии факторов отсоединения RF1, RF2, RF3. Первые два из них катализируют отщепление белковой цепи от тРНК при достижении кодонов UAA, UAG и UAA, UGA соответственно, а третий - промотирует их действие.
Трансляция в прокариотах протекает с большой скоростью - за секунду присоединяется около 20 аминокислот.
Во многих случаях процессы транскрипции и трансляции протекают одновременно. Сразу несколько транскриптаз, двигаясь по ДНК, осуществляют биосинтез мРНК, на которых, в свою очередь, закрепляются десятки рибосом, реализуя биосинтез молекул белка.
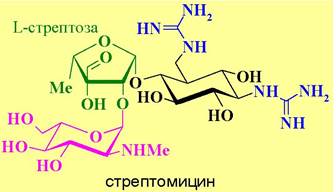
✵ Антибиотики - ингибиторы рибосомального синтеза белка. Механизм антибиотического действия многих антибиотиков включает связывание с определенными участками структуры прокариотической рибосомы и, как следствие, блокирование биосинтеза белка.
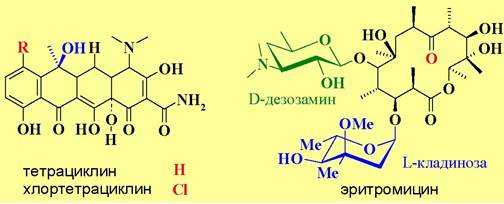
Так стрептомицин, относящийся к группе аминогликозидных антибиотиков, прочно связывается с 30S субъединицей, вызывая изменения в Р-участке, и тем самым блокирует вхождение стартовой формил-Met-тРНК в рибосому и, соответственно, начало биосинтеза белков. Тетрациклины образуют прочные комплексы в A-участке рибосом и препятствуют связыванию аминоацил-тРНК с 30S субъединицами.
Механизм воздействия макролидных антибиотиков, например, эритромицина, на микроорганизмы также связан с нарушением биосинтеза белков в рибосомах в результате их связывания с 50S субъединицей и ингибирования взаимодействия пептидил-тРНК с Р-участком рибосомы.
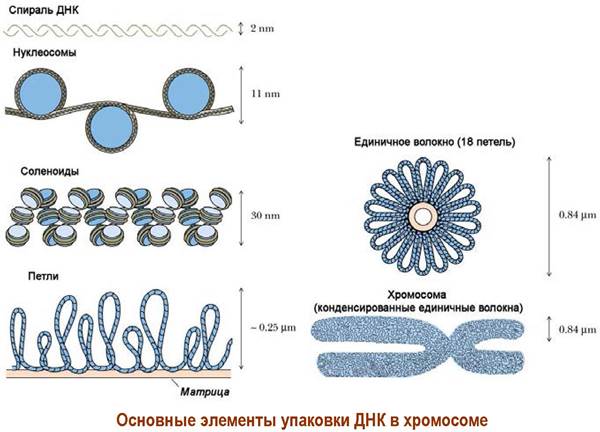
❖ Хроматин. Генетический материал клетки сосредоточен в хромосомах клеточного ядра. ДНК длиной до нескольких миллиметров или даже сантиметров упакованы в хромосомы размерами в несколько микрометров. Например, 46 хромосом человека с общей длиной 200 мкм содержат 2 м ДНК. Укладка ДНК производится с помощью небольших белков-гистонов (молекулярная масса 10-30 кДа), содержащих большое количество основных аминокислот (Arg и Lys), и негистоновых белков. Все вместе они образуют нуклеопротеиновый комплекс - хроматин.
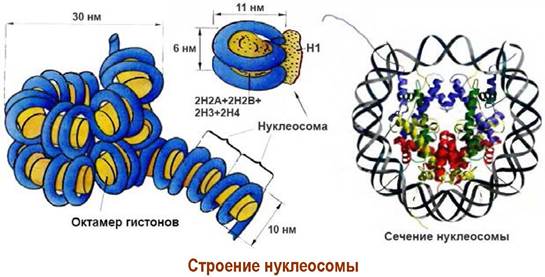
Хроматин состоит из дискретных частиц - нуклеосом, в которых на комплекс из 4 пар гистоновых белков (по две молекулы Н2А, Н2В, Н3 и Н4) накручена ДНК (~140-150 пар оснований). Нуклеосомы соединены «перемычками» свободной ДНК (~50 пар оснований).
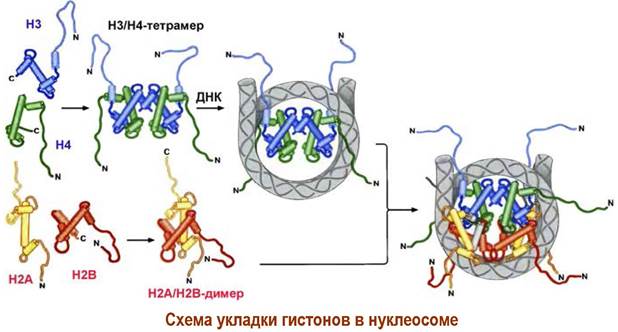
Цепочка из 6 нуклеосом закрепляется гистоном Н1, образуя один виток соленоида. Цепь соленоидов складывается в петли, которые далее образует единичные волокна (сечением ~840 нм). Последние, конденсируясь друг с другом, формируют хромосомы. Для реализации структур соленоида и единичных волокон необходимы негистоновые белки.