СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
02. БЕЛКИ И ПЕПТИДЫ: КЛАССИФИКАЦИЯ И СТРОЕНИЕ
❖ Белки (протеины) - природные полимеры, состоящие из остатков α- аминокислот, соединенных посредством пептидной (амидной) связи.
Каждый индивидуальный белок имеет не только присущий ему аминокислотный состав, но и строго определенную структуру. Молекулярная масса белков может достигать нескольких миллионов Да, например, компонент мускулов человека титин содержит 34 350 аминокислот и его М ~3 816 кДа.
В отдельный класс органических соединений белки были выделены в начале XVIII в. по предложению французского химика А. Фуркруа. Г олландский химик Г. Мульдер выявил аминокислоты в продуктах разложения белков, а в 1836 г. создал первую модель химического строения белков. В 1894 г. немецкий физиолог Альбрехт Коссель доказал, что аминокислоты являются основными структурными элементами белков, а в начале XX в. Эмиль Фишер экспериментально подтвердил, что белковые молекулы состоят из аминокислотных остатков, соединённых пептидными связями.

❖ Классификация белков.
♦ По составу: выделяют простые белки - построенные только из аминокислот, и сложные белки - в структуру которых наряду с аминокислотами входят другие органические и неорганические соединения: гликопротеины, металло- и хромопротеиды и др.
♦ По происхождению: животные, растительные, бактериальные, вирусные.
♦ По органам и клеточным органеллам: белки плазмы, иммунные белки, рибосомные, мембранные и т. д.
♦ По принципу построения: глобулярные, имеющие компактную объёмную форму и растворимые в воде, фибриллярные, обладающие нитевидной формой и нерастворимые в воде, а также мембранные - встроенные в липидную мембрану белки.
♦ По функции: структурные, резервные, гормоны, токсины, ферменты и т. д.
❖ Пептиды - белковые структуры с молекулярной массой ниже 5000 Да. Различают пептиды линейного, циклического и циклолинейного строения. Кроме того, пептиды подразделяют на гомомерные, которые состоят только из аминокислот, и гетеромерные, в состав которых наряду с аминокислотами входят другие органические соединения, например, валиномицин содержит гидроксикислоты.
❖ Первичная структура белков - последовательность соединения аминокислот.
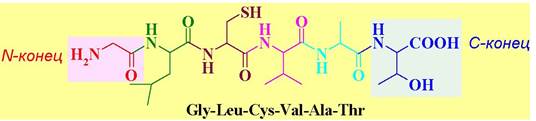
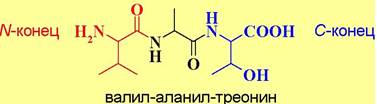
Именно химическая природа аминокислот и порядок их соединения определяет пространственную структуру белка и, следовательно, его свойства. Каждый белок имеет свою индивидуальную первичную структуру. Чередованием относительно небольшого количества аминокислот получается огромное разнообразие белковых структур. Это напоминает, как с помощью небольшого количества букв можно написать бесконечное множество книг. Недаром аминокислоты называют «химическим языком природы». Обычно аминокислотную последовательность записывают, начиная с аминокислоты, содержащей свободную аминогруппу (вконец), и заканчивая аминокислотой со свободной карбоксильной группой (С-конец).
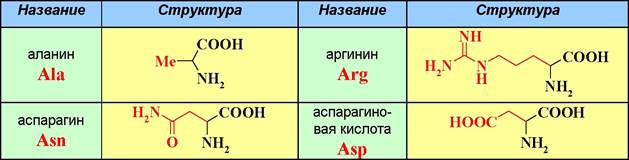
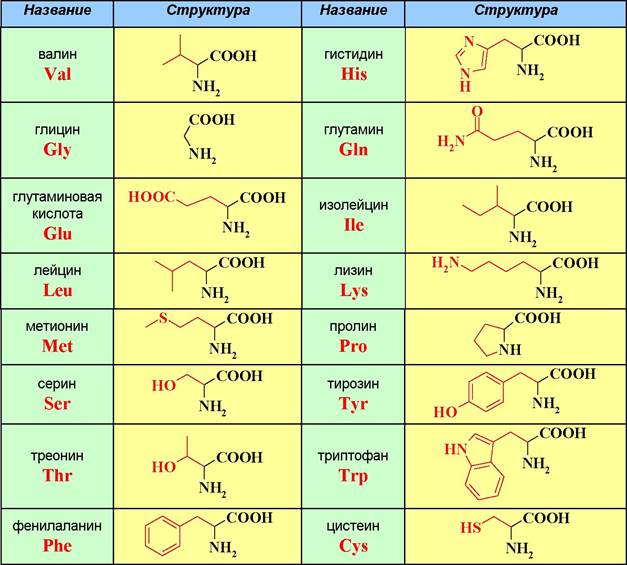
❖ Строение и номенклатура аминокислот. Из природных аминокислот наиболее распространены а-аминокислоты. Известно более 300 природных аминокислот, из которых 20 считаются основными. Структура и тривиальные названия этих аминокислот представлены в таблице 1.
Таблица 1. Тривиальные названия генетически кодируемых аминокислот
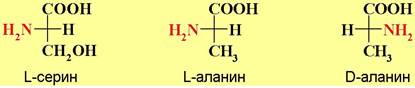
α-Аминокислоты, за исключением глицина, имеют асимметрический атом углерода и могут находиться в двух энантиомерных формах. Природные амнокислоты получаемые из белков животного и растительного происхождения, в основном относятся к L-ряду. В качестве стандарта для определения конфигурации асимметрического центра аминокислот используют природный L-серин. Например, конфигурация природного аланина обозначается L, так как конфигурация его верхнего тетраэдра совпадает с конфигурацией L- серина.
В случае аминокислот с двумя асимметрическими центрами тривиальные названия (треонин, изолейцин) закреплены за аминокислотами белкового происхождения. Для их диастереомеров применяют названия с приставкой алло-.
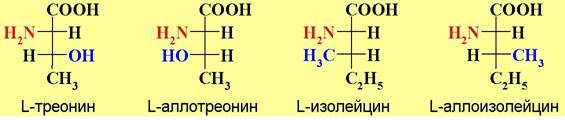
❖ Классификация аминокислот. Карбоксильная и аминогруппы обеспечивают аминокислотам общие свойства, в том числе, способность образовывать пептидную связь. Различаются аминокислоты друг от друга строением боковой цепи, природа которой влияет на свойства, как аминокислот, так и образованных ими белков. В простейшем случае заместителем в α- положении аминокислоты является водород (глицин).
✵ Химические классификации. С точки зрения химического строения аминокислоты можно подразделить по нескольким признакам.
♦ По кислотно-основным свойствам:
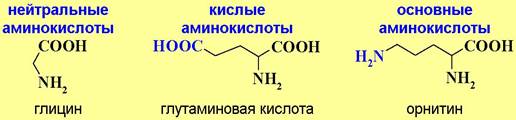
Карбоксильная и аминогруппа взаимно нейтрализуют друг друга, поэтому большинство аминокислот относят к нейтральным аминокислотам. Дополнительная карбоксильная группа в боковой цепи придает соединению кислые свойства, соответственно, аминогруппа - основные.
♦ По природе боковой цепи:
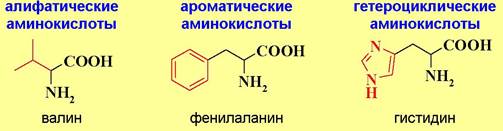
♦ По гидрофильно-гидрофобным свойствам:

По отношению к воде аминокислоты подразделяются на гидрофильные - содержат в боковой цепи полярные гидроксильные, карбоксильные и аминогруппы, и гидрофобные - в боковой цепи присутствуют алифатические и ароматические заместители.
✵ С биохимической точки зрения выделяют 20 основных протеиногенных, или иначе генетически кодируемых, аминокислот (см. таблицу 1). Остальные аминокислоты относят к необычным (редким) аминокислотам. Среди них многие соединения можно рассматривать как продукты химической модификации (метилирования, гидроксилирования, декарбоксилирования и дезаминирования и т. п.) основных аминокислот. Например,
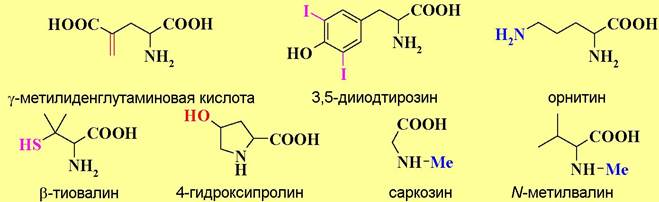
Выделяют также аминокислоты, которые не синтезируются в организме человека и, соответственно, должны обязательно поступать с пищей. К так называемым, незаменимым аминокислотам относят лизин, лейцин, изолейцин, метионин, фенилаланин, треонин, триптофан и валин.
❖ Номенклатура пептидов. При построении названий коротких пептидов за основу берется С-концевая аминокислота, а остальные аминокислотные остатки рассматриваются как ее заместитель, название которого составляют из перечисления начиная с N-конца аминоацильных заместителей. Название последних образуют от тривиальных названий аминокислот заменой окончания -ин на -ил. Например,
Исключение составляют иначе образованные названия: цистеинил, аспарагинил, глутаминил и триптофил.
❖ Химические связи в белковых молекулах.
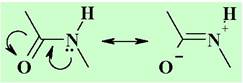
✵ Пептидная связь. Пептидная связь практически плоская, отклонение от плоскости не превышает 5-10°. Связи N-Н и С=О обычно находятся в транс-расположении. По причине взаимодействия электронной пары атома азота с π-системой карбонильной группы свободное вращение вокруг связи С-N отсутствует, что ограничивает общую конформационную подвижность пептидной цепи. Длина пептидной связи - 0,132 нм, что меньше чем у обычной связи С-N.
✵ Дисульфидная связь. Тиольные функции в боковой цепи цистеина способны к окислительной димеризации, образуя дисульфидные мостики между пространственно удаленными участками одной пептидной цепи или двумя различными пептидными цепями.
❖ Невалентные взаимодействия в белках и пептидах.
Наряду с ковалентными связями на пространственное строение белков и пептидов существенное влияние оказывают невалентные взаимодействия.
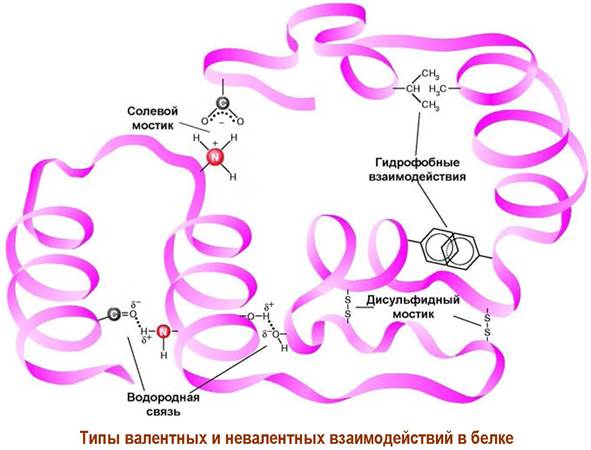
✵ Водородные связи. Подвижные атомы водорода в группе NH, а также в расположенных в боковых цепях группах ОН и SH, обычно образуют водородные связи с атомом кислорода в группе С=О. Чаще всего такие связи реализуются между пептидными фрагментами, но возможно участие функциональных групп боковых цепей.
✵ Ионные взаимодействия. Различные аминокислоты, в том числе удаленные друг от друга по аминокислотной цепи, могут связываться за счет притяжения противоположно заряженных функций боковой цепи (-СОО- и -NH3+), образуя солевые мостики. В тоже время рядом расположенные участки цепи могут наоборот отталкиваться друг от друга из-за наличия одноименно заряженных групп.
✵ Гидрофобные взаимодействия. Под действием воды гидрофобные заместители в боковых цепях с одной стороны стремятся занять положение внутри белковой структуры с минимальным контактом с водой, а с другой стороны такие гидрофобные функции предпочтительно распологаются рядом друг с другом, образуя гидрофобные области.
❖ Вторичная структура - пространственно упорядоченные участки пептидных цепей, стабилизированные водородными связями. Впервые возможность реализации таких структур предположил в 1941 г. У. Астбери. Теоретические доказательства вторичной структуры белка привели в 1951 г. американские химики Л. Полинг (лауреат Нобелевской премии по химии 1954 г. и Нобелевской премии мира 1962 г.) и Р. Кори.

Выделяют α- и β-структуры.
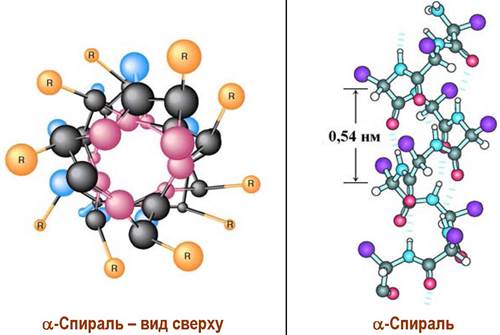
✵ α-Спираль. Пептидная цепь способна самопроизвольно закручиваться в спираль, витки которой скреплены водородными связями. Боковые радикалы аминокислотных остатков при этом оказываются на периферии спирали. Наиболее распространенна α-спираль, в которой амидный атомом водорода образует водородную связь с атомом кислорода четвертого от него аминокислотного остатка, так называемая (5 —> 1)-связь.
На устойчивость спирали влияет природа аминокислот. Стабилизируют спираль нейтральные аминокислоты, например, аланин, валин, лейцин, метионин. Тогда как заряженные аминокислоты, например, лизин, глутаминовая кислота, и аминокислоты, боковые цепи которых создают пространственные препятствия (изолейцин, треонин), препятствуют образованию спирали. Циклическая аминокислота пролин не способна участвовать в формировании α- спирали.
Примером белка, пептидные цепи которого имеют α-структуру, может послужить α-кератин (волосы, шерсть).
✵ β-Структура («складчатый лист») - соединенный водородными связями ассоциат вытянутых, зигзагообразных пептидных цепей. Боковые радикалы располагаются над и под плоскостью «складчатого листа».
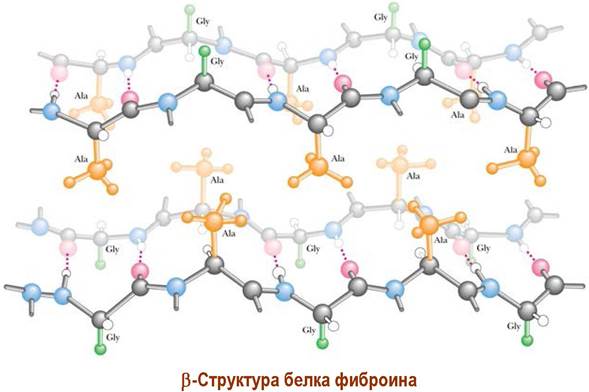
Стабильны β-структуры, построенные из аминокислот с небольшим объемом радикала, например, глицин и аланин. Так, белок натурального шелка фиброин, построенный из белковых цепей с β-структурой, содержит большое количество этих аминокислот.
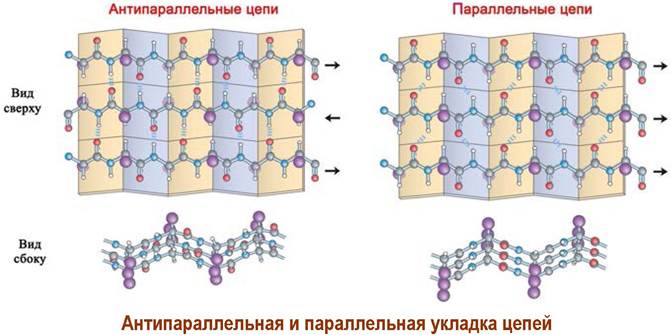
Различают β-структуры с параллельным и антипараллельным направлением пептидных цепей.
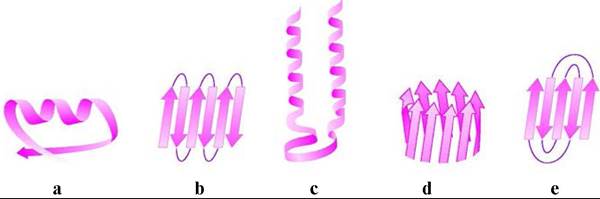
❖ Сверхвторичная структура. Во многих белках α-спирали и β- структуры образуют стандартные комбинации. Примерами таких структур могут послужить
(a) βαβ-блок, в котором две параллельные β-структуры соединены α- спиралью;
(b) β-извилина - пары антипараллельных β-структур, соединяются между собой за счет полярных взаимодействий, одна пара (ββ) называется β- шпилькой по аналогии с шпилькой для волос;
(c) αα-блок - две α-спирали соединены неспирализированным участком; (d) «бочка» («баррель»)- параллельные β-структуры образуют боковую цилиндрическую поверхность;
(е) «греческий орнамент» или «греческий ключ» - размещенные особым способом антипараллельные β-структуры.
❖ Третичная структура белков.
✵ Фибриллярные белки. В эту группу белков входят нерастворимые в воде белковые молекулы, имеющие нитевидное (фибриллярное) строение. Примером такой структуры может послужить белок волос и шерсти - α-кератин. Две α-спиральные цепи кератина закручены друг на друга, образуя протофибриллу. Комплекс протофибрилл образует микрофибриллу, из которых и состоит волос.
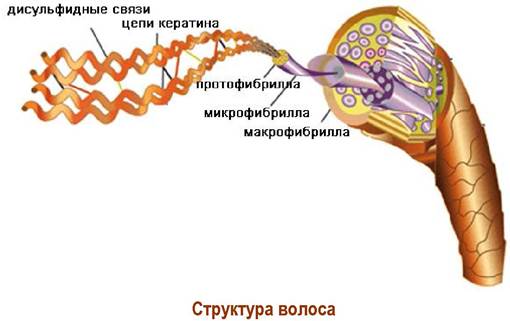
α-Кератин в своем составе содержит достаточно много остатков цистеина (человеческий волос ~14%), что обеспечивает возможность поперечной сшивки молекул белка, придавая дополнительную прочность.
✵ Глобулярные белки. Большинство растворимых в воде белков в пространстве представлены в виде глобулы (неправильной сферы или эллипсоида). Обычно в белковой цепи таких белков участки вторичной структуры сочетаются с неструктурированными фрагментами цепи.
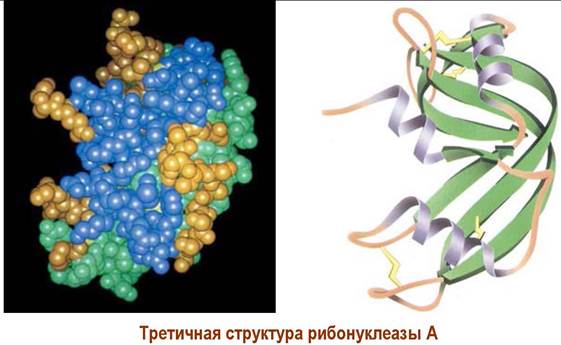
Различные аминокислоты, в том числе удаленные друг от друга по аминокислотной цепи, могут связываться за счет внутримолекулярных водородных связей, притяжения противоположно заряженных функций боковой цепи, а рядом расположенные участки цепи могут наоборот отталкиваться друг от друга из-за наличия одноименно заряженных групп. Большую жесткость третичной структуре белка придают дисульфидные мостики.
Огромную роль в формировании пространственной структуры играет вода: гидрофобные группы стремятся максимально взаимодействовать друг с другом и удалиться от контакта с водой, в тоже время полярные группы выходят на поверхность глобулы.
Совокупность подобных взаимодействий формирует третичную структуру белка. Для большинства белков третичная структура является полной пространственной структурой, которая обеспечивает их специфические биологические свойства.
Наиболее точным методом определения пространственной структуры белка является рентгеноструктурный анализ. Для небольших белковых молекул хорошие результаты дает ЯМР-спектроскопия. На начало 2012 г. Банк данных о белках (Protein Data Bank) содержал более 73 тыс. структур.
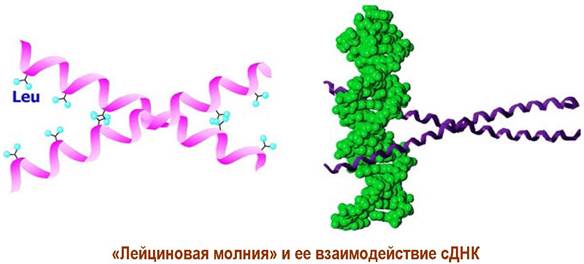
✵ Доменные белки. Многие протеины в своей третичной структуре содержат высокоструктурированные участки (домены), соединенные неструктурированной пептидной цепью. Примерами доменных структур могут послужить иммуноглобулины, «цинковые пальцы» - структура, обеспечивающая взаимодействие белка с ДНК, «EF-hand» - участок связывания ионов кальция, или «лейциновая молния (zipper)» - комплекс двух α-спиралей, способных соединяться или разъединяться посредством образования или разрушения гидрофобных взаимодействий между остатками лейцина. Последний домен также участвует в связывании белков с фрагментами ДНК.
❖ Четвертичная структура. Многие белковые структуры представляют собой комплекс белковых молекул с третичной структурой, связанных между собой в основном водородными связями, гидрофобными и электростатическими взаимодействиями. В некоторых случаях компоненты соединены дисульфидными связями. Фактически все белки с молекулярной массой выше 50 кДа - олигомерны.
Биологические свойства характерны именно комплексу белков, а не отдельным субъединицам, например, гемоглобин.
Реализация четвертичной структуры позволяет экономить генетический материал, кодирующий биосинтез белка. При этом с одной стороны уменьшается вероятность ошибки в процессе трансляции, а с другой - реализуется возможность выбраковки дефектных белков при самосборке четвертичной структуры.
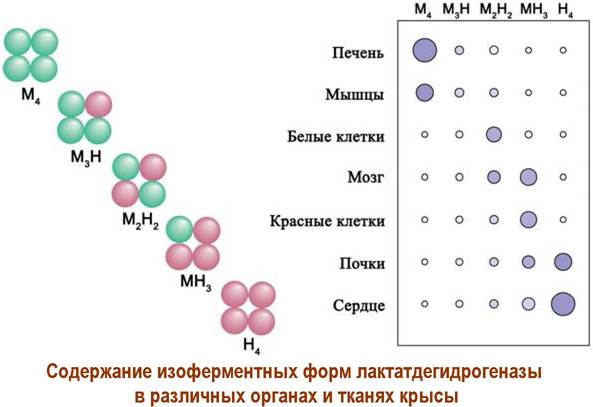
Кроме того, образование четвертичной структуры белка из субъединиц позволяет плавно регулировать активность белка в клетке. Например, фермент лактатдегидрогеназа существует в тканях крыс в 5 формах с одинаковой молекулярной массой ~134 кДа - т. н. изоферменты. Все они катализируют одну реакцию, но различаются по активности.
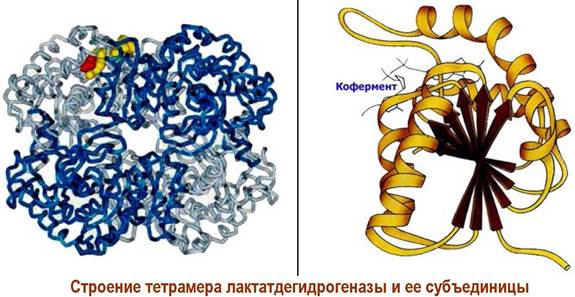
Данный фермент состоит из четырех белковых цепей двух типов М и Н с молекулярной массой ~33,5 кДа, что позволяет образовать 5 структур: М4, МзН, М2Н2, МНз и Н4.
Отличается и локализация этих изоферментов в различных органах, например, в печени и скелетных мышцах преобладает М4, а сердечной мышце и клетках почек - Н4.
❖ Денатурация и ренатурация. При действии кислот, некоторых солей, растворителей, поверхностно-активных веществ пространственная структура белка разрушается. Соответственно белок теряет свою биологическую активность. Такой процесс называется денатурацией.
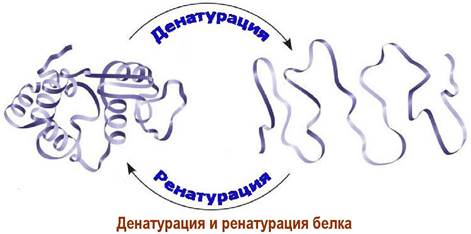
Различают необратимую денатурацию при действии кислот или высокой температуры, например, при варке яичного белка, и обратимую денатурацию, возникающую под воздействием поверхностно-активных веществ, некоторых солей или мочевины.
В последнем случае при удалении денатурирующих веществ и окислении тиольных групп до дисульфидных может происходить ренатурация - возвращение к исходной пространственной структуре и восстановление биологической активности.