СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
03. ФЕРМЕНТЫ
Практически все процессы жизнедеятельности протекают с участием белковых соединений. К числу наиболее важных функций белков относятся ферментативная деятельность, участие в работе гормональной и иммунной систем организма. Также выделяют в отдельные группы транспортные, структурные, двигательные, регуляторные и многих другие белки. В данной главе рассмотрим проявление белками ферментативных свойств. Ряд других функций белков будет рассмотрен в последующих главах.
❖ Ферменты (от лат. fermentum - закваска) - белки или белковые комплексы, являющиеся специфическими и высокоэффективными катализаторами химических реакций, протекающих в живой клетке. В качестве синонима используется термин энзим (от греч. evjomov - дрожжи).
Термин «фермент» был введен в научную практику в начале XVII в. голландским ученым Жаном Баптистом ван Гельмонтом для обозначения веществ, способствующих пищеварению.

Во второй половине XIX в. выдающийся французский микробиолог и химик Луи Пастер высказал предположение, что процесс брожения катализируется некой жизненной силой, находящейся в дрожжевых клетках. А в 1897 г. немецкий химик и биохимик Э. Бухнер доказал экспериментально, что брожение может активировать и бесклеточный дрожжевой сок. В 1907 г. он удостоился Нобелевской премии по химии за открытие внеклеточной ферментации.
Окончательное доказательство белкового строения ферментов связано с именем американского биохимика, лауреата Нобелевской премии по химии 1946 г. Дж. Самнера, который в 1926 г. получил фермент уреазу в кристаллическом виде.

Ферменты имеют широкий диапазон молекулярных масс от 10 кДа до более 2 млн. Да. В их состав наряду с полипептидными цепями могут входить и небелковые компоненты (кофакторы) - ионы металлов, витаминоподобные соединения, порфирины.
Таблица 2. Катионы металлов - кофакторы ферментов
Фермент |
Катион |
Фермент |
Катион |
цитохромоксидаза |
Сu2+ |
аргиназа |
Мn2+ |
пероксидаза |
Fe2+ |
динитрогеназа |
Мо4+ |
пируваткиназа |
К+ |
уреаза |
Ni2+ |
гексокиназа |
Мg2+ |
алкогольдегидрогеназа |
Zn2+ |
Для работы ряда ферментов необходимо присутствие особых органических молекул - коферментов. Обычно они обеспечивают перенос определенных молекул или ионов (см. Таблицу 3).
Таблица 3. Группы, переносимые с участием коферментов
Кофермент |
Группа |
Кофермент |
Группа |
биотин |
СО2 |
кофермент В12 |
Н/алкил |
кофермент А |
ацил |
флавинадениндинуклеотид |
е- |
тетрагидрофолат |
1С |
никотинамидадениндинуклеотид |
Н- |
пиридоксальфосфат |
амин |
тиаминдифосфат |
альдегид |
Кофермент, прочно соединенный с белком, называют простетической группой. В случае способности комплекса «кофермент-белок» к диссоциации исходный комплекс называют холоферментом, а белок без кофермента - апоферментом.
При взаимодействии фермента (Е) с субстратом (S) образуется промежуточный фермент-субстратный комплекс (ES), который затем распадается с образованием продукта реакции (Р) и фермента в исходном состоянии.
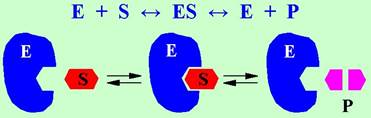
Взаимодействие субстрата проходит в особом участке фермента - активном центре. Субстратную специфичность фермента обеспечивают ряд фрагментов структуры фермента (участки связывания), посредством которых происходит узнавание субстрата и его фиксация в нескольких точках (подробнее см. ниже).
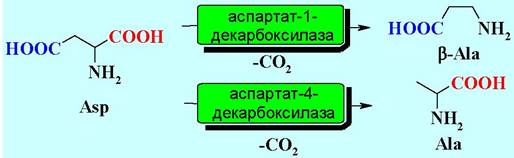
✵ Селективность ферментов. Известно более 4000 реакций, катализируемых белками. Ферменты высокоспецифичны, как по отношению к типу реакции (хемоселективность), которую они катализируют, так и к субстратам. Константа связывания «фермент-субстрат» может достигать 10-10 моль/л. Более того ферменты обеспечивают и регоселективность - катализируют реакцию определенной функциональной группы. Например, при действии на аспарагиновую кислоту двух различных декарбоксилаз селективно удаляется α- или β-карбоксильная группа.
Многие ферменты стереспецифичны, причем, как по отношению к энантиомерии асимметрических центров субстрата (энантиоселективность), так и цис-, транс-конфигурации (диастереоселективность). Например, фермент фумараза катализирует обратимое превращение фумарата в L- малат. При этом он не действует ни на малеат, ни на D-малат.
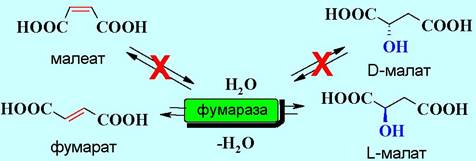
✵ Эффективность ферментов как катализаторов биохимических реакций чрезвычайно высока. Например, 1 молекула фермента ренина при температуре 37 °С за 1 мин створаживает ~105 молекул казеиногена молока. Некоторые ферменты настолько активны, что реакция происходит фактически при каждом их контакте с субстратом. Скорость такой реакции ограничивается только скоростью диффузии субстрата. Такие энзимы называют каталитически совершенными ферментами. К ним, в частности, относятся ацетилхолинэстераза, фумараза, β-лактамаза, супероксиддисмутаза.
✵ В качестве единиц ферментативной активности используют международную единицу (МЕ), которая соответствует количеству фермента, способного превратить 1 мкмоль субстрата в продукт за 1 мин, и катал (кат) - количество катализатора, превращающего 1 моль субстрата в продукт за 1 сек. 1 кат = 6-107 МЕ.
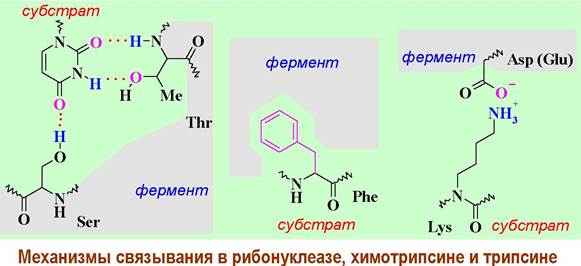
❖ Номенклатура ферментов. Обычно название фермента состоит из названия субстрата с добавлением суффикса -аза. Например, аргиназа катализирует гидролиз аргинина, рибонуклеаза расщепляет РНК и т. д.
Альтернативно название фермента составляют добавление суффикса -аза к названию катализируемой реакции. Например, дегидрогеназа катализирует отщепление водорода, гидролаза катализирует гидролиз и т. д. Ряд ферментов сохранили тривиальные названия: химотрипсин, папаин, лизоцим.
❖ Классификация ферментов.
✵ По принципу построения структуры фермента:
♦ Ферменты, состоящие из одной полипептидной цепи (лизоцим).
♦ Ферменты, состоящие из нескольких полипептидных цепей, соединенных дисульфидными связями (химотрипсин).
♦ Ферменты, состоящие из нескольких субъединиц, соединенных нековалентными связями (лактататдегидрогеназа).
♦ Полифункциональные ферментные ансамбли - одна полипептидная цепь образует активные центры нескольких функционально связанных ферментов. Например, три фермента биосинтеза пиримидинов - карбамоилфосфатсинтетаза, аспартаткарбамоилтрансфераза и дигидрооратаза, реализуются одной полипептидной цепью с молекулярной массой 2,15 млн. Да.
♦ Полиферментные комплексы - несколько ферментов, соединенных ковалентными связями, катализируют серию последовательных реакций, например, биосинтез жирных кислот реализуется в комплексе из 7 ферментов.
✵ По типам катализируемой реакции:
♦ оксиредуктазы - катализируют окислительно-восстановительные процессы,
♦ трансферазы - катализируют перенос функциональных групп,
♦ гидролазы - катализируют реакции гидролиза,
♦ лиазы - катализируют присоединение по двойной связи,
♦ изомеразы - катализируют реакции изомеризации,
♦ лигазы - катализируют реакции синтеза за счет энергии АТР.
❖ Основные классы ферментов. В 1972 г. принята новая международная номенклатура ферментов, в которой названия ферментов основываются на природе катализируемой реакции. Каждый фермент кодируется набором цифр. Первая цифра означает главный класс, следующая цифра относится к характеристике реакции, последующая цифра предусматривает дополнительные уточнения. Например, 2.1.1 означает
2 - класс трансфераз,
2.1. - перенос одноуглеродного остатка,
21.1. - перенос метильной группы.
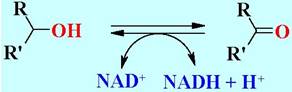
✵ 1. Оксидоредуктазы - ферменты, катализирующие окислительно восстановительные реакции. Ферменты этого типа переносят водород (или электроны) и катализируют гидрогенизацию и дегидрогенизацию биомолекул. В их состав входят специфические коферменты.
Подгруппа |
Катализируемая реакция: гидрогенизация и дегидрогенизация функциональных групп или молекул |
1.1 |
>СН-ОН |
1.2 |
>С=О |
1.3 |
-СН=СН- |
1.4 |
>СН-NH2 |
1.5 |
>СН-NH- |
1.6 |
NADН, NADРН |
Например, алкагольдегидрогеназа обратимо окисляет спирты до карбонильных соединений.
✵ 2. Трансферазы - ферменты, катализирующие реакции переноса групп атомов, например, метильных, карбоксильных, формильных, фосфатных и т.д.
Подгруппа |
Катализируемая реакция: перенос функциональных групп |
2.1 |
Одноуглеродного остатка |
2.2 |
Карбонильной группы |
2.3 |
Ацильной группы |
2.4 |
Гликозила |
2.5 |
Алкильной (кроме метильной) или арильной группы |
2.6 |
Азотсодержащей группы |
2.7 |
Фосфорсодержащей группы |
2.8 |
Серосодержащей группы |
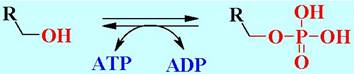
Перенос осуществляется с помощью специфических переносчиков, которые действуют как коферменты. Например, протеинкиназы обеспечивают фосфорилирование белков за счет фосфатной группы АТР.
✵ 3. Гидролазы - ферменты, катализирующие реакции гидролитического расщепления. Называются в соответствии с типом разрываемой связи (гликозидазы, эстеразы и т. д.).
Подгруппа |
Катализируемая реакция: гидролитическое расщепление связей |
3.1 |
Сложных эфиров |
3.2 |
Гликозидов |
3.3 |
Простых эфиров |
3.4 |
Пептидов |
3.5 |
Других С-N-связей |
3.6 |
Ангидридов кислот |
В качестве примера можно рассмотреть амилазу - фермент гидролитически расщепляющий полисахарид амилозу.
![]()
✵ 4. Лиазы - ферменты, катализирующие присоединение групп к двойным связям или, наоборот, негидролитическое отщепление групп или молекул (в том числе, СО2, Н2О, NНз и других более сложных) с образованием двойной связи.
Подгруппа |
Катализируемая реакция: присоединение по двойной связи групп |
4.1 |
>С=С< |
4.2 |
>С=О |
4.3 |
>С=N- |
Действие фермента фумаразы, относящегося к этому классу, рассмотрено выше.
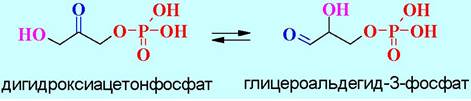
✵ 5. Изомеразы - ферменты, катализирующие реакции изомеризации, в том числе, рацемизации, перемещения двойных связей, обмена групп у асимметрического атома углерода, перемещение фосфатной группы к другому атому углерода и т. д.
Подгруппа |
Катализируемая реакция: изомеризация |
5.1 |
Рацемизация и эпимеризация |
5.2 |
цис-, транс-Изомеризация |
5.3 |
Внутримолекулярное окисление-восстановление |
5.4 |
Внутримолекулярный перенос групп |
Например, триозафосфатизомераза катализирует реакции превращения монофосфатов дигидроксиацетона и глицероальдегида.
✵ 6. Лигазы (синтетазы) - ферменты, катализирующие реакции конденсации двух молекул, сопровождаемые гидролизом макроэргической связи в АТР или другом нуклеозидтрифосфате. Например, один из этапов репликации - сшивка фрагментов ДНК в единую цепь обеспечивается ДНК-лигазой.
Подгруппа |
Катализируемая реакция: образование связей с использованием АТР |
6.1 |
>С=О |
6.2 |
>C=S |
6.3 |
>C=N- |
6.4 |
>С-С< |
❖ Факторы, влияющие на скорость ферментативных реакций.
✵ рН среды. Изменение рН среды влияет на конформацию фермента, а значит и на его активность. Для каждого фермента существует оптимальное значение рН, например, для пепсина - рН 1,5, а для аргиназы - рН 9,5-9,9.
✵ Температура. По Вант-Гоффу скорость ферментативной реакции увеличивается ~2 раза при повышении температуры на 10 °С, но обычно не выше 40-50 °С. При более высокой температуре может произойти денатурация белка. В тоже время, обнаружены бактерии, живущие в высокотемпературных гейзерах, бьющих на больших глубинах океанов («черные курильщики»). Следовательно, их ферментные системы выдерживают существенно более высокие температуры.
✵ Активаторы - вещества, увеличивающие активность ферментов.
✵ Ингибиторы - вещества, тормозящие работу ферментов. Различают необратимые ингибиторы, которые необратимо модифицируют важные участки фермента, образуя ковалентные связи, и обратимые ингибиторы, взаимодействующие с ферментом без образования ковалентных связей, которые можно удалить отмывкой, диализом или гель-фильтрацией и тем самым восстановить работу фермента.
В частности, в качестве необратимых ингибиторов для серинсодержащих ферментов используют диизопропилфторфосфат, а для цистеинсодержащих ферментов - йодуксусную кислоту.
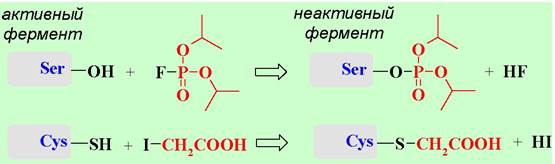
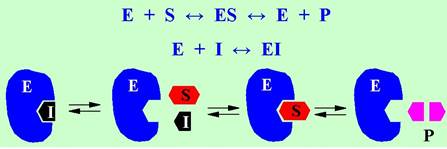
Взаимодействие между ферментом и обратимым ингибитором, в свою очередь, могут происходить как конкурентное и неконкурентное ингибирование. В первом случае ингибитор (I) структурно напоминает субстрат и его связывание происходит в том же месте, что и для субстрата. При этом обычно не протекает каталитическая реакция с ингибитором. Такие ингибиторы менее прочно связываются с ферментом, и активность фермента может быть восстановлена увеличением концентрации субстрата.
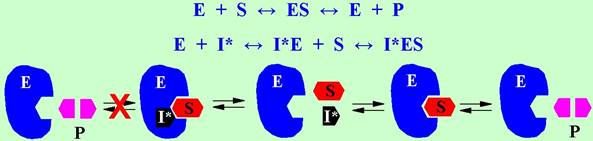
При неконкурентном ингибировании ингибитор (I*) отличается по структуре от субстрата и связывается он с ферментом в другом месте, чем субстрат. Обычно такой тип ингибиторов препятствует не образованию комплекса «фермент-субстрат», а нарушает протекание каталитического процесса превращения субстрата в продукт реакции. В этом случае увеличение концентрации субстрата не приводит к восстановлению активности фермента.
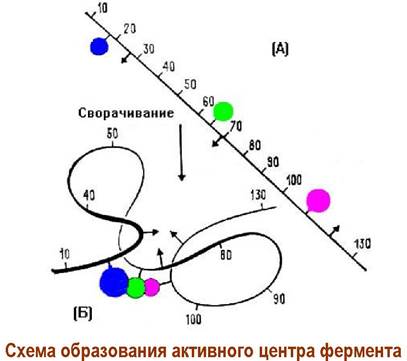
❖ Активный центр. Субстрат связывается в комплекс с ферментом в особой зоне - активном центре. Активный центр часто формируется пространственно удаленными аминокислотами. Условно различают связывающий и каталитический участки.
Каталитический центр обычно образуется аминокислотными остатками, удаленными в первичной структуре друг от друга. Когда пептидная цепь сворачивается под действием валентных и невалентных взаимодействий в третичную структуру, эти аминокислоты оказываются пространственно сближенными. На рисунке показано как сближение неполярных боковых радикалов в результате гидрофобных взаимодействий приводит к созданию активного центра фермента (образующие его аминокислоты обозначены стрелками).
Связывание определяет специфичность фермента. Могут быть задействованы различные принципы фиксации субстрата. Например, в рибонуклеазе гетероциклическое основание связывается водородными связями с остатками серина и треонина, в химотрипсине гидрофобные аминокислоты фиксируются в неполярном «кармане» за счет гидрофобных взаимодействий, а в трипсине основные аминокислоты (Lys или Arg) закрепляются за счет ионных взаимодействий.
В 1890 г. Эмиль Фишер предложил, что гипотезу субстраты действуют на ферменты по принципу «ключ-замок.» - т. е. реализуется точное соответствие формы субстрата и энзима.
В 1958 г. Дениел Кошланд выдвигает гипотезу действия ферментов по принципу «рука-перчатка». В процессе узнавания и связывания субстрата происходит конформационная «подгонка» фермента к субстрату - точная ориентация катализируемых и связывающих групп, создание определенных напряжений в структуре субстрата, что делает его более восприимчивым к действию катализатора. В каталитический участок входят аминокислоты, непосредственно участвующие в катализе. Они обычно имеют ионогенные группы.
Обычно связывание субстрата осуществляется за счет невалентных взаимодействий - водородных связей, ион-ионных, диполь-дипольных и гидрофобных взаимодействий. В некоторых случаях реализуется образование ковалентных связей, например, образование ацилферментов (см. далее химотрипсин). В процессе фиксации субстрата происходят конформационные изменения в структуре фермента. Он «подстраивается» под структуру субстрата. Одновременно многоцентровое связывание субстрата вносит в его структуру «напряжения», благодаря чему в каталитическом центре легче протекает химическая реакция.
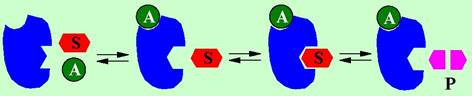
❖ Аллостерические ферменты. Для активации ферментов этого типа необходимо предварительное взаимодействие со специальным лигандом - эффектором (активатором, А). Это взаимодействие протекает по специальному участку фермента - регуляторному центру. В результате образования комплекса «фермент-эффектор» происходит изменение в структуре фермента, и он становится способным взаимодействовать с субстратом.
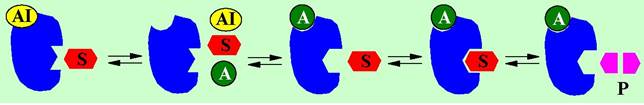
Аллостерическое ингибирование также может быть обратимым или необратимым. В этом случае аллостерический ингибитор (АI), связываясь с регуляторным центром, или конкурирует за связывание с эффектором, или в результате химического взаимодействия делает невозможным узнавание эффектора. В обоих этих случаях изменения в структуре фермента делают невозможным взаимодействие с субстратом.
❖ Активация ферментов. Многие ферменты синтезируются в организме в виде неактивных предшественников - проферментов. Один из механизмов их превращения в активные формы заключается в ковалентной модификации функциональных групп аминокислотных остатков, что приводит к изменению конформации биомолекулы и формированию активного центра.
Наиболее часто происходит фосфорилирование или аденилирование гидроксильных групп под действием аденозинтрифосфата (АТР), а также метилирование карбоксильных групп S-аденозилметионином (Met-A).
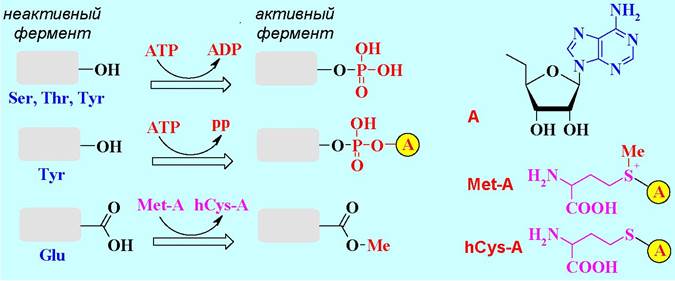
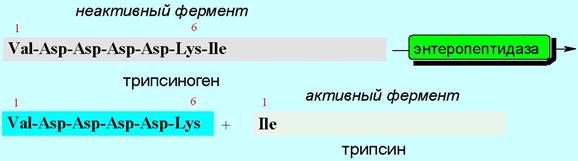
Другой механизм активации заключается в протолитическом отщеплении части пептидной цепи под действием другого фермента. Например, от полипептидной цепи неактивного трипсиногена под действием фермента отщепляется гексапептидный фрагмент, в результате чего образуется активный фермент трипсин. Сам трипсин в свою очередь участвует в активации фермента химотрипсина (см. ниже).
❖ Лизоцим (мурамидаза) - фермент, гидролизующий полисахарид клеточных стенок бактерий (муреин). Был открыт в 1922 г. английским биохимиком Александром Флемингом. Относится к классу гликозидаз. Содержится в различных тканях растений и животных, в частности, в слезной жидкости, яичном белке. В клетках тканях лизоцим локализуется в лизосомах.
Выделено и изучено более 50 мурамидаз из разных источников. Лизоцимы видоспецифичны, например, яичный лизоцим содержит 4 S-S связи и 6 остатков триптофана, а лизоцим человека - 3 S-S связи и 5 остатков триптофана. В составе лизоцима много основных аминокислот, что облегчает его взаимодействие с отрицательно заряженной клеточной стенкой бактерий.
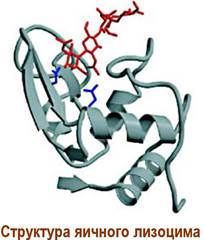
Молекулярная масса яичного лизоцима - 14,6 кДа, он состоит из 129 аминокислот. Фермент представляет собой эллипсоид с осями 3 и 4,5 нм, разделенный на две части: одна гибкая, содержит много полярных аминокислот, а вторая жесткая, с повышенным содержанием гидрофобных аминокислот. Около 25% аминокислотных остатков полипептидной цепи включены в α-спирали.
Между двумя половинами молекулы лизоцима находится щель, в которую помещается гексасахаридный фрагмент пептидогликана, и где происходит процесс расщепления. Не менее 12 аминокислот участвуют в связывании. Активный центр включает две кислые аминокислоты Glu-35 и Asp-52. Первая аминокислота находятся в неполярном окружении и поэтому ее карбоксильная группа неионизированна, а вторая - в полярном и ее карбоксил, соответственно, ионизирован.
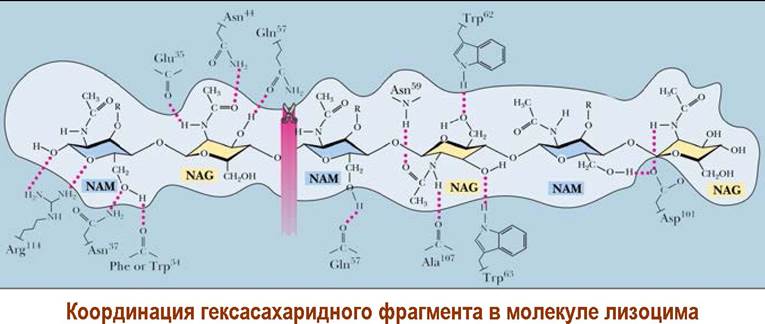
В основе одного из предложенных механизмов действия лизоцима лежит гипотеза о том, что в процессе связывания полисахарида в области каталитического центра остаток мурамовой кислоты (фрагмент D) не может находиться в обычной конформации «кресло». Углеводный цикл переходит в менее устойчивую конформацию «полутвист». В районе гликозидного центра создаются напряжения.
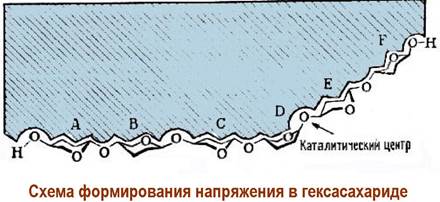
Гликозидный атом кислорода протонируется за счет Glu-35 и затем происходит расщепление гликозидной связи. В результате гексасахарид разрывается на два фрагмента, содержащих, соответственно, четыре и два углеводных остатка. Расщепление полисахаридной цепи мурамина приводит к разрушению клеточной стенки бактерии, что и является основой антибактериального действия лизоцима.
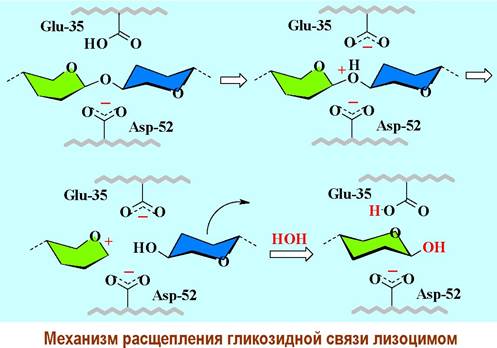
Лизоцим находит применение в медицине в качестве антисептика и противовоспалительного средства. В частности, он усиливает действие β- лактамных антибиотиков, например, пенициллина.
❖ Химотрипсин - протеолитический фермент (эндопептидаза). Его основная функция - гидролиз белков и пептидов.
Процесс расщепления преимущественно проходит по ароматическим аминокислотам (Tyr, Trp, Phe), а также Met. Этот фермент способен катализировать перенос ароматических ацильных групп на другие аминокислоты, благодаря чему используется в ферментативно-катализируемых синтезах.
Молекулярная масса химотрипсина ~25 кДа. Его молекула состоит из трех цепей (А, В и С), содержит 241 аминокислоту, соединенных 5 S-S связями. С-конец цепи С имеет структуру α-спирали. Внешняя форма - эллипсоид.
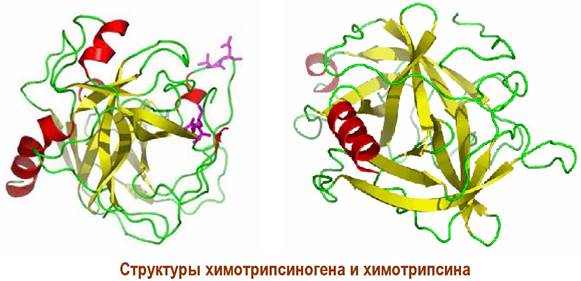
Секретируется химотрипсин в виде профермента - химотрипсиногена. Превращение в активный фермент происходит в двенадцатиперстной кишке под действием трипсина, который вырезает два дипептида (Ser-14 - Аrg-15) и (Thr-147 - Asn-148) (на рисунке показаны фиолетовым цветом). В результате происходит новая укладка трех цепей с формированием каталитического центра.
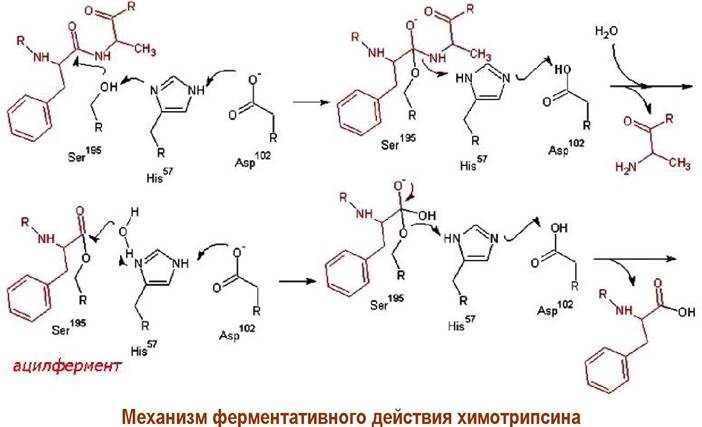
Связывание субстрата с ферментом осуществляется за счет гидрофобных взаимодействий. В активный центр фермента входят три аминокислоты: Ser- 195, His-57 и Asр-102.
В процессе катализа происходит нуклеофильная атака атома кислорода бокового заместителя серина по карбонильному атому углерода пептидной цепи с образованием ковалентной связи между остатком пептидной цепи субстрата и остатком этой аминокислоты. Такая форма энзима называется ацилферментом. Затем происходит гидролиз ацилфермента. В этих процессах аспарагиновая кислота выполняет функцию донора/акцептора протона, а гетероциклический фрагмент гистидина играет роль передатчика протона.
Дыхательные ферменты
Ряд белковых молекул включают в свой состав компоненты небелковой природы - пигменты и ионы металлов, поэтому их относят к хромо- и металлопротеинам. В природе также встречаются белковые комплексы дрогой природы, например, гликопротеины - белки, содержащие одну или несколько олигосахаридных цепей; липопротеины - сферические мицеллы белково-липидной природы; нуклеопротеиды - комплексы белков и ДНК или РНК.
Этот раздел посвящен строению и функции хромопротеинов, специализирующихся на обратимом связывании и транспортировке кислорода в органы и ткани. Такие протеины часто относят к дыхательным ферментам. Структура и функции еще одного хромопротеина родопсина будет рассмотрена в следующей главе.
❖ Миоглобин - хромопротеин, находящийся в тканях, в скелетных мышцах и в мышце сердца, и обеспечивающий перенос кислорода от гемоглобина крови к цитохромам мышечных клеток. Особенно богаты миоглобином мышечные ткани морских млекопитающих. Например, в мышцах дельфинов и тюленей миоглобин составляет, соответственно, 3,5 и 7,7%.
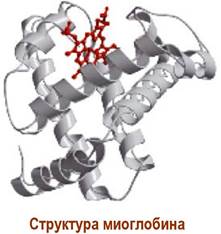
Полипептидная цепь миоглобина кашалота содержит 153 а. о. Его молекулярная масса ~17 кДа. В структуре миоглобина выделяют 8 спирализованных участков, обозначаемых буквами А-Н. Внутри белковой глобулы размером 4,5 х 2,5 нм находится порфириновая структура - гем, содержащий координационносвязанный ион Fe2+.
Гем удерживается в молекуле за счет гидрофобных взаимодействий с полипептидной цепью, а также координационной
связью между атомом железа в геме и атомом азота в остатке гистидина участка F. С другой стороны, гема рядом с атомом железа также расположен гистидиновый атом азота участка Е, но на большем расстоянии.
В этот гидрофобный «карман» может обратимо входить молекула кислорода, координируясь одновременно с атомом железа и атомом азота и образуя оксимиоглобин. Так как данный участок характеризуется низкой полярностью, то не происходит окисления Fe2+ до Fe3+.
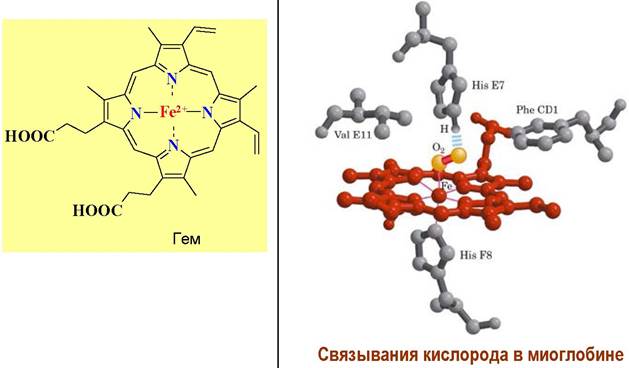
Высвобождение молекулы кислорода из оксимиоглобина происходит в момент сокращения мышцы, когда в результате сжатия капилляров парциальное давление кислорода резко падает. Белок выполняет функцию водорастворимого носителя гема, предохраняет Fe2+ от окисления и регулирует величину сродства к кислороду.
❖ Гемоглобин. В эритроцитах находятся белковые молекулы гемоглобина (1 клетка содержит ~340 млн. молекул), которые осуществляют перенос кислорода в организме. Этот хромопротеин состоит из двух α- и двух β-субъединиц, содержащих по 141 и 146 аминокислот соответственно. Каждая белковая компонента, которая близка по строению миоглобину, содержит молекулу гема (показана красным), способного обратимо присоединять по молекуле кислорода.
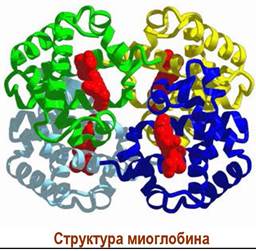
За исследование пространственной структуры миоглобина и гемоглобина в 1962 г. Нобелевская премия по химии была присуждена британским исследователям Дж. Кендрью и М. Перуцу.

Свою биологическую функцию каждая из субъединиц выполняет во взаимодействии с другими. Первая молекула кислорода присоединяется к α- субъединице, которая при этом конформационно изменяется.
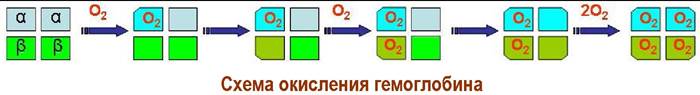
Конформационные изменения передаются β-субъединице, что облегчает ей присоединение молекулы кислорода. «Окисленный» блок αβ-субъединиц изменяет конформацию второго αβ-блока, что приводит к его окислению.
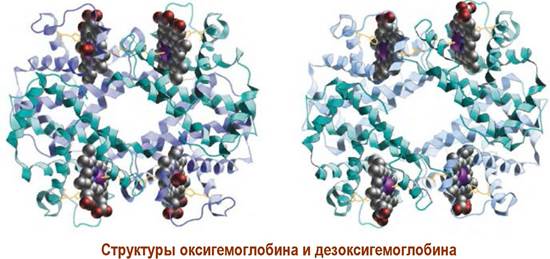
Такая цепочка конформационных изменений приводит к тому, что общая конформация молекулы гемоглобина с присоединенным кислородом (оксигемоглобин) отличается от конформации молекулы без кислорода (дезоксигемоглобин).
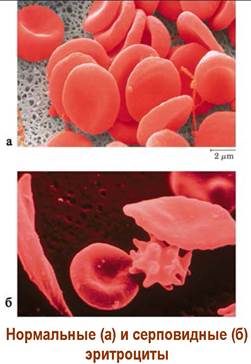
✵ Серповидно-клеточная анемия.
У ряда людей, особенно проживающих в Южной и Юго-Восточной Азии, наблюдается заболевание крови серповидноклеточная анемия, связанное с изменением структуры гемоглобина и соответственно эритроцитов. У больных этим заболеванием в β-субъединице гемоглобина шестой аминокислотой вместо валина является глутаминовая кислота. Даже такое небольшое изменение в аминокислотном составе приводит к существенным изменениям в пространственной структуре гемоглобина. Такой гемоглобин S в отличие от обычного гемоглобина А хуже переносит кислород. У больных наблюдаются признаки гипоксии - кислородного голодания. Красные клетки крови, несущие гемоглобин S, имеют измененную форму в виде серпа - отсюда и название болезни. Они отличаются пониженной устойчивостью, подвержены более легкому разрушению.
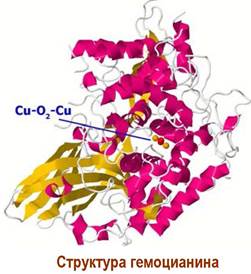
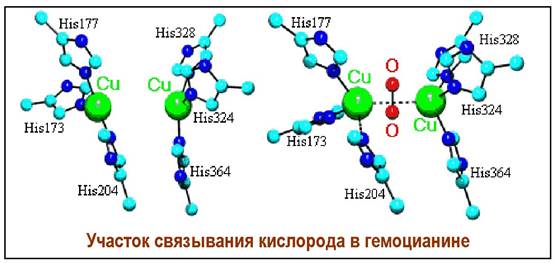
❖ Гемоцианин. У моллюсков и членистоногих функцию переноса кислорода выполняет металлопротеин гемоцианин. Функциональный домен моллюсков состоит из двух участков: α- и β. Субъединица гемоцианина может содержать 7-8 молекулярная функциональных доменов и ее масса достигает 550 кДа.
α-Спирализованный участок содержит два атома меди, каждый из которых координирован с тремя молекулами гистидина. Молекула кислорода помещается в полость между атомами меди, выступая в качестве четвертого центра координации. При этом расстояние между атомами металла уменьшается с 0,46 до 0,36 нм.