СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
04. РЕЦЕПТОРЫ И ЛЕКТИНЫ
Рецепторы
❖ Рецептор (от лат. receptio - восприятие) - конформационно подвижный биополимер, расположенный на поверхности или внутри клетки, способный специфически связывать определенное химическое соединение (лиганд) и формировать биологический ответ.
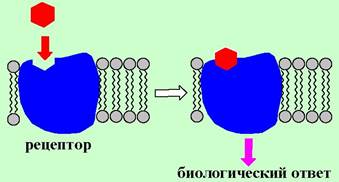
В биологических системах рецепторы взаимодействуют с широким кругом низкомолекулярных биорегуляторов - гормонов, нейромедиаторов, простагландинов и лейкотриенов, нуклеотидов. Такие эндогенные лиганды имеют разнообразное химическое строение. В частности, к ним относятся аминокислоты, пептиды, белки, стероиды, липиды, алкалоиды и биогенные амины.
Большинство рецепторов представляют собой гликопротеины или липопротеины. Взаимодействия «лиганд-рецептор» обычно носят невалентный характер. В связывании лиганда решающую роль играют водородные связи, ионные, диполь-дипольные и гидрофобные взаимодействия. Определенный вклад в образование комплекса «лиганд-рецептор» вносят и ван-дер- ваальсовые силы. В процессе связывания лиганда происходят конформационные изменения, которые далее трансформируются в биологический ответ.
Многие лиганды связываются с рецептором не одним участком своей структуры, а несколькими - т. е. реализуются многоцентровые взаимодействия. Иначе говоря, отдельные компоненты молекулы лиганда, например, функциональные группы или гидрофобные участки, узнаются отдельными участками рецептора.
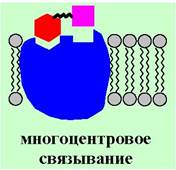
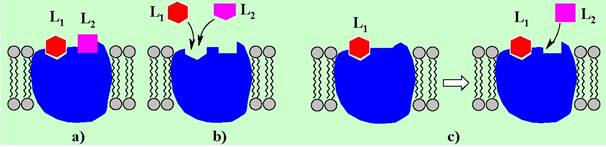
В ряде случаев рецептор может взаимодействовать с нескольким лигандами. Такие взаимодействия подразделяют на несколько типов:
a) неконкурентное - связывание различных лигандов происходит с различными участками структуры рецептора;
b) конкурентное - различные лиганды связываются с одним участком рецептора;
с) бесконкурентное - второй лиганд способен связываться после образования комплекса «рецептор-первый лиганд».
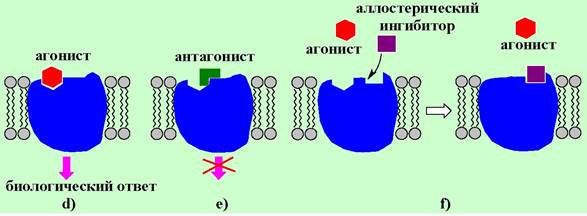
С точки зрения реализации биологического ответа лиганды подразделяют на агонисты - вещества при взаимодействии которых с рецептором индуцируется биологический ответ (d), и антагонисты - химические соединения, взаимодействующие с рецептором, но не вызывающие биологический ответ (е).
Антагонисты могут связываться как с участком узнавания агониста, но другим образом, не приводящим к целевому ответу, так и взаимодействовать с другим фрагментом структуры рецептора, переводя его в неактивное состояние (аллостерический ингибитор) (f).
Способность лиганда связываться с рецептором называют аффинностью. Аффинность агониста оценивают с помощью величины ЕД50 - количество соединения, вызывающего 50% эффект или эффект у 50% экспериментальных животных. Для антагонистов используют характеристику IС50 - концентрация, обеспечивающая 50% ингибирующий эффект.
❖ Классификация рецепторов. Различают рецепторы мембранные (интегрированные в фосфолипидную мембрану клетки) и внутриклеточные, в т. ч. находящиеся на внутренней поверхности клеточной мембраны, в цитоплазме и на мембранах органелл клетки, например, на ядерных мембранах. К последним, в частности, относятся рецепторы на стероидные и тиреоидные гормоны.
Таблица 4. Отдельные типы и подтипы рецепторов
Типы рецепторов |
Подтипы рецепторов |
аденозиновые рецепторы |
А1, А2А, А2В, А3 |
адренорецепторы |
α1А, α1В, α1C, α1D; α2А, α2В, α2С; β1, β2, β3 |
ангиотензиновые рецепторы |
АТ1А, АТ1В, АТ2, АТ3, АТ4 |
ацетилхолинорецепторы |
мускариновые: М1, М2, М3, М4, М5 никотиновые: мышечного и нейронального типа |
брадикининовые рецепторы |
В1, В2 |
ГАМК-рецепторы |
ГАМКA, ГАМКВ, ГАМКС |
гистаминовые рецепторы |
Н1, Н2, Н3, Н4 |
глициновый рецептор |
GlyR |
глутаматные рецепторы |
GluR1-GluR7, КАI, КА2, NR1-NR3, mGlu1-mGlu8 |
дофаминовые рецепторы |
D1, D3, D4, D5 |
кальцитониновый рецептор |
СТ |
лейкотриеновые рецепторы |
ВLТ1, ВLT2, CysLT1, CysLT2 |
опиоидные (эндорфиновые) рецепторы |
μ, δ, к |
простагландиновые рецепторы |
DP1, DР2, FP, IР1, IР2, ТР, ЕР1 - ЕР4 |
пуриновые рецепторы |
Р2Х1-Р2Х7, P2Y, P2Z, Р2Т, Р2U |
ретиноевой кислоты рецепторы |
RАRα, RАRβ, RАRy |
серотониновые рецепторы |
5-HT1(A-F), 5-НТ2(А-F), 5-НТ3, 5-НТ4, 5-НТ5(A-B), 5-НТ6, 5-НТ7 |
соматостатиновые рецепторы |
SST1, SST2(A-B), SST3 - SST5 |
цитокиновые рецепторы |
I, II, IL-1-R, ТNFR |
рецепторы стероидных гормонов |
ЕRα, ЕRβ, АR, ТRα, ТRβ |
Эндогенные лиганды обычно в качестве мишени имеют не один рецептор, а группу рецепторов с однотипной специфичностью, но часто обеспечивающие различный биологический ответ. Различные типы и подтипы рецепторов локализуются на клетках разных тканей. Некоторые типы и подтипы рецепторов представлены в таблице. Соответственно, действие одного лиганда приводит к различному биологическому эффекту в различных органах. Если к началу 90-х годов XX века было обнаружено несколько десятков типов рецепторов, то в результате расшифровки генома человека выявлено существование нескольких сот рецепторов, но к большинству из них лиганды еще не установлены.
Выделяют 4 основных группы рецепторов:
■ рецепторы - ионные каналы (ионотропные рецепторы), например, н- холинорецепторы или ГАМКА-рецепторы;
■ метаботропные рецепторы - сопряжены G-белками, которые в свою очередь могут регулировать действие или ферментов, или ионных каналов, например, ангиотензиновые рецепторы или адренорецепторы;
■ рецепторы, напрямую контролирующие функцию фермента тирозинкиназы, например, рецепторы инсулина и гормонов роста;
■ внутриклеточные рецепторы, осуществляющие контроль за транскрипцией ДНК, например, рецепторы на стероидные и тиреоидные гормоны. Рассмотрим отдельные представители разных групп рецепторов.
Рецепторы — ионные каналы (ионотропные рецепторы)
❖ ГАМКA-рецептор. Рецепторы данного типа состоят из пяти субъединиц. Выявлено несколько типов субъединиц, обозначаемых как α, β, y, δ, ε, π, θ и р. Некоторые субъединицы образуют ряд изоформ: α1-α6, β1-β4, у1-у4 и р1- р3. Наиболее распространены рецепторы α1β2у2- (60%) и α2β3у2- (до 20%) типов. Масса рецепторов составляет 220-270 кДа, а диаметр достигает 8 нм.
Каждая субъединица содержит более 200 аминокислотных остатков, которые образуют 4 трансмембранных α-спирализованных участка (ТМ1-ТМ4) приблизительно по 20 аминокислот в каждом.
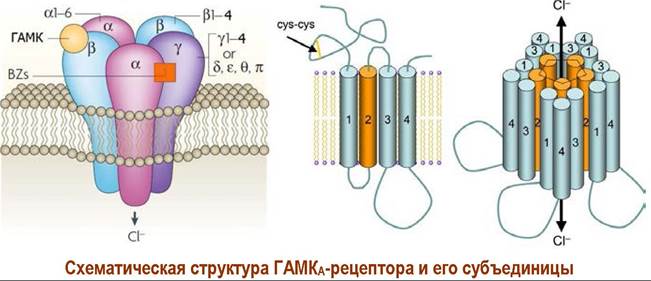
На внешней стороне мембраны расположены гидрофильные N и С- концевые домены. Внутри мембраны выделяют большой гидрофильный домен между фрагментами ТМ-3 и ТМ-4, содержащий сайты фосфорилирования. Домен ТМ-2 обращен к внутренней части канала и содержит аминокислоты, обеспечивающие распознавание ионов. Конформационные изменения в этом домене обеспечивают открытие/закрытие ионного канала.
При действии у-аминомасляной кислоты (ГАМК) на участки связывания, находящиеся в области контактов α- и β-субъединиц происходит изменение конформации белковых субъединиц и образуется ионный канал. Ионы хлора проходят по этому каналу внутрь клетки, вызывая процесс нервного торможения.
Рецептор имеет участки связывания с бензодиазепинами (BZs), барбитуратами, стероидами и этиловым спиртом, которые выступают в качестве аллостерических агонистов.
Метаботропные рецепторы
Рецепторы этого типа взаимодействуют с внутримембранными G-белками, которые далее способны активировать/ингибировать ряд ферментов или ионных каналов.
Структурно метаботропные рецепторы представляют собой трансмембранные протеины или гликопротеины с семью α- спирализованными внутримембранными доменами. Аминокислотная цепь содержит обычно 450-550 а. о. N-конец протеина расположен во внешнеклеточной области и обычно формирует участки связывания с лигандом. С-концевая часть рецептора находится во внутриклеточном пространстве и способна координироваться с G-белками.
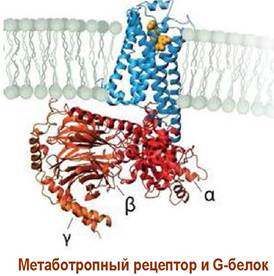
Передача биологического сигнала метаботропными рецепторами осуществляется с помощью специальных сигнальных соединений, называемых внутриклеточными медиаторами или мессенджерами. Наиболее изучены механизмы действия таких внутриклеточных медиаторов как циклоаденозинмонофосфат (сАМР),циклогуанозинмонофосфат (сGМР), инозинтрифосфат, диацилглицерин, оксид азота(II) и ионы Са2+.
G-белки представляют собой комплекс трех субъединиц: α, β и y. Выявлено, по меньшей мере, 20 α-субъединиц, 4 β- и 7 y-субъединиц.
Различают несколько групп G-белков:
■ Gs-белки в своем составе содержат αs-субъединицу и обеспечивают активацию фермента аденилатциклазы и, соответственно, индукцию продукции внутриклеточного медиатора сАМР;
■ Gl-белки включают α1-субъединицу, которая ингибирует аденилатциклазу и активирует гидролитический фермент сАМР-фосфодиэстеразу, что в результате приводит к снижению концентрации сАМР;
■ Gt-белки родопсиновых рецепторов содержат α1-субъединицу (трансдуцин), которая активирует фермент сGМР-фосфодиэстеразу, что приводит к снижению концентрации внутриклеточного медиатора сGМР;
■ Go-белки угнетают Са2+-каналы и активируют К+-каналы;
■ Gк-белки активируют К+-каналы и ингибируют аденилатциклазу;
■ Gq-белки содержат аq-субъединицу, которая способствует активации фермента фосфолипазы С и, соответственно, выработке внутриклеточных медиаторов инозинтрифосфата и диацилглицерина.
За установление механизма работы метаботропных рецепторов в 1994 г. американским ученым М. Родбелу и А. Гилману присуждена Нобелевская премия по физиологии и медицине.

❖ β-Адренергические рецепторы. Взаимодействие β-адренергических рецепторов с норадреналином и адреналином приводит к активации внутриклеточного фермента аденилатциклазы и соответствующему увеличению концентрации внутриклеточного медиатора сАМР, который в свою очередь стимулирует ряд ферментов.
Разберем подробнее основные этапы этого процесса.
Взаимодействие лиганда с рецептором приводит к образованию комплекса «лиганд-рецептор» и изменению конформации рецептора. Конформационные изменения передаются на GS-белок. В αs-субъединице происходит превращение связанного с ней в комплекс гуанозиндифосфата (GDP) в гуанозинтрифосфат (GTP).
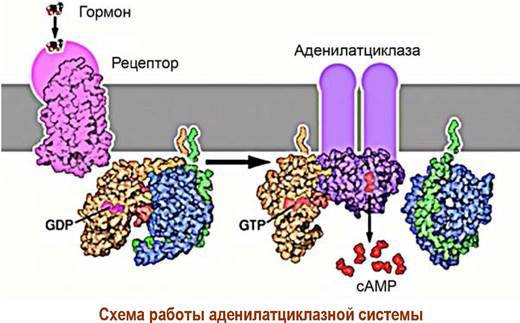
Активированная таким образом α-субъединица отсоединяется от блока β, y-субъединиц и в качестве мишени атакует фермент аденилатциклазу. Фермент активируется и начинает катализировать реакцию синтеза сАМР из аденозинтрифосфата (АТР). Увеличение концентрации сАМР приводит к активации ряда специфических ферментов в клетке, например, внутриклеточных протеинкиназ, что запускает дальнейшие биохимические превращения.
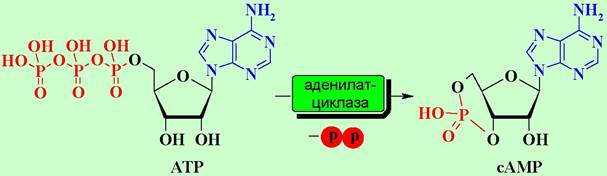
Прекращение передачи сигнала реализуется путем разрушения комплекса «а-субъединица-GTP» ввиду того, что белковая субъединица обладает ферментативной активностью и способна гидролизовать GTP до GDP. В результате чего изменяется конформация субъединицы. Комплекс дезактивируется, и система переходит в неактивное состояние.
В дальнейшем сАМР под действием фосфодиэстераз разрушается и перестает активировать белки. Гормон покидает рецептор и подвергается биодеградации.
Для аденилатциклазной системы характерно усиление сигнала на каждом этапе. Одна молекула рецептора после взаимодействия со своим лигандом способна проактивировать от 10 до 100 G- белков и, следовательно, такое же количество аденилатциклаз. Соответственно каждая молекула активированного фермента синтезирует до 100 молекул сАМР. Таким образом, стимуляция одного рецептора может привести к активации 102-104 специфических ферментов.
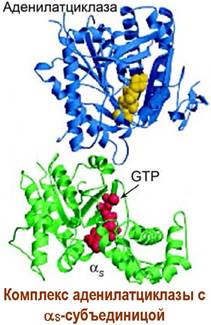
Подобным образом реализуется взаимодействие с рецепторами широкого ряда гормонов, например, рецепторов D1, D2 дофамина, Н2 гистамина, ЕР1, ЕР2 простагландинов, тиротропина и соматостатина.
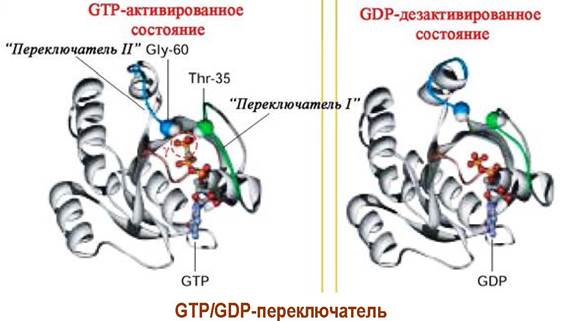
✵ GТP/GDP-переключатель. Одним из важнейших молекулярных механизмов, рассмотренного выше процесса, является регуляция конформаций молекул путем взаимного превращения GDP ⇄ GTP, так называемый «GTP/GDP-переключатель». Удлинение молекулы на один фосфатный остаток приводи к образованию водородных связей с остатками аминокислот и, соответственно, изменению пространственного строения. В свою очередь, гидролиз фосфоэфирной связи возвращает молекулу в исходное состояние. Еще один пример работы «GTP/GDP-переключатель» будет рассмотрен в процессе трансляции.
Внешние агенты, например, дифтерийный или холерный токсин, могут блокировать рассмотренный механизм регуляции. Токсинами называют яды биологического происхождения
✵ Холерный токсин вырабатывается холерным вибрионом (Vibrio cholerae) и состоит из двух блоков. Блок из 5 В-субъединиц с молекулярной массой по 12 кДа обеспечивает присоединение к клеткам кишечника.
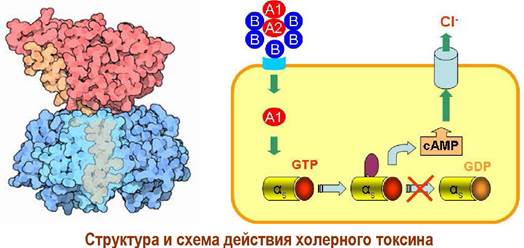
Проникающая внутрь клетки А1-субъединица связывается с αs- субъединицами, блокируя их дальнейшие трансформации, и тем самым увеличивает концентрацию сАМР. отвечает за токсический эффект, увеличивая
концентрацию внутриклеточного медиатора сАМР, что в свою очередь приводит к избыточному открытию хлоридных каналов и, как следствие, - к диарее.
❖ ГАМКB-рецептор. Рецепторы этого типа также найдены в клетках ЦНС. Они состоят из двух гомологичных субъединиц. Сам рецептор устроен аналогично рассмотренному выше. В передаче биологического сигнала участвует не только α1-субъединицы, которые ингибируют аденилатциклазу, но и блок β, у-субъединиц, способный активировать К+-каналы и угнетать Са2+- каналы.
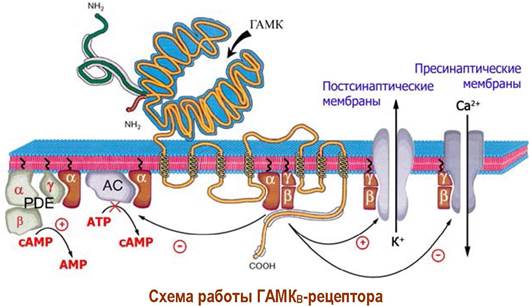
α1-Субъединицы способны не только ингибировать аденилатциклазу, но и активировать фермент фосфодиэстеразу (PDE), катализирующую расщепление сАМР до АМР. Активация PDE происходит, как и в случае рассмотренного ниже родопсина, путем связывания в комплекс α1-субъединицы и ингибирующей y-субъединицы фермента.
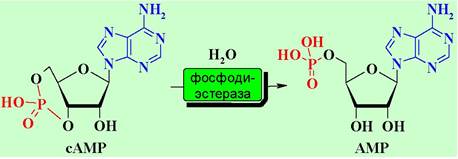
В результате взаимодействия лигандов с такими рецепторами снижается концентрация сАМР в клетке.
Подобным образом работают, в частности, рецепторы М2 и М4 ацетилхолина, α2А, α2В и α2С норадреналина, D2, Dз и D4 дофамина, Н3 и Н4 гистамина и 5-НТ1 и 5-НТ5серотонина.
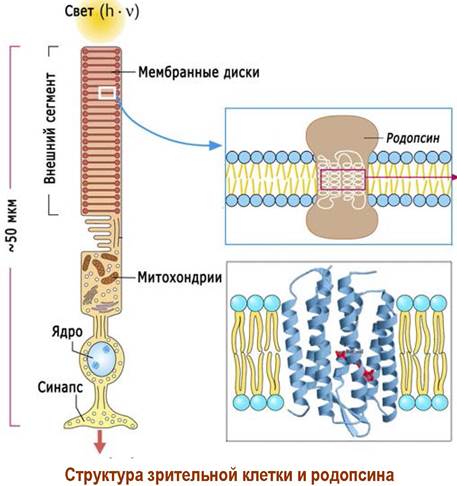
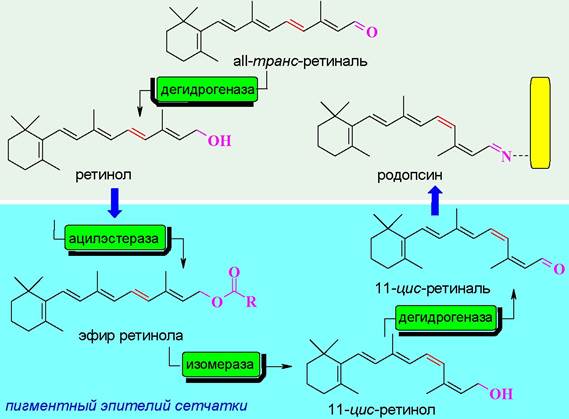
❖ Родопсин - светочувствительный белок (хромопротеин) фоторецепторных клеток-палочек сетчатки глаза. Подобные белки входят также в состав галофильных бактерий.
В состав рецепторного белка входят 348 а. о. На N-концевом участке по остаткам Asn-2 и Asn-15 присоединены углеводные цепи. Молекула родопсина относится к мембранно-интегрированным рецепторам. Семь α- спиральных участков пептидной цепи погружено в фосфолипидный слой мембраны. Аминогруппа в боковой цепи Lys-296 конденсирована с альдегидом 11-цис-ретиналем.
При попадании кванта света на мембрану в полиеновой цепочке остатка ретиналя происходит цепочка превращений, которая заканчивается изомерзацией в аII-транс-ретиналь.
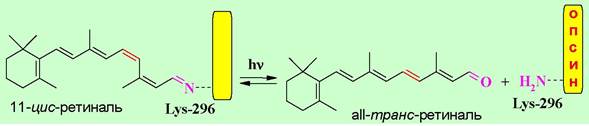
Такое основание Шиффа менее устойчивое по сравнению с исходным, вследствие чего происходит расщепление на белковую часть (опсин) и свободный альдегид. Отщепление ретиналя изменяет конформацию белковой цепи рецептора.
Конформационные изменения передаются на связанный с рецептором Gt-белок (трансдуцин). αt-Субъединица трансдуцина взаимодействует с ингибирующей y-субъединицей фосфодиэстеразы в результате чего фермент активируется и начинает катализировать гидролиз внутриклеточного медиатора cGMP до GMP.
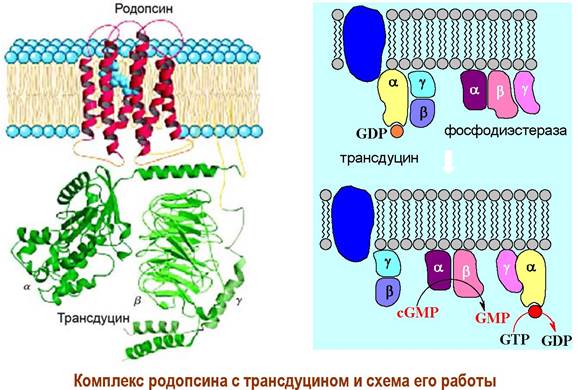
Как и в случае аденилатциклазной системы рецепторное взаимодействие вызывает каскадное усиление сигнала. Считается, что активированная молекула родопсина способна активировать около 500 молекул трансдуцина, что приводит к стимуляции 500 фосфодиэстераз, которые в свою очередь гидролизуют 105 молекул cGMP. В результате 250 Na+-каналов закрывается, что предотвращает выход 106-107 ионов Na+ в секунду, и как конечный итог - гиперполяризация мембраны на 1 мВ, которая в свою очередь передается нервному окончанию клетки.
Процесс восстановления родопсина достаточно сложен и включает стадии восстановления а11-транс-ретиналя до ретинола (витамина А), его этерификацию, изомеризацию, сопровождаемую гидролизом сложного эфира, окисление спирта до 11-цис-ретиналя и присоединение последнего к белку. Большая часть этих химических превращений протекает в пигментном эпителии сетчатки.
Необходимый для организма ретиналь также образуется окислением витамина А (ретинола).
❖ α1-Адренергический рецептор. Взаимодействие с рецепторами норадреналина (α 1-адренорецепторы), а также ряда пептидных гормонов (например, тиролиберина, окситоцина или ангиотензина II), биогенных аминов (мускариновые рецепторы М1, М3, М5 ацетилхолина, рецептор Н1 гистамина), мононуклеотидов (пуриновые рецепторы P2X, P2Y на АТР) и ростовых веществ (цитокининов), протекает через активацию Gq-белков.
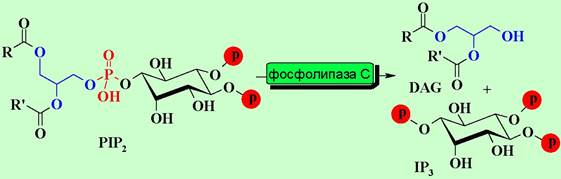
В отличие от аденилатциклазной системы αq-субъединица активирует мембраносвязанный фермент фосфолипазу С (PL-C), который катализирует расщепление фосфатидилинозит-4,5-дифосфата (PIP2) на инозинтрифосфат (IP3) и диацилглицерин (DAG), выполняющих функцию внутриклеточных медиаторов.
Диацилглицерин в комплексе с фосфатидилсерином (PS) в присутствии ионов Са2+ активирует другой мембранный фермент - протеинкиназу С, катализирующую реакцию фосфорилирования, а значит и стимуляции, ряда регуляторных белков.
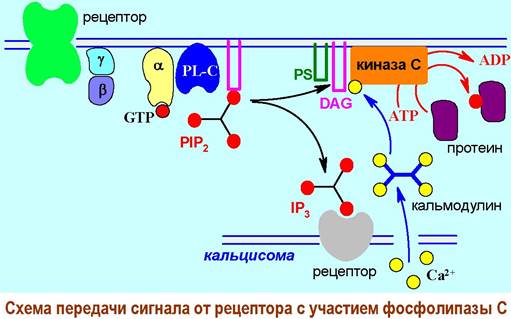
Появление необходимых для перехода протеинкиназы из неактивной формы в активную ионов Са2+ обеспечивает инозинтрифосфат. Он связывается со специфическими рецепторами на Са2+-каналах кальцисом - внутриклеточных органелл, в которых сконцентрированы ионы кальция, и тем самым обеспечивает увеличение концентрации этих ионов внутри клетки.
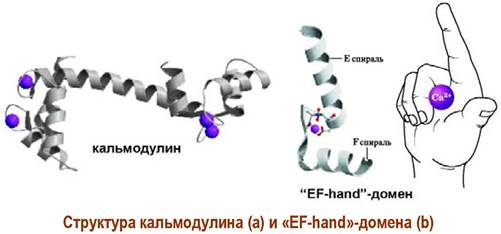
Ионы Са2+ внутри клетки обычно транспортируются специальным белком кальмодулином. Этот глобулярный белок содержит большое количество остатков глутаминовой и аспарагиновой кислот, образующих 4 участка связывания ионов кальция. Каждый такой домен представляет собой сочетание петли и двух взаимно перпендикулярных α-спиралей. Подобные доменные участки в англоязычной литературе называют «EF-hand». Они обнаружены более чем в 100 кальцийсодержащих белках.
Рецепторы, связанные с тирозинкиназой.
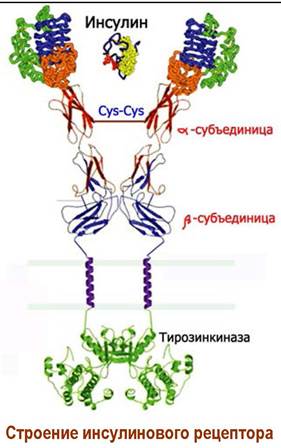
К этому типу относятся рецепторы IRА и IRВ на белковые молекулы инсулина и рецепторы IGF1R и IGF2R на инсулин-подобные факторы роста. В передаче биологического сигнала участвует фермент тирозинкиназа.
Инсулиновый рецептор представляет собой тетрамер, состоящий из двух α-субъединиц массой по 135 кДа и двух β-субъединиц с массой 95 кДа, связанных дисульфидными связями. На внешней стороне мембраны находится димер α-субъединиц, имеющих по два цистеинсодержащих участка связывания гормона.
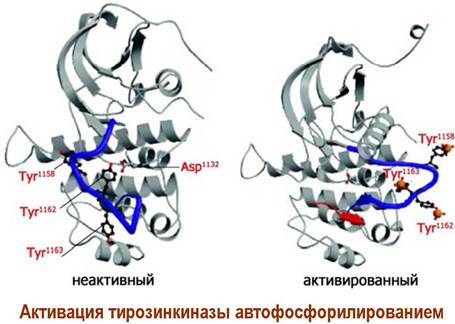
β-Субъединица состоит из трех доменов: внешнеклеточного, мембранного и внутриклеточного домена, включающего участок фермента тирозинкиназы. При действии лиганда (инсулина) происходит активация этого фермента путем автофосфорилирования за счет АТР, после чего тирозинкиназа приобретает способность фосфорилировать внутриклеточные протеины.
Вначале тирозинкиназа активирует внутриклеточный переносчик сигнала - белок IRS-1 (инсулин-рецепторный субстрат) путем фосфорилирования его тирозиновых остатков. Тирозин-фосфатные группы IRS-1 выступают в качестве лиганда для белка Grb-2, который через другой рецепторный участок способен связываться с фрагментом протеина Sos, содержащего большое количество остатков пролина.
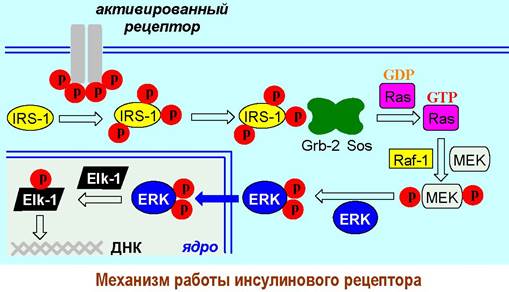
Образованный комплекс Grb-2+Sos индуцирует превращение GDP —> GTP в G-подобном белке Ras, который в свою очередь активирует протеинкиназу Raf-1. Этот фермент далее фосфорилирует остатки серина в митоген- активирующей внутриклеточной киназе (МЕК), после чего она способна катализировать введение фосфатных групп по остаткам тирозина и треонина еще одного фермента - внутриклеточной регуляторной киназы (ERK).
Активированная киназа ERK проникает в ядро клетки и фосфорилирует фактор транскрипции Elk-1, после чего он способен индуцировать процесс транскрипции более 100 инсулин-регулируемых генов. В конечном результате в клетке синтезируются специфические белки.
Внутриклеточные рецепторы
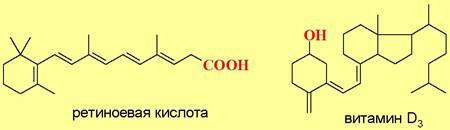
К настоящему времени обнаружено более 50 внутриклеточных рецепторов, обладающих схожим механизмом действия. В качестве лигандов к этим рецепторам выступают стероиды (половые и кортикостероидные гормоны), тиреоидные гормоны, ретиноевая кислота - продукт окисления ретинола, витамин D3 и другие соединения.
Взаимодействие этих соединений с рецептором индуцирует транскрипцию ДНК и в конечном итоге приводит к синтезу определенных белков.
❖ Рецепторы на стероидные гормоны. В качестве примера рассмотрим строение рецептора на стероидные гормоны. Такие рецепторы весьма распространены - в клетке находится от 1000 до 10 000 стероидных рецепторов.
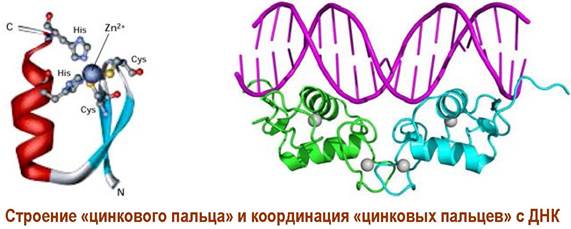
В структуре рецептора выделяют 4 домена. N-концевой участок цепи отвечает за активацию транскрипции. Далее идет домен, содержащий координированные за счет остатков цистеина ионы цинка, посредством которых происходит связывание с молекулой ДНК (так называемые «цинковые пальцы»).
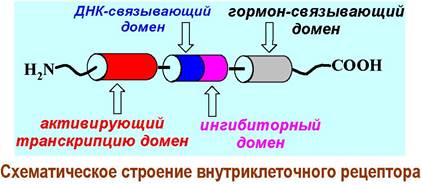
Рядом расположенный домен выполняет ингибиторную функцию - препятствует координации рецептора с ДНК. Ближе к С-концу расположен домен с сайтами связывания лиганда.
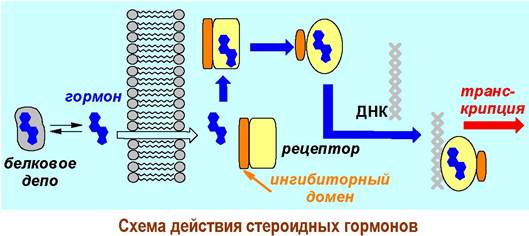
Стероидные гормоны транспортируются обычно в виде комплекса с белками. При сближении с мембраной стероид покидает «белковое депо» и проходит через липидную мембрану клетки.
Аллостерическое связывание стероидного гормона изменяет конформацию рецептора - ингибиторный домен перестает блокировать возможность взаимодействия с нуклеиновой кислотой. ДНК-связывающий домен переходит в активную конформацию, происходит координация рецептора с нуклеиновой кислотой и посредством активирующего домена инициируется процесс транскрипции.
❖ Гуанилатциклаза. Ферменты, обеспечивающие синтез сGМР на основе GТР, найдены как в связанном с мембраной виде, так и в растворимой внутриклеточной форме. Последнюю можно рассматривать в качестве внутриклеточного рецептора. Известно, что данный фермент относится к хромопротеинам и содержит гем в качестве простетической группы.
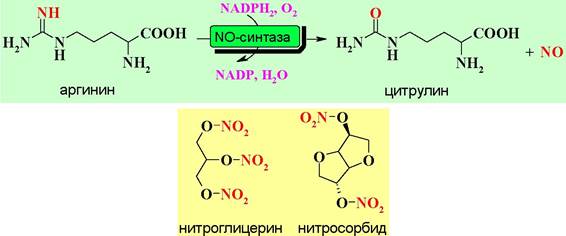
Молекулой, активирующей гуанилатциклазу, является NO. Оксид азота(II) регулирует ряд физиологических процессов, в том числе, расслабление кровеносных сосудов (вазорелаксация), торможение агрегации тромбоцитов, протекание иммунных реакций, работу нервной системы.
Основные пути образования эндогенного оксида азота(II) - биохимическое окислении аргигина или восстановление нитроэфирных лекарственных средств типа нитроглицерина или нитросорбида.
Значительная часть вышерассмотренных биологических эффектов NO связана с увеличением в клетках концентрации сGМР в результате стимуляции работы гуанилатциклазы. Индукция продукции сGМР приводит к фосфорилированию специфических серин- и треонинсодержащих ферментов и дальнейшей передаче биологического сигнала.
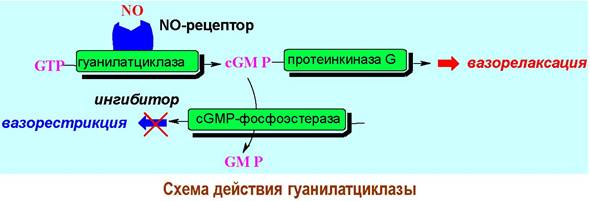
Контроль за концентрацией сGМР осуществляется с помощью сGМР-фосфоэстераз, гидролизующих циклофосфат до GМР. Применение ингибиторов этих ферментов приводит к увеличению концентрации сGМР и, следовательно, к расширению кровеносных сосудов. Таким ингибирующим действием, в частности, обладает виагра.
Лектины
Специфическое узнавание ряда углеводных структур в природе осуществляют специальные белки - лектины. Такое углевод-белковое связывание реализуется в растительных и животных клетках, бактериях, а также и при взаимодействии вирусов с клетками. Лектины могут выполнять функции межклеточного узнавания, адгезии, идентификации сигнальных молекул.
Например, утилизация ряда гликозилированных пептидных гомонов (лютеинизирующий гормон, тироторопин) осуществляется клетками печени. При этом захват гормонов происходит за счет связывания лектинами гепатоцитов с концевым дисахаридным фрагментом GalNAc4-SO3H (βI —> 4) GlcNAc.
Таблица 5. Специфичность ряда лектинов
Источник |
Лектин |
Обозначение |
Лиганд |
Растения |
Конканавалин А Рицин |
СоnА |
α-D-Man Gal(β1 —> 4)Glc |
Животные |
Галектин 1 |
Gal(β1 —> 4)Glc |
|
Бактерии |
Энтеротоксин Токсин холеры |
LT СТ |
Gal ганглиозид GM1 |
Вирусы |
Гемагглютинин вируса гриппа Протеин 1 вируса полиомы |
НА VP1 |
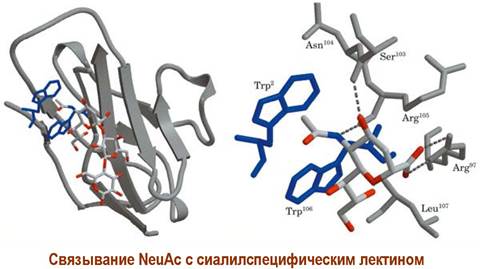
NeuAc (α2 —> 6) Gal (β1 —> 4 (=) Glс NeuAc (α2 —> 3) Gal (β1 —> 4) Glс |
Важную сигнальную функцию в гликопротеинах выполняет находящаяся на невосстанавливающих концах олигосахаридов сиаловая (нейраминовая) кислота. Она «защищает» такие вновь синтезированные молекулы от расщепления в печени.
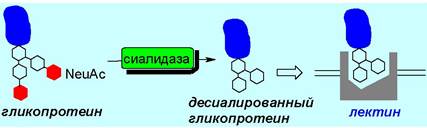
Со временем под действием сиалидаз (нейраминидаз) происходит удаление сиаловой кислоты, и оставшиеся углеводные фрагменты гликопротеинов связываются с лектинами.
Гемагглютинин вируса гриппа играет роль лектина, связываясь с олигосахаридными фрагментами NeuАс (α2 —> 6) Gаl (β1 —> 4) Glс на поверхности клеток животного, что в дальнейшем обеспечивает проникновение вируса внутрь клетки. В настоящее время разрабатывается ряд лекарственных противогриппозных средств, ингибирующих гемагглютинины.
Для бактерии кишечной палочки E. coli находящиеся на внешней мембране лектины, способные связываться с остатками маннозы, играют роль «якоря». Связывание этих лектинов с муцинами эпителия обеспечивает закрепление бактерий на поверхности кишечника.
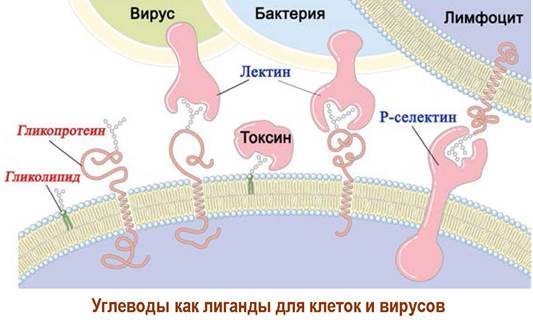
Выделяют группу селектинов - лектинов плазматических мембран, участвующих в межклеточном узнавании и процессах адгезии клеток. Они, в частности, обеспечивают движение иммунных клеток через капилляры к тканям, пораженным инфекцией или воспалением.