СТРУКТУРА И СВОЙСТВА БИОМОЛЕКУЛ - А. Е. Земляков - 2017
05. КЛЕТОЧНЫЕ И МОЛЕКУЛЯРНЫЕ ОСНОВЫ ИММУННОЙ СИСТЕМЫ
❖ Иммунитет - врожденная, наследуемая способность организма распознавать и обезвреживать чужеродный материал, поступивший извне или образовавшийся в результате патологий.
Различают две основные системы иммунитета, которые в организме взаимосвязаны.
♦ Клеточный иммунитет - система клеток, обладающих фагоцитарной активностью. К ним относятся макрофаги, нейрофильные гранулоциты и др.
♦ Гуморальный иммунитет - выработка в организме специфических веществ (антител) против чужеродного объекта (антигена).
Основы современной теории иммунитета были заложены русским биологом И. Мечниковым, открывшим фагоцитарное действие иммунных клеток, и немецким исследователем П. Эрлихом, который открыл дифференциацию лимфоцитов, роль костного мозга в иммунной системе, предложил рецепторную теорию иммунного действия. В 1908 г. оба ученых за эти исследования получили Нобелевскую премию по физиологии и медицине.

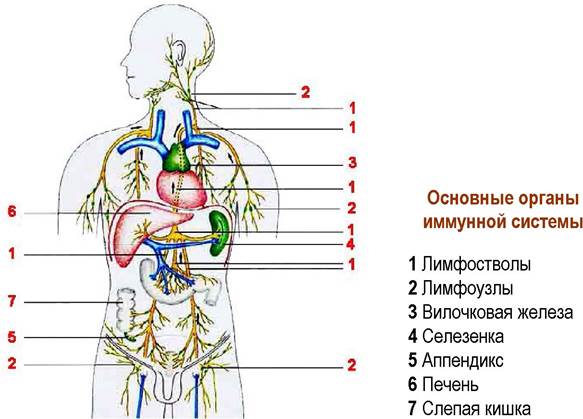
В работе иммунной системы человека задействованы самые разные органы, в том числе, костный мозг, лимфоузлы, селезенка, тимус (вилочковая железа), миндалины.
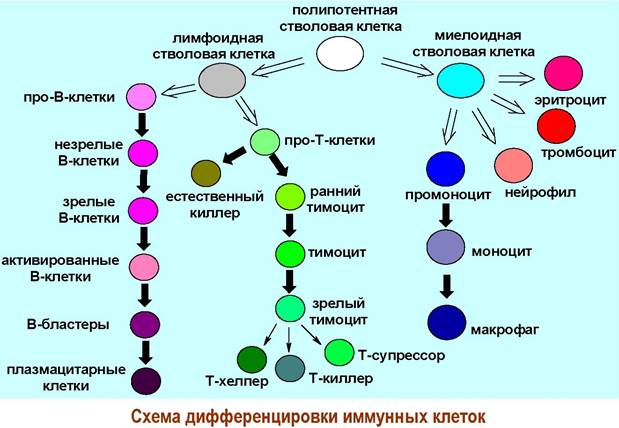
В тканях, кровеносной и лимфатической системе организма выявлено большое количество клеток, участвующих в работе иммунной системы. К основным иммунным клеткам относят макрофаги, лимфоциты, естественные киллеры.
❖ Макрофаги. Диаметр клеток - 10-20 мкм, они содержат большое количество лизосом, в которых происходит ферментативное расщепление. Происходят из общего для многих клеток предшественника - стволовых клеток, которые последовательно переходят в промоноцит, циркулирующий моноцит и тканевый макрофаг.
Макрофаги участвуют как в опознании клеток, так и обеспечивают захват чужеродных клеток или других антигенов посредством многочисленных псевдоподий с последующим пиноцитозом - поглощением и расщеплением с помощью лизосомных ферментов.
Наряду с фагоцитарными функциями макрофаг осуществляет распознавание антигенов, активирует лимфоциты, продуцирует монокины: интерлейкин-1, фактор некроза опухолей, синтезирует интерферон (см. далее), лизоцим, белковые компоненты системы комплемента (см. далее).
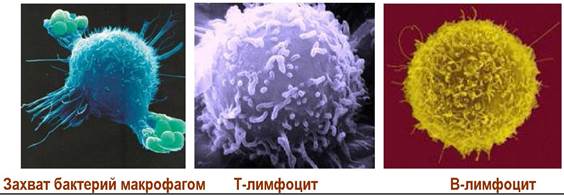
❖ Лимфоциты. Образуются из стволовых клеток костного мозга. Различают две главные популяции: Т-клетки, созревание и дифференцировка которых проходит в тимусе, и В-клетки, которые предположительно дифференцируются в костном мозге.
✵ Т-лимфоциты. Диаметр ~4,5 мкм, поверхность относительно гладкая, содержит ряд специфических рецепторов. Не имеют эндоплазматической сети. Основные субпопуляции:
♦ Т-хелперы - участвуют в активации В-клеток;
♦ Т-супрессоры - отвечают за завершение иммунного ответа;
♦ Т-дифференцирующие клетки - направляют дифференцировку стволовых клеток;
♦ Т-киллеры - цитотоксические клетки;
♦ Т-амплиферы - содействуют развитию иммунного процесса;
♦ Т-клетки памяти - сохраняют информацию об антигене, облегчают вторичный иммунный ответ.
✵ В-лимфоциты. Диаметр ~5,8 мкм, поверхность ворсинистая, содержит множество рецепторов иммуноглобулиновой природы. Эндоплазматическая сеть с полирибосомами. Основные субпопуляции:
♦ В1-клетки-предшественники, способны синтезировать антитела без активации Т-хелперами;
♦ В2-плазмацитарные клетки, осуществляют синтез антител;
♦ В3-(В-киллеры) - цитотоксические клетки;
♦ В-супрессоры - участвуют в остановке иммунного ответа;
♦ В-клетки памяти - сохраняют информацию об антигене, облегчают вторичный иммунный ответ.
❖ Ключевые положения развития иммунной реакции.
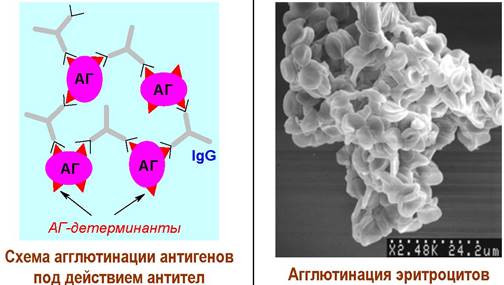
Иммунная реакция начинается с попадания в организм антигена (АГ) - любого объекта (молекула, комплекс, вирус, клетка), вызывающего иммунный ответ. Антиген захватывается рецепторами макрофага (А), втягивается во внутрь клетки и подвергается расщеплению (пиноцитоз). С поверхности антигена вырезаются определенные структуры (антигенные детерминанты), которые выносятся на поверхность макрофага в виде комплекса с антигенами гистосовместимости II класса (АГС II) - специальными белками, обеспечивающими передачу информации об антигене.
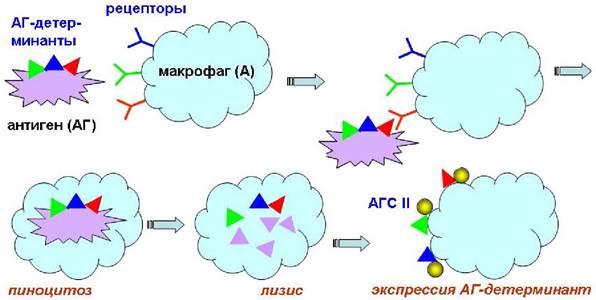
Такой активированный макрофаг активирует Т-хелперы, передавая информацию об антигенах на рецепторы лифоцитов. Параллельно стимулируют Т-киллеры, способные самостоятельно уничтожать антигены. Активированные Т-хелперы взаимодействуют со специфическими рецепторами В-клеток. Именно на этом этапе происходит «опознание» антигенов. Считается, что популяции В-клеток способны распознать ~106-109 антигенов. В-клетки превращаются в плазмацитарные клетки. Последние секретируют специфические антитела (Ig), способные соединяться с антигеном в комплексы (агглютинация - слипание). Если в качестве антигенов выступают бактерии, то возможно разрушение их липидных мембран. При недостаточной концентрации антител меченые ими клетки антигена разрушаются комплементом. После уничтожения антигена Т-супрессоры переводят иммунную систему в стационарное состояние.
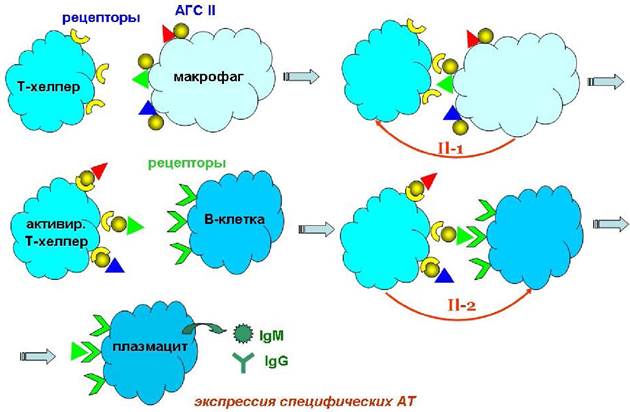
На всех этапах, требующих межклеточных взаимодействий, важную роль играют медиаторы (посредники) иммунных реакций: монокины - белки, выделяемые макрофагами, и лимфокины - белки, продуцируемые лимфоцитами. Например, активированные макрофаги выделяют интерлейкин-1 (IL-1, см. далее), стимулирующий Т-хелперы. Последние, в свою очередь, выделяют интерлейкин-2 (IL-2), необходимый для активации В-клеток.
❖ Система комплемента. В крови содержится 11 белков с молекулярными массами от 75 до 400 кДа, образующих 9 комплексов, способных каскадно присоединяться к чужеродным клеткам, меченым антителами. Комплемент «просверливает» мембрану, что приводит к лизису клетки.
Процесс начинается с присоединения к константной части иммуноглобулина комплекса «антиген-антитело» белка С1, состоящего из 3 субъединиц. После присоединения блок С1 приобретает способность ферментативно расщепить белок С4 на две части С4а и С4b. Первая из них деградирует, а вторая дает комплекс с С1.
Далее происходит последовательное присоединение белков С2а и С3b, каждый из них отщепляется от более крупных белков С2 и С3. Образованный ассоциат с одной стороны взаимодействует с мембраной антигена и активирует бактериальный фагоцитоз, а с другой стороны обладает протеазной активностью.
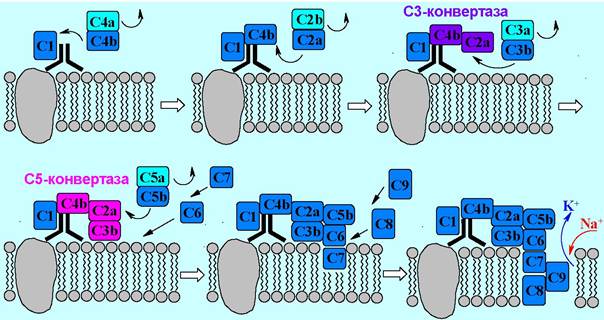
Расщепление белка С5 и присоединение фрагмента С5b облегчает внедрение в липидную мембрану компонентов С6 и С7. Дальнейшая ассоциация с белком С8 запускает процесс лизиса, а присоединение компонента С9 его существенно ускоряет. В мембране образуются поры, нарушается ионный состав цитоплазмы, клетка набухает и разрывается.
❖ Антитела - класс белков, продуцируемых В-клетками и осуществляющих связывание антигенов. Антитела, называемые иначе иммуноглобулинами (Ig), составляют более 20% от общего веса белков плазмы. Иммунная система животных способна синтезировать до 108 молекул антител различной специфичности, что обеспечивает взаимодействие с основными антигенами.
В основе строения иммуноглобулинов лежит комплекс из двух пар полипептидных цепей - легких (L) и тяжелых (Н). Существует два типа легких цепей (λ и χ) и пять видов тяжелых цепей (y, α, μ, δ и ε). Природа тяжелых цепей определяет класс иммуноглобулинов. У позвоночных существует 5 классов антител:
♦ IgG (состав χ2у2 или λ2у2; молекулярная масса ~140-170 кДа) - основной класс антител - до 75% от общего количества антител, их концентрация в сыворотке крови 6-16 г/л;
♦ IgM (молекулярная масса ~800-950 кДа) - продуцируются в начале иммунного ответа, их содержание - 5-10% от общего количества иммуноглобулинов, их концентрация в сыворотке крови 0,5-1,8 г/л, структура реализуется в виде пентамера (χ2μ2)5 или (λ2μ2)5;
♦ IgA (молекулярная масса от 160 до500 кДа) - составляют основу антител в секретах (молоко, слизи, слезы), его содержание во фракции иммуноглобулинов - 7-15%, а концентрация в сыворотке крови 1-5 г/л; может существовать в виде мономера χ2α2 или λ2α2, димера (две субъединицы соединены дополнительной J-цепью и секреторным компонентом гликопротеиновой природы) или тримера;
♦ IgD (состав χ2δ2 или λ2δ2, молекулярная масса ~180 кДа) и IgE (состав χ2ε2 или λ2ε2, молекулярная масса ~190 кДа) - минорные компоненты сыворотки крови, их содержание, соответственно, 0,3 и 0,03% от общего количества антител; выполняют функции рецепторов В-клеток (IgD) отвечают за развитие аллергических реакций (IgE).
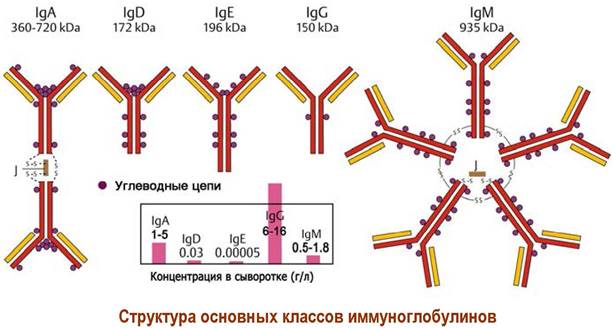
Белковые цепи иммуноглобулинов содержат углеводные цепи, присоединенные N-гликозидной связью. Для каждого класса этих гликопротеинов характерно наличие определенного количества моносахаридных остатков, например, у IgG - 22 моносахарида в 2 углеводных цепях, а у IgM - 82 в 10 олигосахаридных цепях.
❖ Строение IgG. Молекула состоит из четырех полипептидных структур: двух легких цепей, включающих приблизительно по 220 а. о., и двух тяжелых цепей, содержащих около 450 а. о. Тяжелые цепи содержат по одному олигосахаридному фрагменту. Белковые цепи, соединяясь дисульфидными мостиками, а также за счет невалентных взаимодействий, образуют Y- образную структуру.
Белковые цепи имеют доменное строение. Компактные структурированные участки (домены) по ~110 аминокислотных остатков соединены неструктурированной пептидной цепью, что обеспечивает молекуле повышенную гибкость и облегчает подстраивание к антигену (особенно, в так называемом, шарнирном участке).
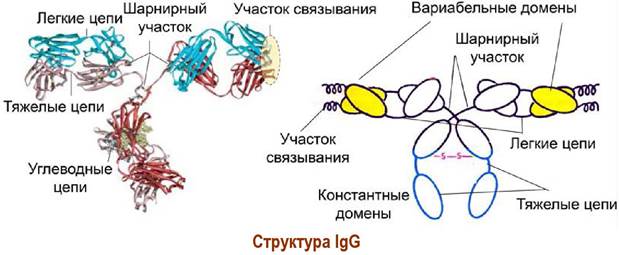
В цепях различают вариабельную часть - индивидуальную у каждого антитела и обеспечивающую высокоспецифичное связывание с конкретным антигеном, а также константную область, общую для всего класса иммуноглобулинов и отвечающую за общие свойства, например, за способность присоединять комплемент или фиксироваться на мембранах.
Благодаря наличию двух антигенсвязывающих центров антитела способны «сшивать» антигены в агрегаты. Слипание антигенов под действием антител называют агглютинацией.
❖ Строение IgM. Макромолекула этого иммуноглобулина имеет структуру пентамера в сыворотке и мономера в качестве рецептора на поверхности зрелых В-клеток. Каждая субъединица пентамера соединяется дисульфидными связями в области константных цепей между собой и с дополнительной пептидной цепью J. По сравнению с IgG в константной части пептидных цепей присутствует дополнительный домен. Упрощенно пространственную структуру можно представить в виде кольца, имеющего 10 участков связывания с антигеном.
❖ Медиаторы иммунного ответа.
✵ Интерфероны - противовирусные вещества универсального действия. Выделяются рядом клеток, в т. ч. в ответ на вирусную инфекцию. Представляют собой небольшие белки или гликопротеины с массой 15-25 кДа. В зависимости от клеток-продуцентов подразделяют лейкоцитарные (α- интерфероны), фибробластные (β-интерфероны) и иммунные (н-интерферон). α-Интерферон является белком, а два других типа интерферонов - гликопротеины.

Интерфероны (IF) - гормоноподобные соединения. Их взаимодействие с клеточными рецепторами клеток, пораженных вирусом, вызывает активацию олигоадениласинтазы (ОАС). Синтезируемый с ее помощью олиго (2’ —> 5’) аденилат (2-5А) активирует протеинкиназу-R (РК-R). Фосфорилирование ей инициаторного фактора eIF2 переводит его в неактивное состояние, чем блокируется биосинтез белков, в т. ч. вирусных. С другой стороны, олигоаденилат активирует рибонуклеазу-L (RN-L), которая расщепляет как матричные, так и вирусные РНК. Тем самым наряду с уничтожением компонентов вируса также ингибируется синтез белков. Кроме того, «осколки» РНК активируют продукцию β-интерферона, который выделяясь из клетки развивает антивирусное действие. Таким образом инфицированная клеткам погибает вместе с попавшим в нее вирусом.
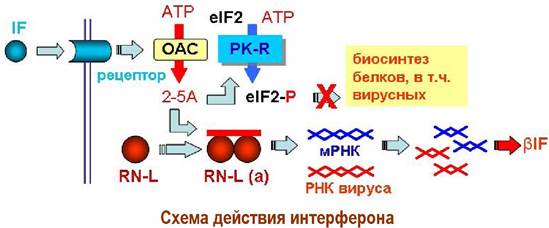
Кроме того, интерфероны активируют клетки иммунной системы. Например, активированные Т-киллеры и естественные киллеры способны уничтожать зараженные вирусом клетки. Активированные интерфероном макрофаги через индукцию Т-хелперов стимулируют иммунный ответ на вирусные детерминанты.
В настоящее время генно-инженерный интерферон (рекомбинантный интерферон) является одним из эффективных препаратов современной медицины.
✵ Интерлейкины - факторы полипептидной природы, синтезируемые клетками иммунной системы и воздействующие на иммунокомпетентные клетки. К настоящему времени установлено почти четыре десятка интерлейкинных белков. К наиболее изученным относятся интерлейкины-1, 2, 4, 6.
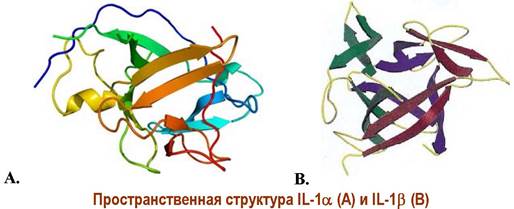
♦ Интерлейкин-1(IL-1) существует в двух формах - IL-1α и IL-1β. Это соединения белковой природы, состоящие из 159 и 153 а. о. и молекулярной массой 18 и 17,4 кДа соответственно.
Главными продуцентами IL-1 являются макрофаги. Наиболее сильными индукторами (веществами, усиливающими продукцию) IL-1 являются липополисахарид (LPS) и MDP (см. ниже). В целом IL-1 усиливает функции Т- и В-лимфоцитов, в том числе активирует продукцию IL-2, IL-6, IL-12, y-интерферона, воздействует на мозг, в частности повышает температуру (пирогенный эффект) и активирует медленноволновую фазу сна.
♦ Интерлейкин-2(IL-2) состоит из 133 а. о., имеет внутримолекулярный дисульфидный мостик, гликозилирован по Thr-3. Его молекулярная масса - 15,4 кДа. Основным продуцентом IL-2 являются Т-хелперы, в меньшей степени Т-киллеры. В качестве индукторов продукции IL-2 выступают IL-1, интерферон, MDP. IL-2 является ключевым соединением в развитии иммунного процесса, в том числе он стимулирует Т- и В-клетки.
✵ Фактор некроза опухоли (tumor necrosis factor, TNF). Под этим понятием объединяют семейство цитокинов, включающих 19 различных белков. Различают мембранную форму с молекулярной массой 26 кДа, которая в дальнейшем превращается в секретируемую форму с молекулярной массой 17 кДа. Название этого цитокина связано со способностью активированных им Т-киллеров поражать ряд опухолевых клеток.
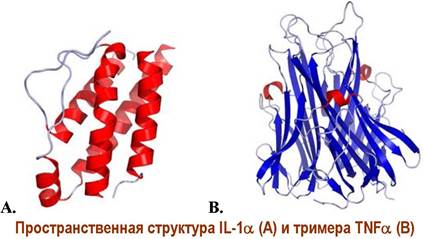
К настоящему времени установлено, что триммер TNF, действуя на специфические рецепторы TNF-R1 и TNF-R2, участвует в активации иммунной системы, препятствует развитию опухолевых клеток и вирусной репликации.
❖ Циклоспорин А. Циклопептид, состоящий из 11 а. о., из которых значительная часть Ж-метилирована: саркозин (Sar), MeVal, MeLeu. Продуцируется рядом мицелиальных грибов.
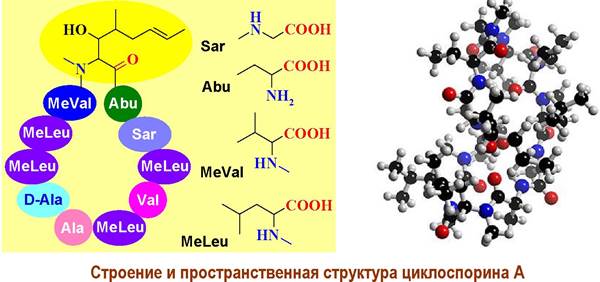
Циклоспорин А применяется в медицинской практике в качестве иммунодепресанта, препятствуя отторжению пересаженных тканей и органов, а также лечения ряда аутоиммунных заболеваний.
В основе механизма биологического действия лежит супрессия Т- хелперов за счет подавления продукции синтеза ряда лимфокинов, например, IL-2 - иначе фактора роста Т-клеток.
❖ Иммуномодуляторы гликопептидной природы. Более 50 лет назад было показано, что адъювант Фрейнда - водно-масляная эмульсия, содержащая убитые клетки микобактерий туберкулеза в органической фазе и антиген в водной фазе, многократно увеличивает иммунный ответ как в тестах гуморального, так и клеточного иммунитета.
Адъювант - соединение, усиливающее иммунный ответ при совместном введении с антигеном.
Минимальной активной структурой в адъюванте Фрейнда является гликопептид мурамоил- дипептид (MDP) - продукт расщепления пептидогликана лизоцимом. Структурно молекула MDP состоит из остатка углевода N-ацетилмурамовой кислоты и дипептида L- аланил-D-изоглутамина.
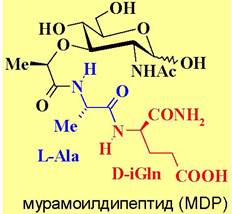
Мурамоилдипептид активирует иммунные клетки, стимулирует защитный эффект против
бактериальных и вирусных инфекций, а в присутствии синергетиков - димиколата трегалозы (TDM), липополисахарида (LPS) или липида А, и противоопухолевый иммунитет.
На основе продуктов расщепления муреина был также получен высокоактивный дисахариддипептид GMDP, внедренный в медицинскую практику в качестве лекарственного препарата «ликопид» (Россия) для лечения вторичных иммунодефицитных состояний.
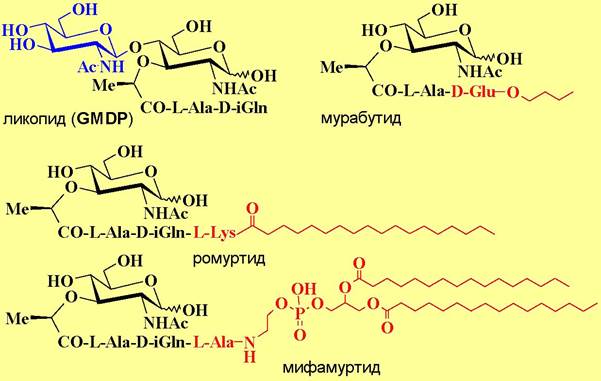
С целью изучения взаимосвязи между биологической активностью и строением было синтезировано около тысячи производных MDP. Некоторые из них используются в медицине. Например, MDP-L-Lys-COCi17H35 («ромуртид», Япония) рекомендован для восстановления числа лейкоцитов у больных после радио- и химиотерапии опухолей, бутиловый эфир N-ацетилмурамоил- L-аланил-D-глутамина («мурабутид», Франция) используется в качестве адъюванта для вакцин, а фосфоэтаноламид MDP-L-Ala («мифамуртид», Швейцария) эффективен при терапии остеосаркомы.
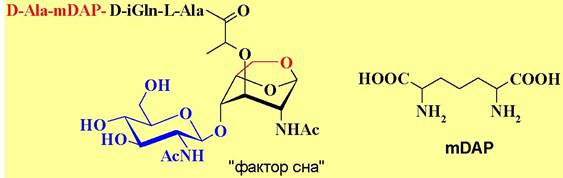
Гликопептиды группы MDP проявляют и нейропептидные свойства. Они повышают температуру (пирогенный эффект), влияют на кровяное давление и индуцируют глубокий сон. Структурно близок к GMDP и выделенный из организма человека «фактор сна» - вещество, стимулирующее фазу медленно-волнового сна. Особенностью его структуры является наличие мурамовой кислоты в виде 1,6-ангидросахара и присутствие в тетрапептидном фрагменте диаминодикарбоновай кислоты - мезодиаминопимелиновой (mDAP).
Достаточно убедительной является гипотеза французского ученого Эдгара Ледерера, что MDP может выполнять в организме роль витамина. Необходимое для регуляции иммунной системы количество мурамоилдипептида может образовываться в организме за счет расщепления клеточных стенок бактерий.
Контрольные задания.
Тест 1 (вариант)
1. Первичная структура белка формируется с помощью:
А. пептидных связей; Б. дисульфидных связей; В. водородных связей; Г. ионных взаимодействий; Д. гидрофильно-гидрофобных взаимодействий.
2. Нарисуйте формулу L-изолейцина в проекции Фишера.
Эта аминокислота относится к следующим классам аминокислот: А. нейтральным; Б. кислым; В. основным; Г. ароматическим; Д. алифатическим; Е. гетероциклическим; Ж. гидрофильным; З. гидрофобным; И. заменимым; К. незаменимым.
3. Определите конфигурацию данных аминокислот по D, L-номенклатуре, назовите их.

4. Назовите дипептид.
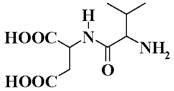
Тест 2 (вариант)
1. Выберите понятия, соответствующие следующим определениям:
I. «белки или белковые комплексы, являющиеся специфическими и высокоэффективными катализаторами химических реакций, протекающих в живой клетке»;
II. «яд биологического происхождения».
А. адъювант; Б. антиген; В. антитело; Г. иммунитет; Д. иммуностимулятор; Е. кофермент; Ж. лектин; З. селектин; И. рецептор; К. токсин; Л. фагоцитоз; М. энзим.
2. Активация метаботропных рецепторов с GS-белками приводит к:
I. высвобождению ДНК-связывающего домена; II. активации аденилатциклазы; III. активации фосфодиэстеразы; IV. активации фосфолипазы С; V. активации тирозинкиназы.
A. увеличению концентрации сАМР; Б. уменьшению концентрации сАМР; B. увеличению концентрации сGМР; Г. уменьшению концентрации сGМР; Д. увеличению концентрации Са2+; Е. уменьшению концентрации Са2+; Ж. инициации транскрипции; З. ингибированию транскрипции.
3. Составьте смысловые пары:
А. гемоглобин; Б. химотрипсин; В. трипсин; Г. миоглобин; Д. лизоцим
I. фермент, гидролизующий белки и пептиды по ароматическим аминокислотам; II. фермент, гидролизующий белки и пептиды по основным аминокислотам; III. фермент, гидролизующий полисахарид клеточных стенок бактерий; IV. дыхательный фермент, состоящий из одной полипептидной цепи; V. дыхательный фермент, состоящий из четырех полипептидных цепей.
4. Изомеразы катализируют реакции:
A. окислительно-восстановительные; Б. переноса функциональных групп; B. гидролиза; Г. присоединение по двойной связи; Д. изомеризации; Е. синтеза за счет энергии АТР.
5. Расставьте номера названий веществ и процессов в соответствии с позициями в схеме работы рецепторов стероидных гормонов.
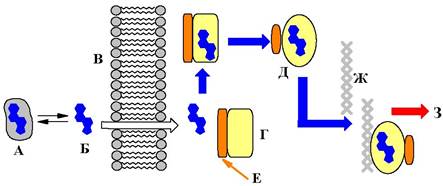
1. гормон; 2. ингибиторная субъединица; 3. ДНК; 4. белковое депо гормона; 5. липидная мембрана; 6. транскрипция; 7. активированный рецептор; 8. рецептор.
6. Выберите название представленного соединения.
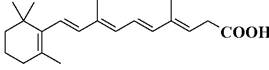
1. мурамоилдипептид; 2. мурабутид; 3. нитроглицерин; 4. нитросорбид; 5. ретинол; 6. аII-транс-ретиналь; 7. 11-цис-ретиналь; 8. ретиноевая кислота; 9. витамин D3.