БІОНЕОРГАНІЧНА ТА БІООРГАНІЧНА ХІМІЯ - М.В. Яцков - 2014
І. ПРЕДМЕТ, ЗАВДАННЯ, МЕТОДИ ТА ОСНОВНІ НАПРЯМКИ ДОСЛІДЖЕНЬ БІОНЕОРГАНІЧНОЇ ХІМІЇ
1.4. Промислові мінеральні добрива, які утворюють комплексні сполуки з мікроелементами
1.4.3. Мікродобрива на основі комплексонів
Комплексні сполуки - металів-мікроелементів з синтетичними комплексонами - хелати, комплексонати - в останній час отримали широке розповсюдження як високоефективні добрива. Відмінною особливістю таких добрив є їх добра розчинність у воді, стійкість в широкому інтервалі значень pH, висока стійкість проти мікробіологічного руйнування. Хелати металів-мікроелементів лише частково сорбуються грунтом, що дозволяє їм довгий час переміщуватися в грунтовому розчині. Важливим є також той факт, що хелати добре поєднуються з мікродобривами, хімічними меліорантами, пестицидами.
Починаючи з 1953 р. в нашій країні почали розвиватися дослідження, які направлені на створення широкого асортименту комплексонів і використання їх в агрохімічній практиці. Спочатку це були поліамінополіацетатні кислоти або їх солі, які містять аміноацетатні групування. З цієї групи комплексонів простішими є амінодиацетатна кислота (АДА), нітрилтриацетатна кислоти (НТА), етилендиамін-тетраацетатна кислота (ЕДТА):
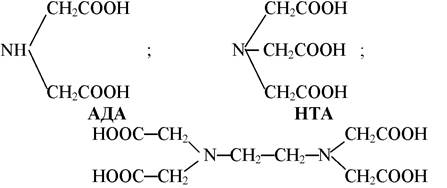
ЕДТА
Перші агрохімічні випробування вказаних хелатів показали їх високу агрохімічну активність, однак лише на помірно кислих грунтах.
Приклад. pH ґрунтового розчину дорівнює 9. В грунт внесений хелат феруму (ІІІ) з ЕДТА з концентрацією 0,1 моль/л. Необхідно визначити, у вигляді якої сполуки в цих умовах буде знаходитись ферум - комплексу чи гідроксиду.
З виразу добутку розчинності знаходимо рівноважну концентрацію йонів феруму(ІІІ) для даного значення рН:
![]()
Концентрація гідроксид-йонів в розчині при pH = 9 буде дорівнювати 10-5 моль/л. Підставивши відомі значення в цей вираз, розраховуємо рівноважну концентрацію [Fe3+].
![]()
![]()
Знаходимо рівноважну концентрацію йонів феруму, виходячи зі значення константи стійкості хелату:
![]()
![]()
Враховуючи, що [Fe3+] = [ЕДТА4-] = х, підставивши всі відомі величини в останній вираз, знайдемо рівноважну концентрацію [Fe3+]
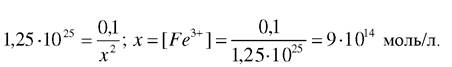
Порівнюючи отримані дані видно, що рівноважна концентрація йонів феруму, яка відповідає ДРFе(ОН )3, менша, ніж відповідна концентрація йонів феруму (III), яка відповідає константі стійкості комплексного йону. Тому комплекс повинен руйнуватися і Ферум буде знаходитися у вигляді Fe(OH)3.
Приведений розрахунок є наближеним, оскільки, з однієї сторони, в реальних умовах комплекс в більшості випадків знаходиться в надлишку ліганду, з другої - при внесенні у грунт концентрації хелату і ліганду постійно зменшуються. При цьому концентрація хелату зменшується переважно за рахунок розведення, а концентрація ліганду - внаслідок розведення і взаємодії з іншими катіонами грунтів.
В процесі розведення грунтовим розчином хелат Феруму поступово піддається гідролізу, утворюючи проміжні гідроксокомплекси, які в подальшому при повному гідролізі дають Fe(OH)3.
В даний час агрохімічна практика нараховує більше 10 комплексонів, які застосовуються для захисту металів- мікроелементів від ґрунтової фіксації.
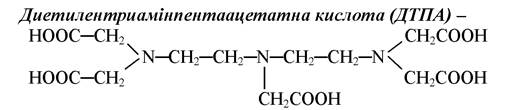
являє собою п’ятиосновну кислоту, молекула якої містить три атома Нітрогену, які здатні утворювати координаційні зв’язки. Таким чином, ДТПА потенційно є восьмидентатним лігандом; здатна утворювати комплекси
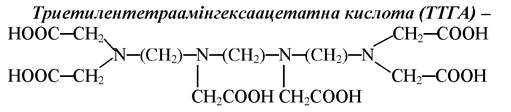
шестиосновна кислота, але з врахуванням донорних властивостей атомів Нітрогену потенційно є десятидентатним лігандом. Для того, щоб всі десять атомів приймали участь у комплексоутворенні, середовище повинно бути достатньо лужним, оскільки через велику кількість кислотних груп спорідненість до протона у цієї сполуки достатньо велика. Здатна утворювати різного ступеня протоновані комплекси
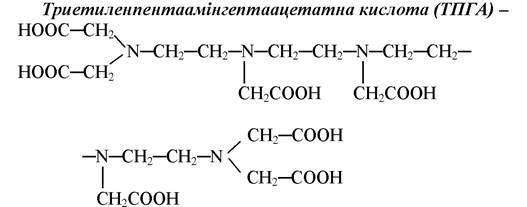
семиосновна кислота, формально дванадцятидентатний ліганд. Однак максимальне число координаційних зв’язків ТПГА практично не утворює внаслідок великих розмірів молекул і виникаючими у зв’язку з цим просторовими труднощами.
ТПГА є представником гомологічної серії комплексонів з загальною формулою:
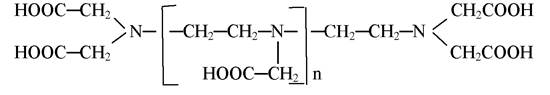
при n = 0-ЕДТА; n = 1-ЕДТА; n = 2-ЕДТА; n = 3-ЕДТА.
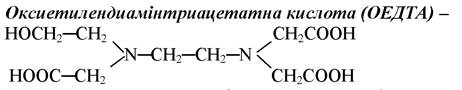
трьохосновна кислота, п’ятидентатний ліганд, оскільки гідроксиетильна група не здатна до депротонування. Цей комплексон утворює комплексони, як правило, менш стійки, ніж ЕДТА, однак проявляє вибірковість до йонів феруму(ІІІ).
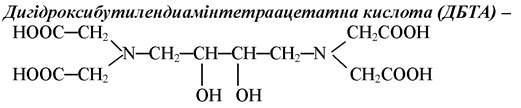
чотириосновна кислота, шестидентатний ліганд. В утворенні комплексів гідроксильні групи, як правило, участі не приймають, тому стійкість комплексів металів з ДБТА практично не відрізняється від стійкості комплексів з бутилендиамінтетра- ацетатної кислоти. Однак по відношенню до кальцію ДБТА проявляє деяку селективність.
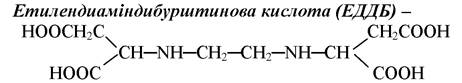
чотириосновна кислота, шестидентатний ліганд, є аналогом ЕДТА. Однак стійкість комплексів біометалів з ЕДДБ в порівнянні з етилендиамінтетраацетатними дещо нижча.
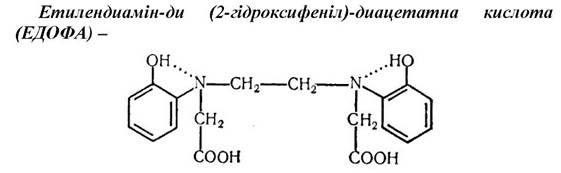
двохосновна, шестидентатний ліганд. Утворює два ряди комплексонів MeH2L, в яких фенольні групи не дисоційовані, за рахунок зв’язків з атомами Нітрогену і MeL. Однак у складі ЕДОФА наявність оксифенільних радикалів, які проявляють більшу спорідненість до Феруму, надає комплексу високу специфічність. При взаємодії з йонам феруму(ІІІ) утворюється надзвичайно стійкий комплекс (lgβ ~ 30, табл. 6) з шістьома координаційними зв’язками, в тому числі і з фенольними атомами Оксигену.
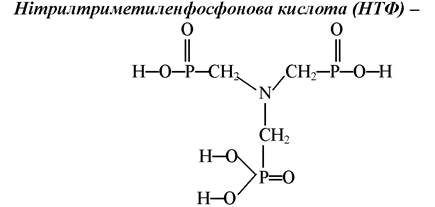
є шестиосновною кислотою, комплексоном амінофосфонового ряду. На відміну від амінокарбонових лігандів амінофосфонові комплексони утворюють цілий ряд протонірованих комплексонів: MeHL, MeH2L і навіть MeH3L.
Таблиця 6
Логарифми констант стійкості біометалів з комплексонами (за Н. Дятловою, В. Темкиною, І. Колпаковою)
Скорочене позначення |
Повна назва комплексону |
Caz+ |
Mg2+ |
Mn2 |
Fe2 |
Fe3+ |
Zn2+ |
Co2+ |
Cu2+ |
ІДА |
Імінодиацетатна кислота |
2,59 |
3,86 |
- |
5,80 |
10,72 |
7,02 |
7,01 |
10,60 |
НТА |
Нітрилтриацетатна кислота |
6,41 |
5,41 |
7,44 |
8,83 |
15,87 |
10,67 |
10,38 |
12,96 |
ЕДГА |
Етилендиамінтетраацетатна кислота |
10,70 |
8,69 |
14,04 |
14,33 |
25,16 |
16,50 |
16,31 |
18,80 |
ДТПА |
Диетилентриамінпентаацетатна кислота |
10,89 |
9,05 |
15,60 |
15,97 |
27,50 |
18,55 |
19,27 |
21,53 |
ТТГА |
Триетилентетраамінгексаацетатна кислота |
9,89 |
8,43 |
11,70 |
17,10 |
26,80 |
18,10 |
28,00 |
27,60 |
ТПГА |
Тетраетиленпентамінгептаацетатна кислота |
7,57 |
6,61 |
- |
- |
- |
- |
- |
- |
ОЕДГА |
Оксиетилендиамінтриацетатна кислота |
8,00 |
5,20 |
10,70 |
11,60 |
19,60 |
14,50 |
14,40 |
17,40 |
ДБТА |
Дигідроксибутилендиамінтет-раацетатна кислота |
9,39 |
- |
- |
- |
- |
- |
- |
- |
ЕДДБ |
Етилендиаміндибурштинова кислота |
4,23 |
5,82 |
8,95 |
10,70 |
22,00 |
13,49 |
14,06 |
18,36 |
ЕДОФА |
Етилендиамін-ди-(2-гідроксофеніл)-диацетатна кислота |
7,20 |
8,00 |
7,39 |
- |
~30<0 0 |
10,82 |
11,00 |
12,98 |
ОЕДФ |
Гідроксиетилендифосфонова кислота |
6,00 |
6,60 |
9,20 |
9,10 |
16,30 |
10,70 |
9,40 |
12,50 |
НТФ |
Нітрилтриметиленфосфонова кислота |
6,68 |
6,49 |
10,20 |
- |
- |
- |
14,40 |
17,80 |