Общая биотехнология: Курс лекций Часть II - Блинов В.А. 2004
Микробиологическое производство антибиотиков и витаминов
♦ Общие сведения об антибиотиках. Селекция антибиотиков. Основы технологии.
♦ Микробиологическое производство витаминов.
♦ Биотрансформация органических соединений. Бесклеточный синтез.
Общие сведения об антибиотиках. Антибиотики, алкалоиды, гормоны роста растений, токсины относятся к вторичным метаболитам (идиолитам). Они производятся ограниченным числом таксономических групп. Микроорганизмы, производящие вторичные метаболиты, сначала проходят стадию быстрого роста - тропофазу, во время которой синтез вторичных метаболитов незначителен. Затем, по мере истощения одного или нескольких необходимых питательных веществ в культуральной среде, микроорганизмы переходят в идиофазу. В этот период и синтезируется основное количество вторичных метаболитов. Что касается антибиотиков, то большинство микроорганизмов в тропофазе чувствительны к собственным антибиотикам. Поэтому процесс как можно быстрее следует перевести в идиофазу и в этой фазе культивировать микроорганизмы, продуцирующие антибиотики.
В 1940 г. А. Флеминг и другие впервые получили пенициллин из культуральной жидкости в аморфном, а затем и в кристаллическом виде. Сейчас антибиотики - самый большой класс фармацевтических соединений, синтез которых осуществляется микробными клетками. К этому же классу относятся противогрибковые агенты, противоопухолевые лекарства и алкалоиды. Шесть родов филаментозных грибов производят около 1000 различных антибиотиков, в т.ч. цефалоспорины и пенициллины. Два рода нефиламентозных бактерий синтезируют 500 антибиотиков, а три рода актиномицетов - около 3000 антибиотиков. В настоящее время известно примерно 6000 антибиотиков. Причем наблюдается тенденция к получению новых форм антибиотиков не путем биосинтеза новых веществ, а путем химической или биотехнологической трансформации уже известных антибиотиков.
По биологическому действию антибиотики делятся на антибактериальные, антифунгицидные (противогрибковые) и противораковые. К антибактериальным антибиотикам относятся: угнетающие рост грамположительных бактерий (пенициллин, цефалоспорин, эритромицин, олеандомицин, карбомицин и др.); угнетающие рост грам отрицательных бактерий (тетрациклин, неомицин, стрептомицин, полимиксин, грамицидин и др.), обладающие противотуберкулезным действием (стрептомицин, биомицин, циклосерин и др.). В группу противогрибковых антибиотиков входят нистатин, гризеофульвин, леворин, кандицидин и др. К противоопухолевым антибиотикам относятся актиномицин, митомицин С и др.
С коммерческой точки зрения наиболее распространенными оказались пенициллин, цефалоспорин и тетрациклин. Стоимость мирового производства антибиотиков в 1985 г. составила 8 млрд, долларов. В 1980 г. мировое производство антибиотиков составляло примерно 25000 т. из них 17000 т пенициллины, 5000 т - тетрациклины, 1200 т - цефалоспорины, 800 т — эритромицины.
Ядром пенициллинов является 6-аминопенициллановая кислота (6-АПК), которую используют для получения полусинтетических пенициллинов.
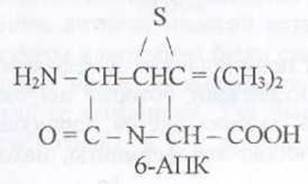
Обычно 6-АПК получают из бензилненициллина (пенициллин G) при помощи пенициялинамидазы (пеницииллинацилазы). Этот процесс микробиологический, используют либо Е. coli, либо В. megatherium. Фермент адсорбируют из культуральной жидкости на бентоните и осуществляют реакцию в периодическом режиме. Иммобилизованная пенициллинамидаза используется и для получения новых антибиотиков из группы цефалоспоринов.
Если один из водородов аминогруппы 6-АПК заменить на какой-либо радикал, то можно усилить или расширить антимикробный спектр такого полусинтетического антибиотика. Например, добавление к ß-лактамному кольцу метоксильной (СН3О-) группы привело к появлению цефалинов. В настоящее время производят биосинтетические (с помощью Penicillium notatum или Р. chrysogenum) антибиотики и на их основе - полусинтетические антибиотики (ß-лактамы).
Ядром другой обширной группы экстрацеллюлярных ß-лактамных антибиотиков-цефалоспоринов является 7-аминоцефалоспорановая кислота (7-АЦК), выделенная в ходе очистки цефалоспорина С (продуцент Cephalosporium acremonium).
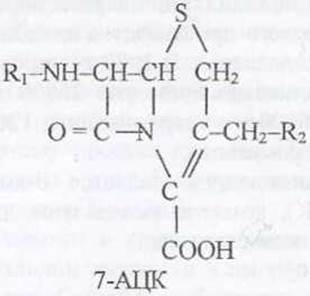
Устойчивость к пенициллинам и цефалоспоринам связана с ферментами ß-лaктамазами, которые широко распространены среди бактерий, актипомицетов, цианобактерий и дрожжей. Гены, кодирующие эти ферменты, находятся в составе плазмид, поэтому устойчивость может передаваться при переносе плазмид от одного бактериального штамма к другому. Ферменты ß-лактамазы ингибируют синтез ß-лактамных антибиотиков, в т.ч. тиенамицинов, продуцируемых Streptomyces cattleya.
Селекция антибиотиков. Антибиотики продуцируются в результате совместного действия 10-30 генов. Их число не позволяет обнаружить отдельные мутации, которые могли бы повысить продукцию целевого продукта. Поэтому высокопродуктивные штаммы пенициллина и тетрациклина (Penicillium chrysogeruim и Streptomyces auerofaciens) были получены в результате последовательных циклов мутагенеза и селекции. При этом, если обнаруживался мутант, производящий большое количество антибиотика, то он становился исходным материалом для новых циклов мутагенеза и скрининга. Так, на первом этапе обнаружили спонтанный мутант, производивший 60 мг/л пенициллина, а затем был выделен суперпродуцент с выходом пенициллина 150 мг/л. После рентгеновского облучения получен штамм, производящий 300 мг/л пенициллина, его подвергли ультрафиолетовому облучению и выделили штамм, который давал 550 мг/л пенициллина. Последний штамм послужил исходным материалом для нескольких циклов мутагенеза и селекции, в которых помимо УФО применили иприт. Был получен продуктивный штамм, который производил 7 г/л пенициллина. Таким путем за два десятка лет в 21 цикле мутагенеза и селекции удалось увеличить выход пенициллина в 55 раз. Позднее выявили продуцент, производящий 20 г/л пенициллина, что в 10000 раз превышает выход антибиотика, полученного в 1941 г.
В результате мутаций появились новые вторичные метаболиты, такие как 6-диметалхлортетрациклин и 6-диметилтетра-циклин, обладающие антибиотической активностью. Причем определенные мутанты-идиотрофы были способны синтезировать только половину молекулы антибиотика, а среда должна обогащаться другой ее половиной. Так были открыты новые производные антибиотиков, в т.ч. принадлежащие к аминоциклитальной группе. Далее было обнаружено, что синтез некоторых антибиотиков, например, продуцируемых различными видами Streptomyces, определяется не хромосомными генами, а плазмидой. Считается, что введение в одну клетку Streptomyces нескольких плазмид такого типа может способствовать объединению различных метаболических путей и биосинтезу новых антибиотиков.
Основы технологии. В настоящее время многие антибиотики получают методом глубинной ферментации. Например, интенсивный синтез пенициллина начинается при большом количестве биомассы мицелия, полном использования глюкозы и молочной кислоты в среде и pH, близком к нейтральному. Установлено, что бензилпенициллановая кислота, как один из предшественников пенициллина, синтезируется из L-цистина, фенилуксусной кислоты и диметилнировиноградной кислоты.
Для получения пенициллина вначале размножают споры, как правило, на агаризованных средах. В их состав входит (в %): 0,5 мелассы, 0,5 пептона, 0,4 поваренной соли, 0,01 однозамещенного фосфата калия и 0,05 сульфата магния. В промышленных условиях споры выращивают на пшене во флаконах при температуре 25- 27 °С в течение 4-5 суток. Высушенные споры можно хранить при комнатной температуре. Затем спорами засевают инокуяяторы (1-3 флакона на аппарат), где мицелий размножают до 5-10 % объема посевных ферментаторов. В них мицелий выращивают 12-18 ч, а 15-20 % объема культуральной жидкости используют для основной ферментации.
Питательные среды, как для выращивания мицелия, так и биосинтеза пенициллина, обычно готовят из кукурузного экстракта - 2-3 %, лактозы — 5 %, глюкозы — 1,5 %, сульфата аммония и фосфатов - 0,5-1,0 %, а также производных фенилуксусной или феноксиуксусной кислот как предшественников антибиотика - 0,3-0,6 %. Для стабилизации pH используют мел. Ферментацию ведут при 22-26 °С, pH — 5,0-7,5, при интенсивной аэрации среды [(1 м3 О2 / (м3∙мин)] и мощности 1- 4 кВт/м3. Чаще всего применяют биореакторы объемом от 30 до 200 м3 с механической мешалкой, системами охлаждения и пеногашения. В течение 4 суток количество пенициллина достигает максимума (до 10000 усл. ед./мл). Мицелий отделяют фильтрованием, обычно в вакуум-фильтрах, а затем его используют в животноводстве как источник белков и витаминов.
После отделения мицелия в культуральной жидкости содержится 3-6 % СВ, из которых 30- 40 % составляют минеральные вещества и 15-30 % пенициллин. В фильтрате содержится белок, иногда до 700 мг на 100 мл, что затрудняет выделение пенициллина. Белковые примеси удаляют, осаждая их солями многовалентных металлов (Al, Fe, Zn), коагулируя танином или денатурируя при температуре 65 70 °С и pH среды 5,5-6,0. При этом потери пенициллина составляют 5-15 %.
Пенициллин экстрагируют органическими растворителями (бутилацетатом или амилацетатом), при этом pH должен быть 1,9-2,0. В результате экстракции чистота продукта увеличивается в 4 6 раз. Затем пенициллин из бутилацетатного экстракта при помощи раствора бикарбоната натрия (pH среды 6,6- 7,2) растворяют в воде, получая жидкость с содержанием сухих веществ 5-7 % и активностью 30000-50000 усл. ед./мл. Для очистки пенициллин снова экстрагируют бутилацетатом. Соотношение фаз при экстракции 1:0,5-1:1, активность экстракта 50000-70000 усл. ед./мл. Выход пенициллина составляет примерно 86 % от его количества в культуральной жидкости.
Затраты на производство антибиотиков следующие (в % от общих затрат): ферментация - 50-70; фильтрация - 3-5; экстракция - 15 -30; кристаллизация - 5-10; сушка - 5-10. В свою очередь процесс ферментации включает затраты: на материалы - 45-65 %; рабочую силу - 5-10; пар - 5-10; электроэнергию - 15-30; приготовление инокулята - 2-8 % от общих затрат процесса ферментации.
При составлении питательных сред надо помнить, что для синтеза пенициллина лимитирующим фактором является глюкоза, а при синтезе других антибиотиков, продуцируемых Streptomyces, лимитацию роста обеспечивают фосфаты. В последнее время экстракцию и химическую очистку пенициллина ведут по непрерывной схеме. Если пенициллин получают для медицинских целей, то особое внимание уделяют очистке этого лекарства.
Актиномицеты как продуценты антибиотиков «всеядны», т.е. они способны расти и производить продукт на многих средах, содержащих белки (соевая мука, рыбная мука, белок клейковины пшеницы и др.) или крахмал. Однако каждый продуцент имеет свои особенности. Так, посевной материал Streptomyces kanamyceticus получают на соево-крахмальной среде, на ней же проводят основную ферментацию при 27 28 °С в течение 4-5 суток при поддержании pH на уровне 7,1-7,6. При ферментации Str. floridae (продуцент виомицина) используется среда, содержащая глюкозу или гидрол, соевую муку, кукурузный экстракт, нитраты, мел, температура должна быть 27-29 °С, pH - 7,0-7,3. При культивировании Str. erythreus в питательную среду добавляют пропиловый спирт как предшественник антибиотика эритромицина. Продуцент нистатина Str. noursei хорошо усваивает аммонийный, но не нитратный азот.
Микробиологическое производство витаминов. Как известно, витамины поставляются в организм с пищей или их назначают при определенных заболеваниях. Биотехнологическим путем производят витамин A, D, В2, В12, С и др.
Каротиноиды (предшественники витамина А) синтезируются многими пигментными микроорганизмами из рода Aleuria, Blakeslea, Corynebacterium, Fusarium, Halobacterium, Pseudomonas, Sarcina, Sporobolomyces и др. Всего известно около 500 каротиноидов, продуцируемых бактериями, дрожжами и мицелиальными грибами. Они в виде сложных эфиров и гликозидов находятся либо в клеточной мембране микроорганизмов, либо в свободном состоянии в липидных гранулах цитоплазмы. Биосинтезу каротиноидов, которые в основном выполняют защитные функции, способствует свет. При культивировании некоторых видов микроорганизмов можно добиться образования 3-4 г каротина на 1 л среды.
Питательные среды для культивирования каротиноидов сложные, они должны включать источники углерода, азота, витаминов, микроэлементов, стимуляторов (гидрол, кукурузно-соевая мука, растительные масла, керосин, ß-ионон, изопреновые димеры и др.). Стимуляторы обычно вносят в питательную среду в конце тропофазы, т.е. когда продуцент начинает переходить в идиофазу.
Сначала штаммы выращивают раздельно, а затем совместно при 26 °С и усиленной аэрации, затем их переносят в основной ферментатор. Длительность ферментации составляет 6-7 дней. Каротиноиды извлекают полярным растворителем, часто ацетоном, а затем переводят в неполярный растворитель. Если необходимо извлечь белково-каротиноидные комплексы, то применяют ПАВ в концентрации 1-2 %. Затем при гидролизе ß-каротина получают витамин Аl.
В основе витамина D лежит скелет эргостерина, который находится в клеточных мембранах эукариот. Исходя из этого широко используют пекарские или пивные дрожжи, в которых содержание провитамина (эргостерина) составляет 0,2-11 %. Под влиянием УФО эргостерии трансформируется в витамин D2, который легко переходит в витамин D3. Физиологическая активность витаминов D2 и D3 одинакова. Кроме дрожжей продуцентами эргостерина являются аспергиллы и пенициллы, в которых может содержаться от 1,2 до 2,2 % эргостерина. При недостатке витаминов группы D, как известно, у детей развивается рахит, а у взрослых - остеомаляция.
Для получения эргостерина в условиях производства необходимы следующие этапы: размножение исходной культуры и накопление инокулюма. ферментация, сепарирование клеток, облучение клеток ультрафиолетовыми лучами, высушивание и упаковка целевого продукта.
Облученные сухие дрожжи используют в животноводстве. Их выпускают под названием «кормовые гидролизные дрожжи, обогащенные витамином D2». В таком препарате содержится не менее 46 % сырого белка, незаменимые аминокислоты (лизин, метионин, триптофан) и 5000 ME витамина D2/г.
Для получения кристаллического витамина D2 клетки продуцента гидролизуют соляной кислотой при 110 °С, затем температуру снижают до 75-78 °С и добавляют этанол. Смесь фильтруют при 10-15 °С, оставшуюся после фильтрации массу промывают водой, затем ее высушивают, измельчают, нагревают до 78 °С и дважды обрабатывают тройным объемом этанола. Спиртовые экстракты объединяют и упаривают до 70 %-го содержания сухих веществ. Такой «липидный концентрат» обрабатывают раствором едкого натра.
Эргостерин кристаллизуется из неомыляемой фракции концентрати при 0 °С. Ею очищают повторными перекристаллизациями. Кристаллы высушивают, растворяют в серном эфире, облучают ультрафиолетовыми лучами, эфир отгоняют, раствор витамина D2 концентрируют и кристаллизуют. «Кислотный фильтрат» упаривают до 50 %-го содержания сухих веществ и применяют как концентрат витаминов. Производят также масляный концентрат витамина D2.
Витамин В2 (рибофлавин) продуцируется бактериями, дрожжами и нитчатыми грибами. В настоящее время селекционированы штаммы, которые образуют на жидких средах 0,5 г и более рибофлавина в 1 л среды. Это: Ashbyii gossypii, Eremothecium ashbyii, Candida guilliermondii. Методами генной инженерии получен штамм сенной палочки, продуцирующий около 6 г рибофлавина в 1 л среды, содержащей мелассу, белково-витаминный концентрат и его гидролизат.
Обычно в качестве источников углерода применяют глюкозу и сахарозу, дрожжевой и кукурузный экстракты, соевую муку, масла и др. Так. известна среда следующего состава для получения посевного материала: сахароза, пептон, кукурузный экстракт, калий дегидрофосфат, магний сульфат, подсолнечное масло. Время выращивания продуцента на этой среде составляет 2 суток при температуре 27-30 °С. Чаще ферментацию проводят в течение 5 суток при pH 5,5-7,7. Полученную биомассу высушивают и продукт с остаточной влажностью 8 %, содержащий 1,5-2,5 % рибофлавина, 20 % белка, тиамин, никотиновую кислоту, пиридоксин, цианкобаламин, микроэлементы, используют для кормления животных. Если продукция рибофлавина достаточно высокая, то можно выделить витамин В2 отдельно и вместе с синтетическим витамином использовать в медицине.
Витамин С (аскорбиновая кислота) синтезируют все растения и животные, кроме обезьян и морских свинок. Человек также не может синтезировать аскорбиновую кислоту, она для людей является незаменимой. Микроорганизмы не синтезируют витамин С, но в нем и не нуждаются. Однако некоторые виды уксуснокислых бактерий образуют полупродукт аскорбиновой кислоты - L-сорбозу. Эта биологическая стадия процесса катализируется мембраносвязанной полиолдегидрогеназой. Затем проводят химическую стадию, состоящую из нескольких этапов. В конечном счете получается 2-кетo-L-гулоновая кислота. Ее подвергают энолизации и трансформируют в L-аскорбиновую кислоту. Следовательно, процесс получения аскорбиновой кислоты является смешанным, т.е. ХИМико-ферментативным.
Ферментацию продуцента (Gluconobacter oxydans) проводят на средах, содержащих сорбит (20 %), кукурузный или дрожжевой экстракт; необходима интенсивная аэрация (8-10 г O2 /л/ч). Выход L-сорбозы может достичь 98 % за 1-2 суток. Культивирование проводят в периодическом или непрерывном режиме. Аскорбиновую кислоту используют как антиоксидант в здравоохранении и пищевой промышленности.
Витамин B12 (цианкобаламин) получают только микробиологическим синтезом. Его продуцируют прокариоты, прежде всего пропионовые бактерии. В России для производства витамина В12 используют Propionibacterrium var. Shermanii, культивируемый в периодическом режиме без доступа кислорода. Ферментационная среда содержит глюкозу, кукурузный экстракт, соли аммония и кобальта, pH около 7,0; его поддерживают, добавляя NH4OH. Продолжительность ферментации 6 суток. Через 3 суток в среду добавляют 5,6-диметилбензими-Дазол (предшественник витамина В12) и ферментацию продолжают еще 3 суток.
Цианкобаламин накапливается в клетках бактерий. Поэтому для его выделения используют: сепарирование клеток, экстрагирование водой при pH 4,5-5,0 и температуре 85-90 °С в присутствии стабилизатора (0,25 %-й раствор натрия нитрата). Экстракция длится один час, затем водный раствор охлаждают, нейтрализуют раствором едкого натра, добавляют коагулянты белка (хлорид железа, сульфат аммония), фильтруют. Фильтрат упаривают и очищают, используя ионный обмен и хроматографию. Затем витамин кристаллизуют при 3—4 °С из водно-ацетонового раствора. Иногда используют резорцин или фенол, которые образуют с витамином В12 аддукты; они затем легко разлагаются.
На ацетобутиловой и спиртовой бардах с добавлением кобальта и метанола в России получают кормовой препарат (КМБ12), который содержит витамин В12 и другие ростовые факторы. Здесь биообъектом является смешанная культура метаногенных бактерий. Витамин В12 обладает высокой светочувствительностью, поэтому все операции необходимо проводить в затемненных условиях или при красном свете.
Витамин B12 является антианемическим фактором, он абсолютно необходим для нормальной жизнедеятельности организмов. Мировое производство цианкобаламина достигает 10 т в год, из которых 6,5 т расходуют на медицинские нужды, а 3,5 т - в животноводстве.
Биотрансформация органических соединений. Многие микроорганизмы способны превращать различные вещества в новые соединения. Так, Gluconobacter suboxydans трансформирует сорбит, глицерин, глюкозу и маннит соответственно в сорбозу, дигидрооксиацетон, 5-кстоглутаровую и глюконовую кислоты. Pseudomonas miyamiry превращает D-фенилалланин в L-фенилалланин и др.
Биотрансформация органических веществ в новые соединения отличается тем, что в ней участвует один фермент, который катализует окисление, декарбоксилирование, метилирование и т.д. В процессах же биосинтеза и брожения, как известно, участвует большое число разных ферментов.
Для получения необходимого соединения, сначала размножают культуру соответствующего микроорганизма до количества, составляющего 5-10 % объема трансформируемого раствора. При этом исходят из двух предпосылок. Во-первых, в питательной среде следует растворить максимально возможное количество трансформируемого вещества, обычно это 10- 25 %. Во-вторых, надо использовать минимум питательных солей, необходимых для роста культуры, причем выделение целевого продукта не должно быть затруднено. Трансформацию проводят в стерильных условиях при поддержании оптимума pH, температуры и других факторов. Процесс длится обычно 0,5-2 суток. После микробиологической трансформации следует химическое выделение вещества из раствора.
Технологические методы трансформации могут быть следующими:
♦ в периодических условиях с использованием растущей культуры;
♦ использование не размножающихся клеток:
♦ использование спор;
♦ применение дезинтегрированных клеток;
♦ при помощи иммобилизованных клеток микроорганизмов;
♦ с использованием выделенных из микроорганизмов ферментов, в т.ч. иммобилизованных;
♦ непрерывные методы.
Трансформация органических соединений осуществляется при высоком коэффициенте конверсии, составляющем 0,9-1,0. Перспективными являются двухфазные системы: вода - органический растворитель, в которых создаются хорошие термодинамические условия реакций. Для биотрансформации важное значение имеет проницаемость цитоплазматической мембраны; ее иногда необходимо регулировать. Например, при конверсии пуринов или пиримидинов в соответствующие нуклеотиды с помощью Brevibacterium ammoniogenes проницаемость мембраны регулируют ионами марганца. В ряде случаев, для более эффективной трансформации одних органических веществ в другие, культуру выращивают на одном субстрате, а конверсию проводят на другом. Однако следует помнить, что трансформирующие свойства штаммов могут изменяться в результате мутации.
Микробиологическую трансформацию стали широко использовать после 1934 г., когда выяснилось, что Acetobacter suboxydans превращает D-сорбит в L-сорбозу, необходимую для синтеза аскорбиновой кислоты. В настоящее время с помощью биотрансформации получают и преобразуют холестерин, эргостерин, половые гормоны, гормоны коры надпочечников, простагландини, тромбоксаны, лейкотриены, простациклин и др. Эти физиологически активные вещества широко применяют в медицине.
Бесклеточный синтез. Академик А.С. Спирин разработал бесклеточную технологию получения целевого продукта; здесь взамен живых клеток используются специальные биореакторы. В них синтез продуктов осуществляет набор очищенных клеточных компонентов. При этом синтез продукта ограждается от ограничивающих факторов клетки и полностью управляется оператором. Система бесклеточною синтеза состоит из рибосом, некоторых белковых факторов, аминокислот и тРНК, а также АТФ и ГТФ. В бесклеточной биотехнологии реализуется размножение генетического материала и биосинтез белка (трансляция).
При внеклеточном клонировании генетического материала отпадает необходимость синтеза комплиментарной ДНК, конструирование вектора, подбор клетки-хозяина, выделение амплифицированной ДНК и получение из нее транскрипта мРНК. Бесклеточный синтез в 10 раз сокращает время, необходимое для клонирования генетического материала, и дает возможность получения больших количеств мРНК для крупномасштабных бесклеточных систем трансляции. При использовании проточных режимов и селективных мембран на входе и выходе процесса, продуктивность бесклеточной системы значительно возрастает.
Таким путем в лабораторных установках получают пептидные гормоны, антигены для диагностики, антитоксины, белковые токсины, антивирусные защитные белки, ферменты и др.