Общая биотехнология: Курс лекций Часть II - Блинов В.А. 2004
Микробиологическое производство возобновляемых источников энергии
♦ Производство этанола.
♦ Производство ацетона.
♦ Перспективы производства водорода.
♦ Биогеотехнология.
Различные природные ископаемые стремительно расходуются. Так, в США 70 % потребности в энергии удовлетворяется за счет трех источников: нефти (34 %), угля (18 %) и та (18 %). По расчетам, запасов нефти и газа хватит лишь до половины первого столетия третьего тысячелетия. Поэтому получение энергии из возобновляемых источников сырья является весьма актуальной проблемой. Возобновляемое сырье это растительный мир, где благодаря фотосинтезу из воды и диоксида углерода образуются органические вещества. На земле в растительном покрове находится 1800 млрд, т сухого вещества, в котором заключено 3,0∙1022 Дж энергии. В то же время запасы нефти, газа, угля и урана эквивалентны 2,5∙1022 Дж. Ежегодный прирост органическою вещества на планете составляет 2∙1011 т. Из этого количества 1,2∙1011 т приходится на долю лигноцеллюлозного сырья.
Простейший способ превращения биомассы в энергию заключается в сгорании - оно обеспечивает тепло, которое можно превратить в механическую или электрическую энергию. Если же вещество сырое, то наиболее эффективным методом является получение из него биогаза. Энергию можно получать из сельскохозяйственных культур, специально выращиваемых для этой цели (плантации быстрорастущих деревьев, растения, богатые крахмалом и сахарозой). Из такой растительной биомассы экстрагируются и подвергаются гидролизу запасные углеводы, которые затем благодаря микробному сбраживанию превращаются в спирт. В зависимости от конечного продукта различают спиртовое, молочнокислое, маслянокислое и другие виды брожения. При этом глюкоза трансформируется в ключевой продукт — пировиноградную кислоту, из которой в свою очередь образуются: уксусная кислота, пропионовая, масляная, молочная кислоты, ацетон, этанол, бутанол и т.д.
Производство этанола. Спиртовое брожение осуществляют дрожжи-сахаромицеты, некоторые мицелиальные грибы (Aspergillus orysae) и бактерии (Ervinia amylovora, Sarcina ventricLila, Zymomonas mobilis, Z. anaerobia). Наибольшее значение в получении этанола имеют дрожжи (Saccharomyces cerevisiae, Schizosaccharomyces pombe и S. octosporus).
Штаммы дрожжей подразделяются на расы верхового и низового брожения, а по способности к флокуляции - на хлопьевидные и пылевидные. Расами верхового брожения являются спиртовые, хлебопекарные и некоторые пивные дрожжи: расами низового брожения - большинство винных и пивных дрожжей. Клетки обеих рас могут быть подвергнуты флокуляции.
Пылевидные дрожжи в процессе брожения находятся в диспергированном состоянии, они менее стойкие к автолизу и более полно сбраживают сусло. Хлопьевидные дрожжи могут оседать на дно или всплывать на поверхность, они более выраженные ароматизаторы. Например, S. cerevisiae культивируют при pH 3-4, температуре 30 °С, при этом выход этанола от максимального составляет 100 %. Максимально может накопиться 130 г/л спирта.
Дрожжи не используют пентозы. Z. mobilis являются аэротолерантными, a Z. anaerobia - термоустойчивыми и т.д. Большой интерес представляют S. rosei. Для образования этанола они используют топинамбур, содержащий много инулина, который после гидролиза сбраживается до этанола.
В качестве сырья для производства этилового спирта используют зерно, картофель, мелассу свекловичную и тростниковую, рис и т.д., а также целлюлозу хвойных деревьев, солому, торф, сульфитные щелока - отходы целлюлозно-бумажной промышленности и пр. Из 1 т старого картона можно получить 150 л этанола.
Технологическая схема получения этанола. Сначала необходимо трансформировать крахмал в глюкозу. Для этого сырье обрабатывают амилолитическими ферментами. Обычно применяют грибную амилазу (A. niger, A. orysae и др.) или пророщенное зерно (солод).
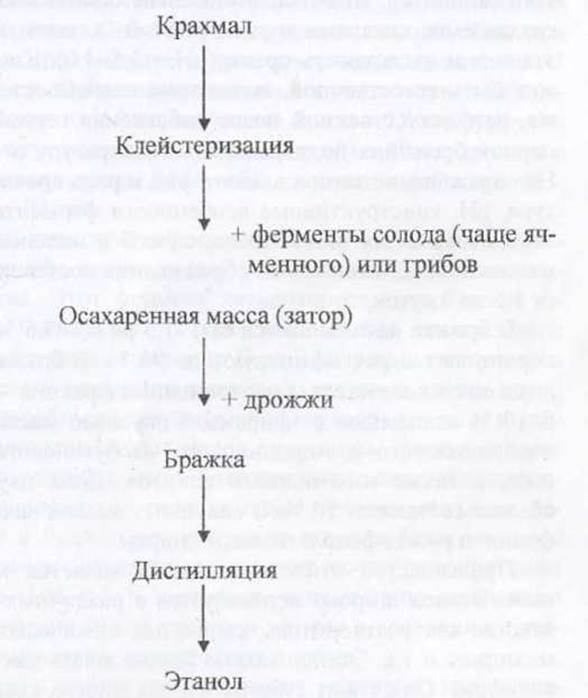
Для получения этанола используют картофельный, кукурузный, пшеничный, рисовый крахмал. Его дробят, применяя вальцовые, молотковые или другие дробилки. Затем крахмал клейстеризуют при разваривании. Например, пшеница и пшеничная крупчатка полностью клейстеризуются при 68 °С в течение 30 мин. Затем крахмал гидролизуют до низших сахаров (моноз, биоз), применяя ферментные препараты из нитчатых грибов или солода
Сбраживание затора проводят с помощью чистых культур в периодическом или непрерывном режиме. Важно, что в заторе создаются неблагоприятные условия для микробов- контаминантов. Сначала это высокое осмотическое давление, создаваемое сахарами и декстринами, а затем концентрация этанола и кислотность среды (pH = 3,8-4,0). Кислотность может быть естественной, вследствие особенностей метаболизма, или искусственной после добавления серной кислоты. В период брожения поддерживают температуру от 30 до 38 °С. На сбраживание затора влияют: вид и раса дрожжей, температура, pH, конструктивные особенности ферментаторов - система охлаждения или нагрева, способ и интенсивность перемешивания. Длительность сбраживания составляет в среднем от 1,5 до 3 суток.
В бражке накапливается от 1-1,5 до 6,5-8,5 % этанола; его перегоняют и ректифицируют до 96 %. В бражке накапливаются сивушные масла (высококипяшая фракция - 90-150 °С) и 5-10 % альдегидов с эфирами. Сивушные масла - это смесь изопропилового и н-пропилового, изобутилового и н-бутилового, а также изоамиловых спиртов. Доля двух последних обычно составляет 50 %. В сивушных маслах находят также ß- фенил- и р-оксифенилэтиловые спирты.
Производство этилового спирта является многотоннажным. Этанол широко используется в различных отраслях хозяйства как растворитель, сырье для химического синтеза, в медицине и т.д. Этанол можно использовать как экстрагент и антифриз. Он служит субстратом для многих красителей, фармацевтических препаратов, смазочных материалов, клеев, моющих средств, пластификаторов, взрывчатых веществ и смол для производства синтетических волокон. Предприняты попытки использовать этанол в качестве автомобильного топлива. В 1980 г. в США в продажу поступила смесь из 6-9 частей бензина и 1 части этанола («газохол»); это одно из перспективных направлений использования этанола.
Отходами производства этанола являются барда и диоксид углерода. Барду используют для откорма скота и птиц, а диоксид углерода - в пищевой промышленности.
Подчеркнем, что все большую экономическую и практическую значимость приобретает получение этанола при сбраживании гидролизатов древесных и травянистых растений; в них обычно содержится 2-3 % редуцирующих сахаров. Так, при совмещенном производстве спирта и кормовых дрожжей из 1 т абсолютно сухой древесины можно получить: этанол (абс.) 175-182 л., метанол 2 кг, сивушные масла - 0,3 кг, фурфурол (94 %) - 3,6 кг, диоксид углерода (жидкий) - 70 кг, дрожжи с остаточной влажностью 10 % - 32 кг, лигнин (абс. сухой) — 380 кг, гипс - 225 кг.
Методами генетической инженерии в дрожжи Schizosaccharomyces pombe включен ген, кодирующий биосинтез ксилозоизомеразы. Этот фермент катализирует превращение D-ксилозы в D-ксилулозу. В качестве вектора использована «ксилозоизомеразная» плазмида Е. coli. В результате удаюсь добиться прямой конверсии ксилозы в этанол, а клетки дрожжей стали способны одновременно сбраживать глюкозу и ксилозу в гидролизатах разных пород древесины. Однако следует помнить, что рентабельность бактериальных анаэробных ферментаций гидролизатов растительных отходов окажется реальной, если в бражке концентрация этанола будет не ниже 4,5-5 %. Причем «гидролизный» спирт после ректификации содержит до 0,05-0,1 % метанола, повышенное количество зльдегидов, органических кислот и эфиров в сравнении с этанолом - ректификатом из картофеля и зерна.
Особенности технологии получения этанола из гидролизатов древесины, сульфитных щелоков, мелассы, газа и других могут быть предметом самостоятельного изучения.
Увеличить производство этанола можно следующими путями:
♦ использовать непрерывную ферментацию вместо периодической. Это повышает продуктивность системы более чем в 2 раза Кроме того, выход этанола увеличивается при использовании флокулирующих рас дрожжей, рециркуляции биомассы и иммобилизации клеток;
♦ проведение вакуумной ферментации при разрежении 32- 35 мм рт. ст. для удаления этанола;
♦ осуществление флеш-ферментации, при которой часть культуральной жидкости периодически попадает в вакуумную камеру для удаления этанола;
♦ селекция этанолтолерантных штаммов микроорганизмов, способных образовывать высокие концентрации спирта.
Экономические преимущества производства этанола зависят от ряда условий: структуры сельскохозяйственных культур и их излишков; себестоимости сырья, экстрагируемого из биомассы и источников топлива; капиталовложений на строительство заводов; распределения цен. Например, страны, не имеющие выхода к морю, заинтересованы в замене нефти на другие топливные материалы и т.д.
Производство ацетона. Ацетонбутиловое брожение является анаэробным и вызывается спорообразующими бактериями Clostridium acetobutylicum или близкими к ним видами маслянокислых бактерий. Сбраживая зерновые, мелассно-зерновые заторы, мелассу, крахмал, патоку, гидролизаты целлюлозы различного происхождения, сульфитные щелока, получают ацетон и бутиловый спирт. Так, если среду готовят из кукурузы, то муку грубого помола смешивают с водой (6-8 кг муки на 100 л воды). Затем затор варят 2 ч под давлением 200 кПа и стерилизуют. Охлажденную до 37—42 °С массу сбраживают в течение 2 суток при pH среды 5—7. В процессе брожения из глюкозы образуется смесь, содержащая 6 частей бутанола, 1 часть этанола и 3 части ацетона. Подсчитано, что из 3 кг крахмала получается 1 кг органических растворителей.
В первый период ацетонбутилового брожения образуется уксусная и масляная кислоты, выделяются водород и диоксид углерода. Затем масляная кислота восстанавливается до бутилового спирта. Ацетон образуется из ацетоуксусной кислоты при ее декарбоксилировании. Инокулят готовят из свежих спор, температура их выращивания 37 °С. Основные ферментации проводят в периодическом, полунепрерывном и непрерывном режимах. Через 12 ч pH примерно с 6,0 снижается до 4,5-4,2 и на этом уровне остается до конца ферментации. Установлено, что при низких значениях pH активируются ферменты, катализирующие трансформацию ацетоацетил-КоА в ацетон. При этом увеличивается расход НАДН2 для восстановления бутирил-КоА в бутанол, количество которого увеличивается.
После окончания процесса ацетонбутиловую барду сепарируют, и дистиллят примерно наполовину упаривают. После этого ацетон отделяют от этанола и бутанола перегонкой при различных температурах. Ацетон кипит при 56,2 °С, этанол - 78,4 °С, азеотроп бутанола с водой - 93,4 °С, чистый бутанол при 117,7 °С.
Ацетон и бутанол широко используются в химической промышленности и других областях хозяйственной деятельности людей Отходами производства являются газообразные водород и диоксид углерода - примерно 30 м3 на 100 кг сахарозы, из которых около 70 % составляет СО2, а также плотная ацетонбутиловая барда. Газы улавливают и применяют для синтеза аммиака и метанола Барда - ценный продукт, содержащий значительные количество рибофлавина для получения кормового витамина В2 барду десятикратно концентрируют в многоступенчатых вакуум-выпарных аппаратах и высушивают в распылительных сушилках. Получают сухой концентрат, содержащий 60-100 мкг/r рибофлавина. Содержание сухих, преимущественно азотистых веществ, в барде составляет 3-5 %. Раньше барду после высушивания непосредственно использовали для кормления скота. В настоящее время ее применяют для выращивания кормовых дрожжей.
Процессы получения органических растворителей постоянно интенсифицируются и усовершенствуются. Так, предложена ферментация продуцента в биореакторе с псевдоожиженным слоем при непрерывной экстракции бутанола из многофазной среды. Процесс интенсифицируется при иммобилизации клеток продуцента на стеклянной поверхности биореактора разрабатываются методы биосинтеза органических растворителей на основе синтетического газа и др.
Перспективы производства водорода. Получение водорода как топлива в значительной степени остается на уровне поисковых разработок. Однако проблема получения такой формы энергии очень важна и имеет ряд предпосылок:
♦ субстрат фотолиза (вода) практически не ограничен;
♦ продукт (водород) можно хранить, он не загрязняет атмосферу и обладает высокой теплотворной способностью (29 ккал/г по сравнению с 3,5 ккал/г для углеводородов);
♦ процесс возобновляемый, ибо после удаления водорода субстрат (вода) регенерирует;
♦ продукция водорода происходит при нормальной температуре без образования токсичных промежуточных продуктов.
Химический и электрохимический способы получения водорода неэкономичны. Поэтому использование микроорганизмов, способных выделять водород, очень заманчиво. Такой способностью обладают аэробные и анаэробные хемотрофные бактерии, пурпурные и зеленые фототрофные бактерии, цианобактерии, различные водоросли и некоторые простейшие. Для процесса получения водорода необходимы ферменты - гидрогеназа и нитрогеназа.
Гидрогеназа - фермент, содержащий FeS-центры, катализирует следующую реакцию:
![]()
Однако гидрогеназа нестабильна, и ее активность быстро ингибируется водородом (продуктом реакции) и кислородом. Чтобы повысить выход водорода, следует найти гидрогеназы, менее чувствительные к кислороду. Такой является гидрогеназа из бактерии Alcaligenes.
При производстве водорода надо соблюдать три условия: 1) должно быть тесное сопряжение между переносчиком электронов и катализатором получения водорода; 2) между мембранами хлоропласта и переносчиком электронов надо установить эффективное взаимодействие; 3) переносчик электронов не должен легко окисляться. Повышение стабильности гидрогеназы можно достичь ее иммобилизацией, при этом чувствительность фермента к кислороду уменьшается.
Известно много вариантов модельных систем, катализирующих образование водорода из воды за счет энергии света. Все они содержат, как правило, хлоропласти или изолированный из них хлорофилл, а также восстановленные никотинамидные нуклеотиды. Если такие системы наряду с водородом образуют кислород, то говорят о фотолизе воды. Примером служит система: хлоропласт - ферредоксин - гидрогеназа. Здесь ферредоксин является промежуточным переносчиком электронов от фотосинтетической цепи хлоропластов к гидрогеназе.
Водород получают также с применением целых клеток микроорганизмов, стабильность которых возрастает при их иммобилизации. Хорошими продуцентами водорода являются пурпурные фототрофные бактерии, например, Rhodopseudomonas sp., которые при иммобилизации в агарозном геле дают до 180 мкмоль водорода за 1 ч в перерасчете на 1 мг бактерио-хлорофилла.
Другим ферментом, катализирующим выделение водорода, является нитрогеназа. У всех микроорганизмов нитрогеназа состоит из двух компонентов: Mo-Fe-белка и Fe-белка. Основной функцией нитрогеназы является восстановление молекулярного азота:
![]()
В отсутствие основного субстрата (N2) нитрогеназа катализирует энергозависимое восстановление Н+ с образованием Н2. Переключение фермента с одного режима работы на другой является технологической проблемой - следует получить штаммы микроорганизмов с нитрогеназой, которые не утилизируют азот.
Возможно комбинирование процессов получения водорода и других ценных продуктов. Так, представители рода Clostridium дают органические растворители и в то же время обладают активной гидрогеназой. Если в реакторе с Cl, saccharoper-butylacetoniocum не создавать оттока для выделяющегося водорода, то наблюдается торможение синтеза Н2 и усиливается продукция бутанола, ацетона и этанола.
Можно использовать и другие механизмы превращения энергии. Например, галофильная бактерия Halobacterium halobiurn способна использовать световую энергию, улавливаемую бактериородопсином мембран клеток. Этот пигмент образует разность концентраций протонов, протонных электрохимических потенциалов, что в конечном итоге обеспечивает производство энергии.
Итак, предложены различные системы для получения водорода с помощью биообъектов. Однако практическую значимость этого биотехнологического процесса еще предстоит оценить.
Повышение эффективности фотосинтетических систем. Теоретическая эффективность фотосинтеза, т.е. коэффициент превращения световой энергии в химическую энергию органических веществ, составляет 15 %. Однако фактически наиболее продуктивные культурные растения запасают не более 1,5-2 % энергии света. Для повышения эффективности фотосинтеза у культурных растений используют следующие подходы:
♦ сбалансированное использование фитогормонов и трансплантацию регуляторных генов;
♦ увеличение скорости роста растений за счет оптимизации водного и минерального питания;
♦ увеличение числа хлоропластов в клетке на единицу площади листа;
♦ повышение коэффициента превращения солнечной энергии до 4-5 % за счет увеличения площади листьев и их раннего формирования. Это достигается, в частности, при использовании препаратов эффективных микроорганизмов (ЭМ-технология);
♦ установление оптимального соотношения между функционирующими реакционными центрами хлорофилла и промежуточными переносчиками электронов, например, цитохромами;
♦ увеличение скорости переноса электронов между фотосистемами 1 и 2 и эффективности сопряжения между транспортом электронов и синтезом АТФ.
Биотопливные элементы. Они способны превращать химическую энергию субстрата в электрическую. Так, созданы модели топливных элементов на основе окисления метанола в муравьиную кислоту с помощью алкогольдегидрогеназы, муравьиной кислоты в СO2 с участием формиатдегидрогеназы, глюкозы в глюконовую кислоту с участием глюкозооксидазы. В реакциях окисления глюкозы используют также целые клетки, например, Е. coli. В. subtilis, Ps, aeruginosa и др. Окисление субстрата происходит на электроде (аноде). Посредником между субстратом и анодом является биокатализатор. Существуют два пути передачи электронов на электрод: с участием медиатора и непосредственный транспорт электронов на электрод.
Ферментные электроды применяются не только в топливных элементах. Они представляют собой основной компонент биологических датчиков - биосепсоров, широко применяемых в химической промышленности, медицине, при контроле за биотехнологическими процессами, в аналитических целях и т.д. Обычно используют системы с биокатализаторами, иммобилизованными на поверхности мембранного электрода. Например, иммобилизацией пенициллиназы на обычном рН- электроде получают чувствительный биосенсор, регистрирующий концентрацию пенициллина. Уже разработаны биосенсоры для быстрой регистрации концентрации глюкозы в крови больных, что очень важно при диагностике сахарного диабета.
Биогеотехнология. Во всем мире потребность в сырье и проблемы сохранения окружающей среды в связи с развитием металлургической и горно добывающей промышленности постоянно растут. Однако стоимость классических методов выделения металлов не позволяет экономически эффективно выделять их из бедных руд или вторичных отходов.
Приложения биотехнологии к добыче, обогащению и переработке руд. отделению и концентрированию металлов из сточных вод как вторичного сырья, экстракции остаточных порций нефти из иссекающих месторождений относится к области биогеотехнологии. Некоторые микроорганизмы могут катализировать определенные окислительно-восстановительные реакции, например, окисление железа и марганца в воде, окисление серусодержащих соединений, окисление и восстановление азотсодержащих соединений и т.д. Аэробные бактерии могут выделять железо, медь, сульфаты. Бактерии, грибы и водоросли способны накапливать в клетках и, следовательно, концентрировать медь, уран, серебро и другие металлы. Известен способ выщелачивания ванадия, реализуется подземное выщелачивание урана на рудниках и выщелачивание золота планируется широкомасштабное использование процессов биотехнологии для получения из обедненных руд никеля, цинка, олова, молибдена и др. Известны биологические способы очистки сточных вод от цианидов. Разработаны технологии выделения тяжелых металлов из стоков с использованием водорослей.
Способностью переводить металлы в растворимые соединения (выщелачивание металлов из руд) обладают различные бактерии. Так, Thiobacillus ferrooxydans выщелачивает железо, медь, цинк, уран, окисляя их серной кислотой, которая образуется этой бактерией из сульфида. Chromobacterium violaceum растворяет золою по схеме Au → Au(CN)2
Технология подобных процессов весьма проста: для извлечения остатков металлов из «пустых пород» горнорудного производства их обливают водой и собирают вытекающие продукты жизнедеятельности микроорганизмов - растворимые соединения (CuSО4, UO;2+2 и др.)
Микробные ПАВ используются в качестве эмульгаторов, смачивающих агентов, для увеличения добычи нефти и облегчения ее транспортировки по трубопроводам. При традиционной добыче нефти лишь 30 % запасов пласта поднимают на поверхность. Использование микроорганизмов, способных образовывать ПАВ, делает рентабельной эксплуатацию выработанных скважин. Микробные препараты показали свою эффективность при устранении нефтяных загрязнений на суше, на море, при деградации и эмульсификации тяжелых фракций нефти. Так, ксантан, внеклеточный полисахарид бактерии Xanthomonas campestris, применяется для извлечения нефти из иссякающих месторождений. Бактерии деэмульгаторы, например, Nocardia sp., Rhodococcus rhodochrous разделяют водную и нефтяную фазы, что используется при концентрировании нефти и очистке сточных вод от нефтяных примесей. Причем генноинженерные штаммы (псевдомонад и др,), утилизирующие сырую нефть, позволяют, во-первых, получать биомассу на базе необработанной нефти, во-вторых, предотвращают нефтяные загрязнения окружающей среды, устраняя, в частности, нефтяные пленки на поверхности вод морей и океанов.
Микроорганизмы могут применяться и для удаления метана из угольных пластов в шахтах.