Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Проблемы поиска, создания и применения антибиотиков в медицинской практике
Механизмы биосинтеза антибиотиков
Три основных обстоятельства определяют особенности биосинтеза, общие для всех антибиотиков:
✵ антибиотики не относятся к прямым продуктам трансляции или вообще матричного синтеза;
✵ антибиотики как вторичные вещества образуются из первичных метаболитов;
✵ биосинтез молекулы любого антибиотика происходит с участием ряда ферментов.
Координация действия ферментов, т.е. обеспечение правильной последовательности ферментативных реакций, обеспечивается разными путями. Один путь, доказанный на примере биосинтеза циклопептидных и некоторых других антибиотиков, связан с тем, что синтез или сборка антибиотической молекулы происходит в мультиферментных комплексах с упорядоченно расположенными ферментами. Первичные метаболиты «входят» в мультиферментный комплекс, в котором происходит ряд их превращений. Из комплекса «выходит» или завершенная молекула антибиотика, или ее крупный фрагмент, например, специфический агликон того или иного антибиотика и т. п. При «сборке» углеродного скелета молекулы антибиотика могут происходить различные реакции: метилирование или деметилирование; карбоксилирование или декарбоксилирование; аминирование или дезаминирование.
Предшественниками беталактамных антибиотиков являются аминокислоты. Началом формирования беталактамной молекулы является синтез так называемого LLD-трипептида из трех L-аминокислот — первичных метаболитов — L-аминоадипиновой кислоты, L-цистеина и L-валина:
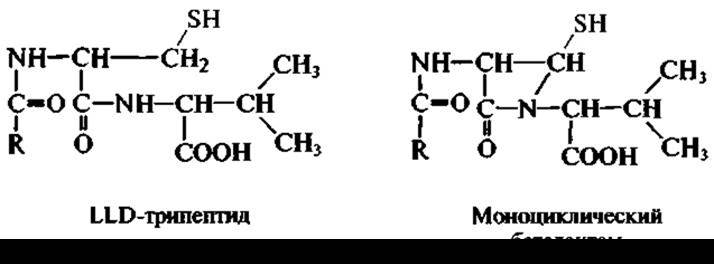
В образовании последнего принимает участие фермент, замыкающий пептидные связи, а также фермент, превращающий L-валин в его оптический антипод — D-валин. Это уже специфические ферменты биосинтеза антибиотика, не принадлежащие к ферментам, катализирующим превращения первичных метаболитов в обычных метаболических циклах.
Затем LLD-трипептид превращается в моноwиклический беталактам, т.е. происходит замыкание беталактамного кольца. Следующий этап — появление пятичленного серусодержащего кольца, сконденсированного с беталактамным. Все это означает участие в биосинтезе антибиотика новых ферментов. В случае образования бензилпенициллина необходимо присутствие фенилуксусной кислоты (в активированной форме), в результате чего освобождаются аминоадипиновая кислота и кофермент А.
Во втором случае происходит «экспансия» — расширение пятичленного кольца до шестичленного, что катализируется специфическим ферментом, получившим название «экспандаза». Далее, в результате еще ряда реакций формируется молекула цефалоспорина С.
Вышеперечисленные реакции биосинтеза демонстрируются как пример, чтобы еще раз подчеркнуть основополагающий тезис: молекула любого антибиотика синтезируется с обязательным участием ряда (5—10 и более) ферментов.
На основании анализа структурных формул аминогликозидов — стрептомицина и гентамицинов и других можно предположить, что их предшественником является глюкоза. Действительно, как показали многочисленные исследования, из глюкозы синтезируются не только остатки сахаров в молекулах аминогликозидов, но и их аминоциклитольный фрагмент. Два других фрагмента молекулы стрептомицина — пентоза (стрептоза) и L-глюкозамин также образуются из глюкозы за счет ряда ферментативных реакций. Наконец, сборка молекулы стрептомицина из трех компонентов — стрептидина, стрептозы и L-глюкозамина (замыкание между ними гликозидных связей) требует специфических ферментов. В биосинтезе стрептомицина и большинства других аминогликозидных антибиотиков участвуют не менее 20 ферментов.
Описывая ферментативные реакции биосинтеза тетрациклиновой структуры, обычно проводят аналогию с биосинтезом первичных метаболитов — жирных кислот, из остатков ацетатных или пропионатных единиц по принципу «голова к хвосту», когда формируется связь между углеродом карбоксильной группы и углеродом метильной группы (или метиленовой группы) следующей единицы. В этих ферментативных реакциях участвует кофермент А.
Существуют и принципиальные отличия между синтезом жирных кислот и антибиотиков — вторичных метаболитов. При биосинтезе антибиотиков не происходит восстановления карбонильных групп после реакции конденсации или такое восстановление происходит до образования гидроксильной группы или двойных связей. При полном восстановлении образуются ароматические структуры; при неполном — макроциклические лактоны. Таким образом, имеется определенная связь между «биогенезом» таких соединений, как тетрациклины и антибиотики-макролиды. Скелет молекулы тетра циклинов строится из одной малонамидной единицы и восьми малонатных.
Основа структуры лактонного макроциклического кольца эритромицина образуется как результат ферментативной полимеризации одной единицы пропионата и шести единиц метилмалоната. Сахара эритромицина происходят из глюкозы за счет ряда ферментативных превращений. В биосинтезе участвуют ферменты сборки молекулы из макроциклического лактона и сахаров.
Методы генной инженерии с успехом используются при создании продуцентов рекомбинантных белков, так как белки — прямые продукты трансляции. В целом остается справедливым правило: один ген — один белок, т.е. один «структурный» ген определяет структуру (последовательность аминокислот) одного белка.
Антибиотики не являются прямыми продуктами трансляции в отличие от ферментов биосинтеза антибиотиков. Количество таких ферментов достигает нескольких десятков. Таким образом, в биосинтезе молекулы антибиотика принимают участие десятки «структурных» генов.