Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Проблемы поиска, создания и применения антибиотиков в медицинской практике
Антибиотики как вторичные метаболиты и их продуценты
История науки об антибиотиках началась с того момента, когда лондонский микробиолог А. Флеминг обнаружил в 1929 г. на агаровой среде в чашке Петри, засеянной стафилококком, колонию плесневого гриба из рода Penicillium, образовавшуюся в результате случайно попавшей на агар из воздуха споры этого триба. Он заметил вокруг колонии зону прозрачного агара. Гриб образовывал антибиотик пенициллин, который не только останавливал размножение стафилококка, но и вызывал последующий лизис его клеток. Однако в очищенном состоянии пенициллин был выделен лишь спустя десятилетие, в начале Второй мировой войны, когда с особой остротой встала проблема борьбы с раневой инфекцией.
Под названием «антибиотики» объединены вещества, образуемые микроорганизмами и избирательно подавляющие рост других микроорганизмов. Позднее это понятие было распространено и на продукты их химической модификации, что получило отражение в наименовании «полусинтетические антибиотики». Некоторые из антимикробных антибиотиков обладают способностью подавлять рост опухолевых клеток, в связи с чем появился еще один новый термин — противоопухолевые антибиотики. Именно антибиотики, использование которых в медицинской практике при инфекционных заболеваниях началось в 1940 г., вызвали (за счет снижения смертности) резкие демографические изменения глобального масштаба, быстрый рост населения в развивающихся странах, увеличение продолжительности жизни в развитых странах и т.д. На мировом рынке годовая стоимость продукции промышленности антибиотиков сейчас превышает 20 млрд долл, и продолжает стремительно возрастать.
Важнейшая характерная черта антибиотиков — их избирательность действия на метаболизм. Обычно из нескольких тысяч метаболических реакций антибиотик подавляет только одну или несколько. В этом отношении антибиотики противопоставляются антисептикам, активность которых значительно ниже (антибиотики угнетают рост микроорганизмов в концентрации порядка 1 мкг/мл и меньше).
Антибиотики принадлежат к самым разным классам химических соединений. Известно около 14000 природных антибиотиков, образуемых микроорганизмами. Из них в медицинской практике применяют около 200. К. антибиотикам относятся только низкомолекулярные вещества — с молекулярной массой не более нескольких тысяч дальтон. Однако большинство антибиотиков, применяемых в медицине, имеет молекулярную массу в пределах одной тысячи дальтон. Образуемые микроорганизмами литические ферменты, несмотря на их антимикробную активность, к антибиотикам не относятся (белки-токсины).
Антибиотики высокоэффективны при инфекционных заболеваниях, вызываемых большинством грамположительных и грамотрицательных бактерий, многими патогенными грибами. Они с успехом используются при некоторых инфекциях простейших, риккетсий и крупных вирусов.
Успех лечения зависит от выбора антибиотика для индивидуального больного. Антимикробный спектр действия всех применяемых в медицинской практике антибиотиков известен, а вот видовая принадлежность и свойства возбудителя инфекции у конкретного больного, как правило, не известны. Б то же время лечение, особенно при тяжело протекающем заболевании, должно быть начато своевременно. Осмотр и опрос больного, предварительные выводы о локализации и характере инфекций обычно позволяют врачу остановиться на одном из так называемых «антибиотиков выбора». Однако независимо от этого рациональная и целенаправленная антибиотикотерапия должна базироваться на тщательной бактериологической диагностике заболевания с выделением, идентификацией возбудителя и оценкой его чувствительности к ряду препаратов, чтобы выбрать наиболее эффективный для лечения антибиотик.
Для определения чувствительности возбудителя используются стандартные, бумажные диски, пропитанные раствором антибиотика и высушенные. Диски раскладываются на поверхности твердой питательной среды, засеянной культурой возбудителя, и после инкубации в термостате определяется величина зоны подавления роста диффундирующим в агар антибиотиком. В настоящее время в клинических микробиологических лабораториях используются автоматизированные системы, позволяющие быстро проводить большое количество таких определений.
Иногда, после сопоставления чувствительности возбудителя к разным антибиотикам, уже применявшийся «антибиотик выбора» заменяют или дополняют другим препаратом, более эффективным в каждом конкретном случае. Частой причиной такой замены является распространение среди патогенных микроорганизмов штаммов, устойчивых (резистентных) к тому или иному антибиотику. Тем не менее набор имеющихся в распоряжении врача антибиотиков, как природных, так и полусинтетических, не гарантирует полного успеха антибиотикотерапии.
Известно, что антибиотики не являются первичными метаболитами. Как правило, их структура резко отличается от первичных метаболитов. Иногда в их молекуле в качестве фрагментов обнаруживаются как необычные для организмов структуры, так и аналоги метаболитов, например, аминоциклитол и аминосахара у аминогликозидов; макроциклические лактоны и аминосахара у макролидов и палиенов. В отличие от первичных метаболитов (предшественников макромолекулярных соединений) антибиотики за редкими исключениями вообще не обнаруживаются во время первых часов роста культуры. Так, образуемые грибами или актиномицетами антибиотики можно выявить в культуральной жидкости или мицелии продуцента только на вторые — третьи сутки роста, причем в незначительных количествах. Максимум их накопления наступает на пятые — шестые сутки.
Несмотря на то, что при синтезе или «сборке» молекулы антибиотика используются первичные метаболиты (аминокислоты, сахара, жирные кислоты, пурины и т.д.), образование антибиотика подчиняется общим законам внутриклеточной регуляции, он становится необходимым для своего продуцента.
Существует несколько предположений о биологической роли антибиотиков. Наиболее распространенной считается гипотеза, что антибиотики являются средством преодоления «стрессовых» ситуаций для продуцента, независимо от того, чем вызвана такая ситуация — исчерпанием питательных веществ в результате роста культуры конкурента или результатом размножения клеток своей же культуры.
Образование антибиотика определенной структуры не является строго видоспецифическим признаком. Принадлежащие к одному виду штаммы, выделенные из природных источников, могут иногда образовывать разные антибиотики. Особенно много таких примеров относится к виду Streptomyces riseus. Разные штаммы этого вида могут образовывать резко отличающиеся по структуре антибиотики: например, аминогликозидный антибиотик стрептомицин, полиеновый антибиотик кандицидин, антибиотик пептидной структуры виридогризеин.
Штаммы микроорганизмов, отнюдь не близкие по своему систематическому положению, могут иногда образовывать сходные структуры. Цефалоспорины образуются не только грибами, но и актиномицетами (в последнем случае они получили название цефамицины). Антибиотики, ключевым компонентом которых является беталактамное ядро, образуются не только грибами и актиномицетами, но и отдельными штаммами бактерий некоторых видов, в том числе даже и неспорообразующих.
Все эти данные трудно объяснить, исходя из того, что каждый антибиотик играет специфическую роль в метаболизме своего продуцента. Японский исследователь Умезава, открывший несколько ценных для практики антимикробных и противоопухолевых антибиотиков, даже выдвинул гипотезу об антибиотиках как о случайных для штамма веществах. Он предположил, что гены биосинтеза антибиотиков могут быть локализованы во внехромосомных генетических элементах — плазмидах и передаваться от одного вида микроорганизма другому путем конъюгации или, например, переноситься с помощью умеренных фагов широкой специфичности. В настоящее время гипотеза Умезавы отвергнута: гены биосинтеза антибиотиков считаются локализованными только в хромосомах.
Внимание привлекла новая концепция: у микроорганизмов, особенно это относится к актиномицетам, часть генов в геноме находится в «молчащем» состоянии. Они не экспрессируются, т.е. продукты, кодируемые этими генами, в том числе антибиотики, не синтезируются. Однако под влиянием различных воздействий тот или иной участок «молчащего» генома начинает работать. В результате получают объяснение причины образования различными штаммами одного вида разных антибиотиков, а также образование близких антибиотиков микроорганизмами разных видов. Конечно, это не означает, что любой актиномицет может образовать любые антибиотики. Однако концепция «молчащих» генов заставляет уже на современном молекулярном уровне вернуться к одному из положений, высказанных классиком науки об антибиотиках американским микробиологом З.Ваксманом. Он утверждал, что, выделив почвенный микроорганизм на искусственных питательных средах и культивируя его в условиях, отличных от природных, нельзя получить представления о полном биосинтетическом потенциале микроорганизма и о перечне образуемых им вторичных метаболитов. Однако моделирование природных условий — исключительно сложная задача. Во-первых, на микроуровне они мало изучены. Во-вторых, их разнообразие должно быть очень велико.
В лабораториях разных стран мира выделены и охарактеризованы десятки тысяч продуцентов антибиотиков. Как правило, продуцентами антибиотиков являются такие почвенные микроорганизмы как плесневые грибы, актиномицеты и спорообразующие бактерии.
Плесневые или «низшие» мицелиальные грибы отличаются от «высших» грибов отсутствием плодового тела. Плесневые грибы широко распространены в почве. Их относят к микроорганизмам эукариотам, имеющим оформленное, окруженное мембраной ядро. Плесневые грибы имеют также субклеточные структуры — митохондрии, где сосредоточены ферменты, катализирующие биоэнергетические процессы. Клеточная стенка грибов состоит из хитина — полимера, содержащего остатки аминосахаров. В целом клетки грибов отличаются сложной организацией и большими размерами по сравнению с бактериальными клетками.
Плесневые грибы — многоклеточные микроорганизмы со сложным циклом развития. Они формируют разные виды мицелия (например, воздушный — на поверхности водной среды), спороносны со спорами и другие морфологические образования. Цикл развития грибов 6-7 сут. Плесневые грибы образуют сотни разных антибиотиков, однако в медицинской практике применяются лишь отдельные из них. Важнейшая группа антибиотиков, образуемых грибами, — пенициллины и цефалоспорины. Их объединяют под названием беталактамные антибиотики, так как важнейшая часть их молекулы, от которой зависит антимикробная активность, реакционно-способное четырехчленное беталактамное кольцо (циклический амид):
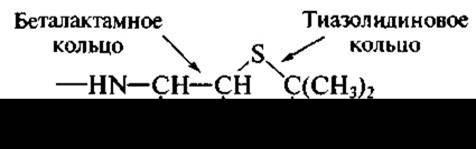
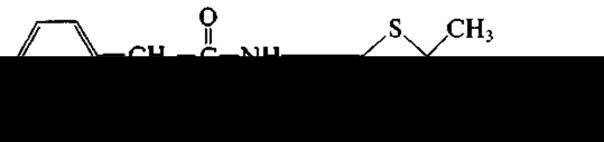
Беталакгамное кольцо получило свое название ввиду того, что при его образовании происходит замыкание связи между углеродом карбоксильной группы аминокислоты и азотом аминогруппы, находящейся при бетауглеродном атоме. Беталактамные антибиотики образуются двумя родами плесневых грибов: Penicillium (отсюда — пенициллины) и Cephalosporium (цефалоспорины). В настоящее время предпочитают вместо Cephalosporium использовать название Acremonium. Широко известны два продуцента беталактамов: Penicillium chrysogenum и Acremonium chrysogenum. Первый образует бензилпенициллин:
второй — цефалоспорин С:
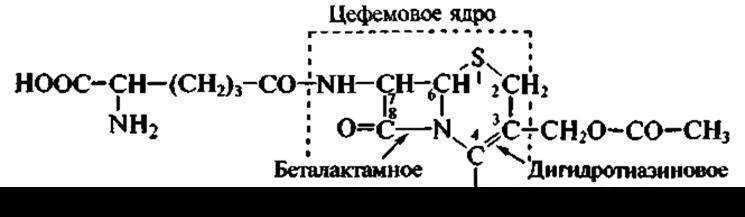
У пенициллинов с беталактамной структурой сконденсировано пятичленное кольцо, содержащее серу, а у цефалоспоринов — шестичленное. К грибам относится продуцент еще одного антибиотика, применяемого в медицинской практике. Представитель рода Fusidium, а именно Fusidium coccineum, образует антибиотик стероидной структуры — фузидиевую кислоту:
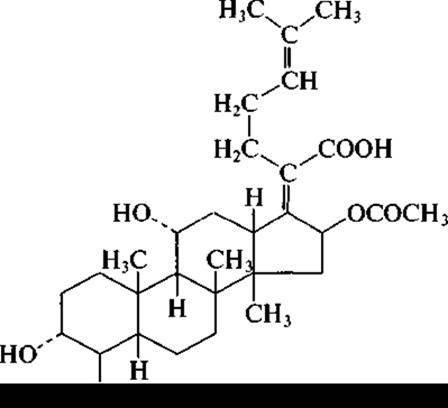
Необходимо отметить еще один ценный лекарственный препарат, образуемый грибами. На рубеже 1970—1980-х гг. из гриба рода Tolypocladium был выделен циклопептид, проявлявший слабую антимикробную активность, поэтому «забракованный» как антибиотик. Однако он оказался высокоэффективным в качестве иммуносупрессора. Циклопептид, получивший название циклоспорин (точнее циклоспорин G), широко используется при пересадке органов и тканей, а также при лечении некоторых аутоиммунных заболеваний.
Название «актиномицеты» отражает распространенное ранее неправильное представление об этих микроорганизмах как о лучистых грибах.
Установлено, что актиномицеты стоят гораздо ближе к бактериям, чем к грибам. Они являются прокариотами. Их геном не заключен в ядро, а представляет кольцевую хромосому, не отделенную от цитоплазмы ядерной мембраной.
Клетки актиномицетов не содержат также и митохондрий. Их клеточная стенка построена из гетерополимера — пептидогликана. Все это сближает актиномицеты с бактериями. Однако актиномицеты в отличие от «истинных» бактерий (эубактерий) являются многоклеточными организмами со сложным циклом развития, обычно за 5 —6 сут. Актиномицеты образуют спороносны и споры.
Актиномицеты являются продуцентами огромного количества (около 4000) разнообразных антибиотиков.
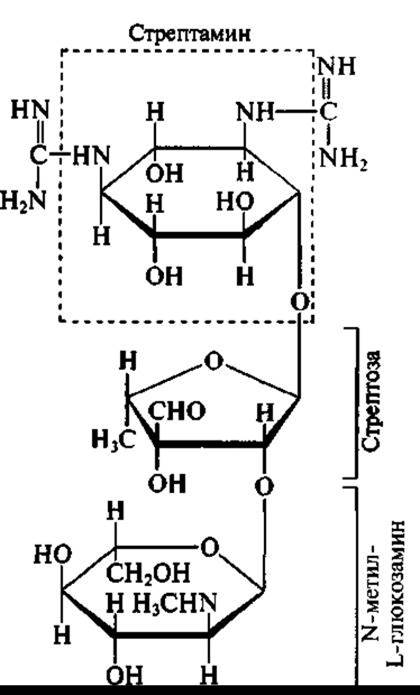
Актиномицетами образуется большинство антибиотиков, применяемых в медицинской практике. Ряд видов, относящихся к родам Streptomyces и Micromonospora, образуют (например, Streptomyces griseus и Micromonospora purpurea) антибиотики аминогликозидной структуры, к которым принадлежат: стрептомицин, гентамицин, неомицин, канамицин и ряд других антибиотических веществ с широким спектром антибактериального действия, получивших широкое распространение в клинике.
Как видно из структурных формул двух представителей аминогликозидов — стрептомицина:
и гентамицина (под последним названием промышленностью выпускается не индивидуальное вещество, а комплекс трех близких веществ — гентамицина С1, гентамицина С1а, гентамицина С2):
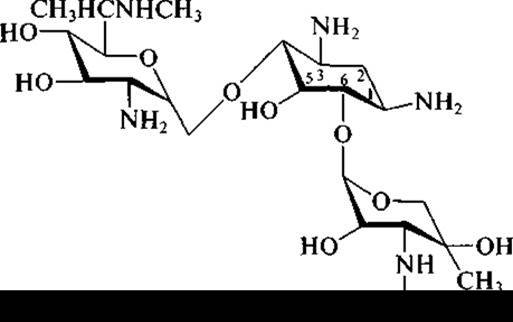
в молекуле аминогликозидов обязательно присутствуют:
✵ остаток щестичленного аминоциклитола;
✵ остатки сахаров и/или аминосахаров.
Кроме природных аминогликозидов в медицинской практике в настоящее время используются и полусинтетические аминогликозидные антибиотики, т.е. продукты химической модификации природных аминогликозидов.
Виды, относящиеся к роду Streptomyces (Streptomyces aureofaciens, Streptomyces rimosus и др.), образуют широко известные антибиотики тетрациклиновой структуры — тетрациклин:
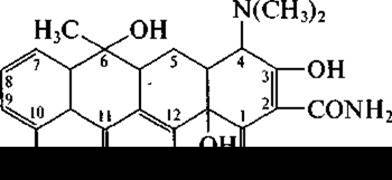
хлортетрациклин (при С7—Сl), окситетрациклин (при С5—ОН).
Все они близки по спектру антибактериального действия, все всасываются при приеме внутрь, однако некоторыми преимуществами (лучшей переносимостью) обладает тетрациклин. Как видно из их формул, они содержат структуру из четырех циклов и разнятся только по «верхней», но не по «нижней» периферии молекулы.
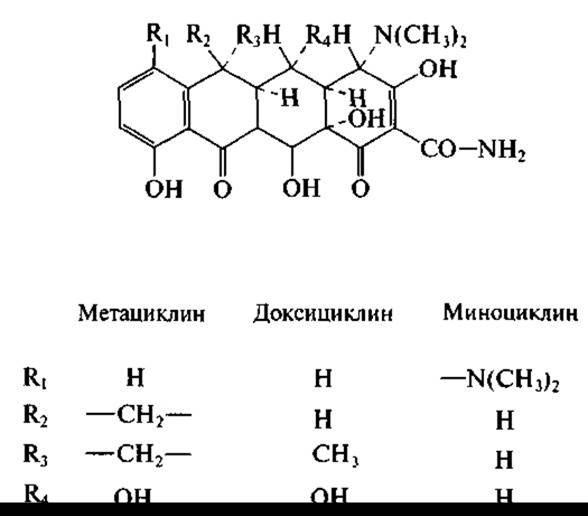
Верхняя периферия тетрациклиновой молекулы была модифицирована химическим путем, что позволило получить полусинтетические тетрациклины — доксициклин, миноциклин и метациклин (первый из них длительно циркулирует в крови, второй обладает повышенной антибактериальной активностью):
Широко известны образуемые актиномицетами антибиотики макролидной структуры, содержащие макроциклическое лактонное кольцо и сахара и/или аминосахара. В частности, к ним относится эритромицин А (продуцент Streptomyces erythraeus):
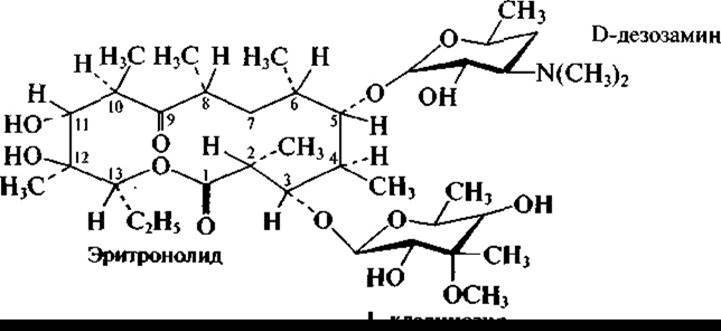
и близкий к нему олеандомицин, образуемый Streptomyces antibioiticus:
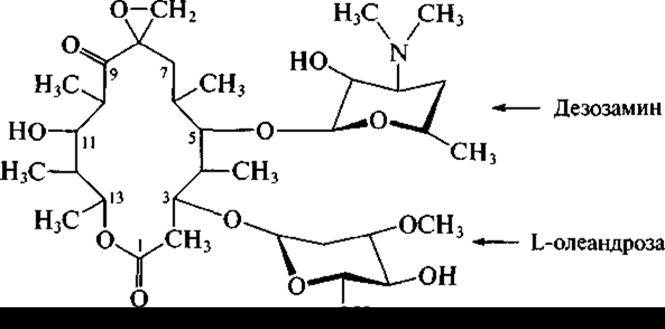
Эти антибиотики хорошо всасываются при приеме внутрь. Они высокоэффективны только против грамположительных бактерий, так как являются антибиотиками узкого спектра действия.
Из актиномицета, первоначально названного Streptomyces mediterranei, а позднее отнесенного к виду Nocardia mediterranea, выделены антибиотики сложной анзамициновой структуры. У них имеется нафталиновое «ядро» и длинная алифатическая цепь, соединенная с ароматической частью эфирной и амидной связями. Наибольшую известность из них получил рифампицин, или рифампин, который является, однако, полусинтетическим антибиотиком:
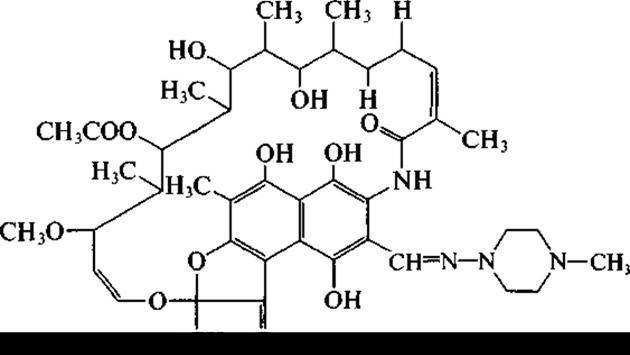
Рифампицин успешно применяется в лечении туберкулеза. Акта но минеты, помимо антибактериальных антибиотиков, образуют также и антибиотики, подавляющие рост грибов и дрожжей, в том числе патогенных. Представители рода Streptomyces, например, Streptomyces nourasei, являются продуцентами противогрибковых антибиотиков, относящихся к полиеновым макролидам. Макроциклическое лактонное кольцо содержит у этих антибиотиков ряд сопряженных двойных связей. Наиболее известны амфотерицин В (гептаен):
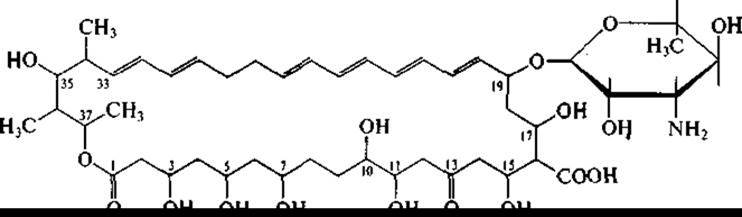
и нистатин (тетраендиен):
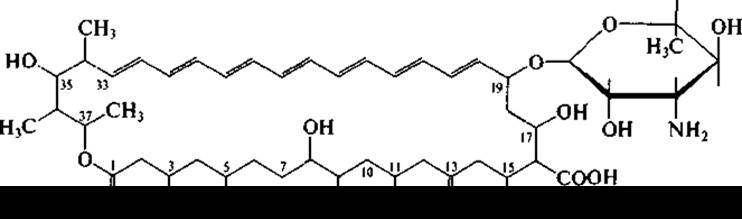
В молекулу полиеновых антибиотиков входят и аминосахара. Полиеновые антибиотики широко известны в медицинской практике. Вследствие их высокой токсичности полнены применяются в основном наружно или перорально.
Нередко при пероральном применении их используют вместе с антибактериальными антибиотиками для того, чтобы предотвратить быстрое размножение дрожжей после подавления роста бактерий. Актиномицеты образуют ряд противоопухолевых антибиотиков. Из них свыше десяти нашли применение при лечении некоторых форм рака. Так, Streptomyces verticillius образует антибиотик блеомицин сложного гликопептидного строения. Наиболее важной в настоящее время считается группа антрациклинов, к которой принадлежат дауномицин (R1 = R2 = СН3), адриамицин (R1 = СН3; R2 = СН2ОН), карминомицин (R1 = Н; R2= СН3):
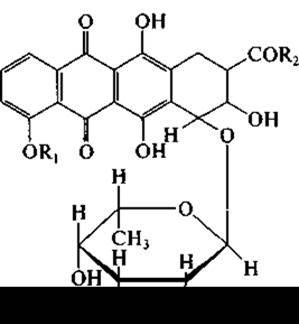
и их полусинтетические производные. Продуцентами антрациклинов являются разные виды рода Streptomyces.
Как видно из приведенной формулы, антрациклины содержат структуру частично сходную с таковой у тетрациклинов, а также остаток аминосахара. Однако ни по спектру антибиотического действия, ни по областям применения в клинике антрациклины и тетрациклины не сходны.
Аэробные спорообразующие грамположительные бактерии (бациллы) относятся к собственно бактериям. Как и все бактерии, они не имеют ядра. Их кольцевая хромосома имеет меньшие размеры, чем у актиномицетов. Их геном соответственно более прост, т.е. содержит меньшее, чем у актиномицетов количество генов, и тем более, у грибов. Бактерии не имеют митохондрий. Их клеточная стенка близка по составу к клеточной стенке актиномицетов и состоит из пептидогликана. Жизненный цикл бактерий значительно короче жизненного цикла грибов и актиномицетов — около полутора суток.
Открыто более тысячи антибиотиков бактериального происхождения. Большинство из них представлены пептидами и циклопептидами. Еще во время Второй мировой войны был внедрен в лечебную практику (для обработки ран) циклический декапептид — грамицидин С:
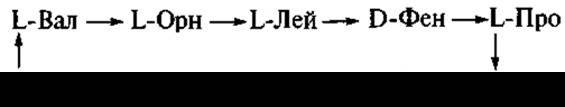
Продуцентом антибиотика является Bacillus brevis.
Как видно из приведенной формулы, кроме L-аминокислот (валина, орнитина, лейцина, пролина), антибиотик содержит также и D-фенилаланин.
Позднее из другого вида почвенных споровых бактерий (Bacillus polymyxa) был выделен также нашедший применение в медицинской практике антибиотик полимиксин В — представитель ряда полимиксинов, в который входят свыше 20 соединений, разнящихся по отдельным аминокислотным остаткам, а также по входящему в их молекулу остатку жирной кислоты. В структуре полимиксина В присутствуют три фрагмента: циклопептид, линейный три пептид, остаток 6-метил октановой кислоты (непептидная часть молекулы):
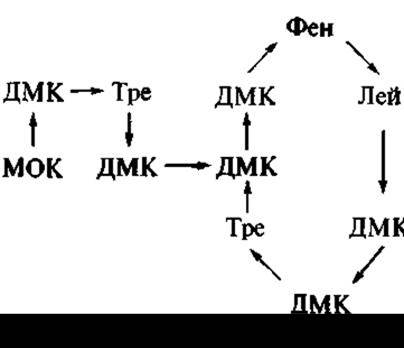
Здесь ДМК — остаток а,у-диаминомасляной кислоты; МОК — остаток 6-метилоктановой кислоты.
В отличие от грамицидина полимиксин В используется не только для местного, но и для внутримышечного введения. В целом антибиотики, образуемые почвенными споровыми бактериями, не столь разнообразны, как антибиотики актиномицетов, и в медицинской практике они играют меньшую роль.